Depuis quelques jours, notre pays est littéralement sidéré par des règles de confinement imposées par le gouvernement, prenant la mesure d’une pandémie pourtant annoncée par l’OMS depuis près d’un mois. Nos malades, paniqués par des informations parfois contradictoires, nous bombardent incessamment de questions concernant cette infection et les risques spécifiques que font courir leur pathologie et leur traitement. Nous vous proposons de faire le point actuel sur cette épidémie de COVID-19, en étant très conscients que l’état de connaissance bouge très rapidement, ce qui imposera certainement des mises à jour rapides.
Qu’est-ce que le COVID-19 ?
Les premiers cas
COVID signifie COrona Virus Infectious Disease 19 pour 2019. Ce nom désigne une épidémie de pneumonies apparue en décembre 2019 à Wuhan, capitale de la province du Hubei, douzième ville la plus peuplée de Chine, qualifiée de Chicago du pays : une ville moderne, plaque tournante du transport intérieur du pays, carrefour de chemins de fer, d’autoroutes, plus grand port fluvial… C’est ici qu’apparaît le premier cas de pneumonie sévère de cause inconnue, le 8 décembre. Quelques semaines plus tard, le 27 décembre, plusieurs cas de pneumonie atypique sévère sont déclarés au CDC (Center for Disease Control) local. Le 31 décembre, les médecins de Wuhan déclarent à l’OMS un premier cluster de cette pneumonie, et l’on relève une caractéristique commune des premiers cas décrits : ils ont fréquenté un marché aux poissons et aux animaux vivants.
Le SARS-CoV-2 : une pandémie
Le 7 janvier 2020, le pathogène est identifié. Il s’agit d’un nouveau coronavirus : le SARS-CoV-2, deuxième coronavirus identifié en Chine susceptible d’être responsable d’un syndrome de détresse respiratoire aigu (SRAS). Le docteur Li Wenliang (qui décédera lui-même de l’infection quelques semaines plus tard) alerte les autorités chinoises sur l’urgence de mesures politiques. Une première alerte est lancée par l’OMS le 30 janvier : 7 736 cas confirmés, dont 170 décès, et 82 cas confirmés en dehors de la Chine. Un mois plus tard, on comptabilise 74 635 cas confirmés en Chine, conduisant à 3 300 décès, et 1 073 cas en dehors de la Chine, dont 8 décès (1). Depuis, la maladie s’étend progressivement dans le monde entier, permettant de parler d’une véritable pandémie.
Que sont les coronavirus ?
Des virus enveloppés
Les coronavirus sont un groupe de virus dits enveloppés, qui comportent, une membrane constituée d’une bicouche lipidique (comme nos cellules) abritant une capside glycoprotéique renfermant le génome viral. Diverses protéines sont portées par la membrane lipidique, dont la protéine S qui forme une couronne (d’où le nom de coronavirus), cette protéine S permettant la fixation du virus sur la membrane de la cellule hôte (Fig. 1). Ce sont des virus à ARN simple brin sens positif (c’est-à-dire qu’il est directement traduit en protéine par les ribosomes de la cellule infectée).
Les familles de coronavirus humains
Il existe plusieurs familles de coronavirus humains, faiblement pathogènes (HCoV-229E, HCoVHKU1, HCoV-OC43 et HCoV-NL63), responsables de 10 à 30 % de nos infections des voies aériennes supérieures : ce sont les agents de nos rhumes hivernaux classiques.
Deux épidémies récentes
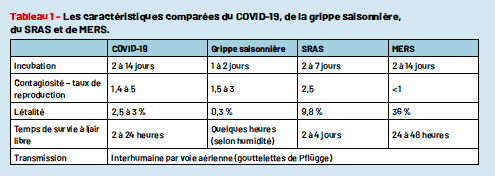
Mais cette famille de virus est tristement célèbre pour deux épidémies récentes liées à deux coronavirus hautement pathogènes : le SARS-CoV et le MERS-CoV. Le SARS-CoV est l’agent du SRAS, responsable d’une épidémie apparue en Chine en 2002, ayant touché 8 000 personnes et responsable de la mort de 800 d’entre elles. Le MERS-CoV, quant à lui, est apparu au Moyen-Orient (Arabie Saoudite et Qatar), touchant 1 219 patients dont 449 sont morts (Tab. 1). On a pu démontrer que, dans les deux cas, le réservoir du virus était des chauve-souris, l’hôte intermédiaire (avant de contaminer l’Homme) étant la civette pour le SARS-CoV et le dromadaire pour le MERS-CoV. Dans les deux cas, les mesures rapides d’isolement et de quarantaines des sujets infectés avaient permis d’enrayer l’épidémie. Le SARS-CoV-2 est relativement proche du SARS-CoV. En effet, leurs protéines S partagent 99 % d’homologie, et ont le même site de liaison : l’enzyme de conversion de l’angiotensine 2 (ACE2) (2). La caractéristique commune de ces trois coronavirus très pathogènes est un transfert récent de l’animal à l’Homme. On suspecte que, pour le SARS-CoV-2, le réservoir est également la chauve-souris, et l’hôte intermédiaire probablement le pangolin, un mammifère vendu sur le marché de Wuhan pour sa chair délicate et les vertus médicinales de ses écailles.
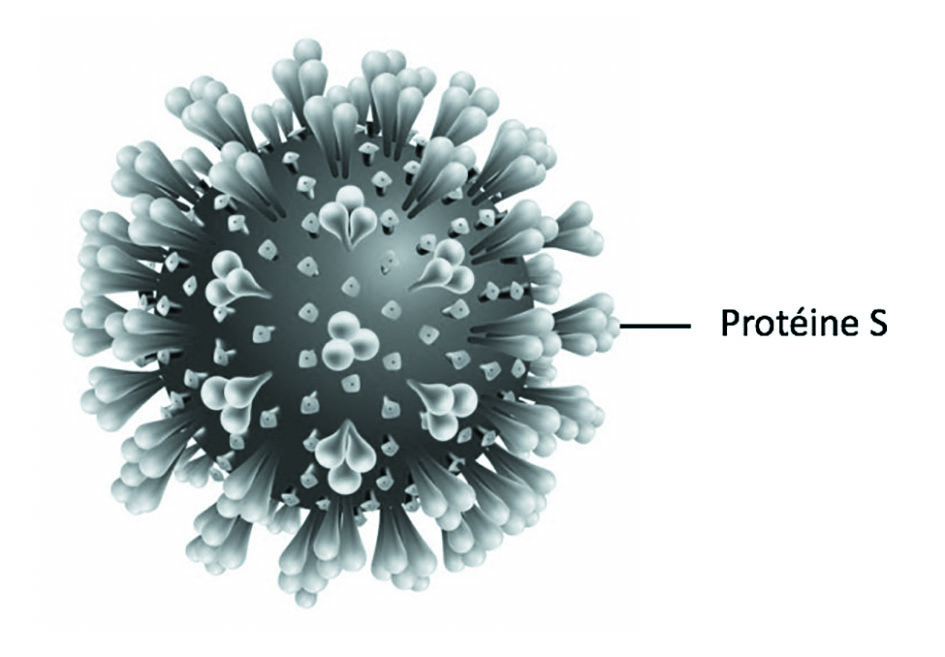
Figure 1 – Le virus SARS-CoV-2, agent du COVID-19.
Comment se développe l’infection chez l’Homme ?
Le virus pénètre par les voies aériennes supérieures. Il adhère à la surface des cellules en se fixant sur le récepteur reconnu par sa protéine S : l’angiotensine 2. Une fois fixé sur son récepteur, un mécanisme d’endocytose permet au virus d’intégrer la cellule. La vésicule d’endocytose se lie à un lysozyme primaire dont les enzymes vont hydrolyser la capsule virale, libérant l’ARN viral qui utilise la machinerie cellulaire pour se répliquer et synthétiser de nouvelles protéines d’enveloppe. Les nouvelles particules virales s’assemblent dans l’appareil de Golgi pour être ensuite excrétées en dehors de la cellule (3) (Fig. 2).
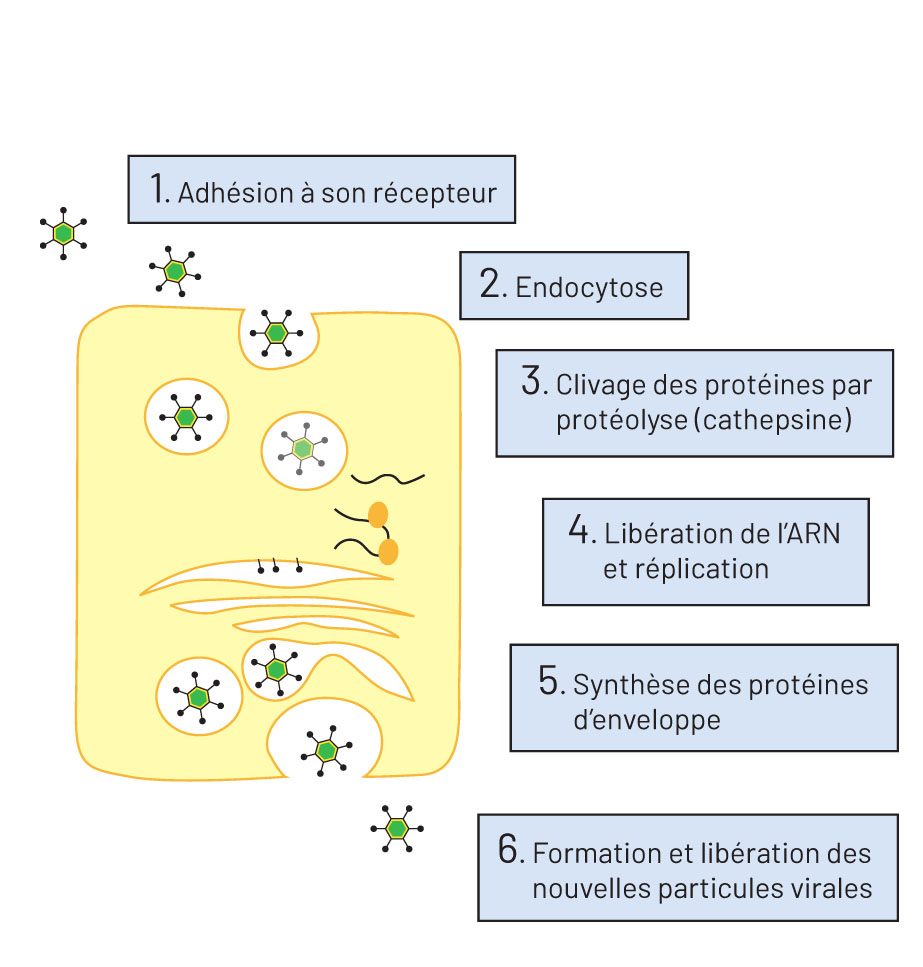
Figure 2 – Le développement du virus chez l’Homme.
Quels sont les symptômes de la maladie ?
L’analyse des premières séries de patients, puis de plus de 72 000 cas déclarés en Chine, permet une description très précise de la maladie (1, 4).
Caractéristiques des patients
La grande majorité des patients (87 %) ont entre 30 et 80 ans. Seuls 2 % ont moins de 20 ans, 8 % entre 20 et 30 ans et 3 % plus de 80 ans. Une légère prédominance masculine (54 %) est notée.
Symptômes rapportés
Les symptômes rapportés sont, par ordre de fréquence : une fièvre (99 % des patients), une fatigue (70 %), une toux sèche (60 %), une anorexie (40 %), des myalgies (35 %), une dyspnée (31 %), des expectorations (27 %), des douleurs pharyngées (17 %), des diarrhées (10 %), des nausées (10 %), et plus rarement des douleurs abdominales et des céphalées. Il s’agit donc, pour simplifier, d’un syndrome grippal sévère avec une apparition rapide de signes respiratoires plus marqués. Sur le plan biologique, une leucopénie a été constatée chez 60 % des patients.
Types d’atteinte
Quatre-vingt-un pour cent des patients ont présenté une atteinte modérée (avec ou sans pneumonie), 14 % une forme sévère, et une forme critique (nécessitant une prise en charge en réanimation) a été observée dans 5 % des cas. Le taux de mortalité a été de 2,3 % (près de la moitié des formes critiques), ce taux parvenant à près de 15 % chez les patients de plus de 80 ans et 8 % pour les patients de 70 à 80 ans. Le taux de professionnels de santé infecté a été de 3,8 % dans l’ensemble, 63 % pour la ville de Wuhan, dont 15 % de formes sévères ou critiques et 5 % de décès.
Caractéristiques des formes sévères et de la pneumonie du COVID-19
L’infection évolue vers la constitution d’une pneumonie dans près de 80 % des cas, le plus souvent entre la deuxième et la troisième semaine après les premiers symptômes. Cette pneumonie se traduit par une dyspnée, une toux sèche au début, puis productive, des troubles respiratoires sévères dans près de 20 % des cas, dont 3 % de syndrome de détresse respiratoire aiguë (5). Cette pneumonie se traduit au scanner thoracique par des images de condensation en verre dépoli, parfois présentes avant l’apparition des manifestations respiratoires, uni ou bilatérales, qui s’étendent rapidement à l’ensemble des deux champs pulmonaires dans les formes sévères. Plus tardivement, ces lésions évoluent vers la formation d’épaississements interlobulaires, de nodules, de la formation de kystes, de bronchectasies, d’épaississements et d’épanchements pleuraux (6) (Fig. 3). D’autres complications sévères ont été décrites : choc septique, acidose métabolique, syndromes hémorragiques et troubles de la coagulation.
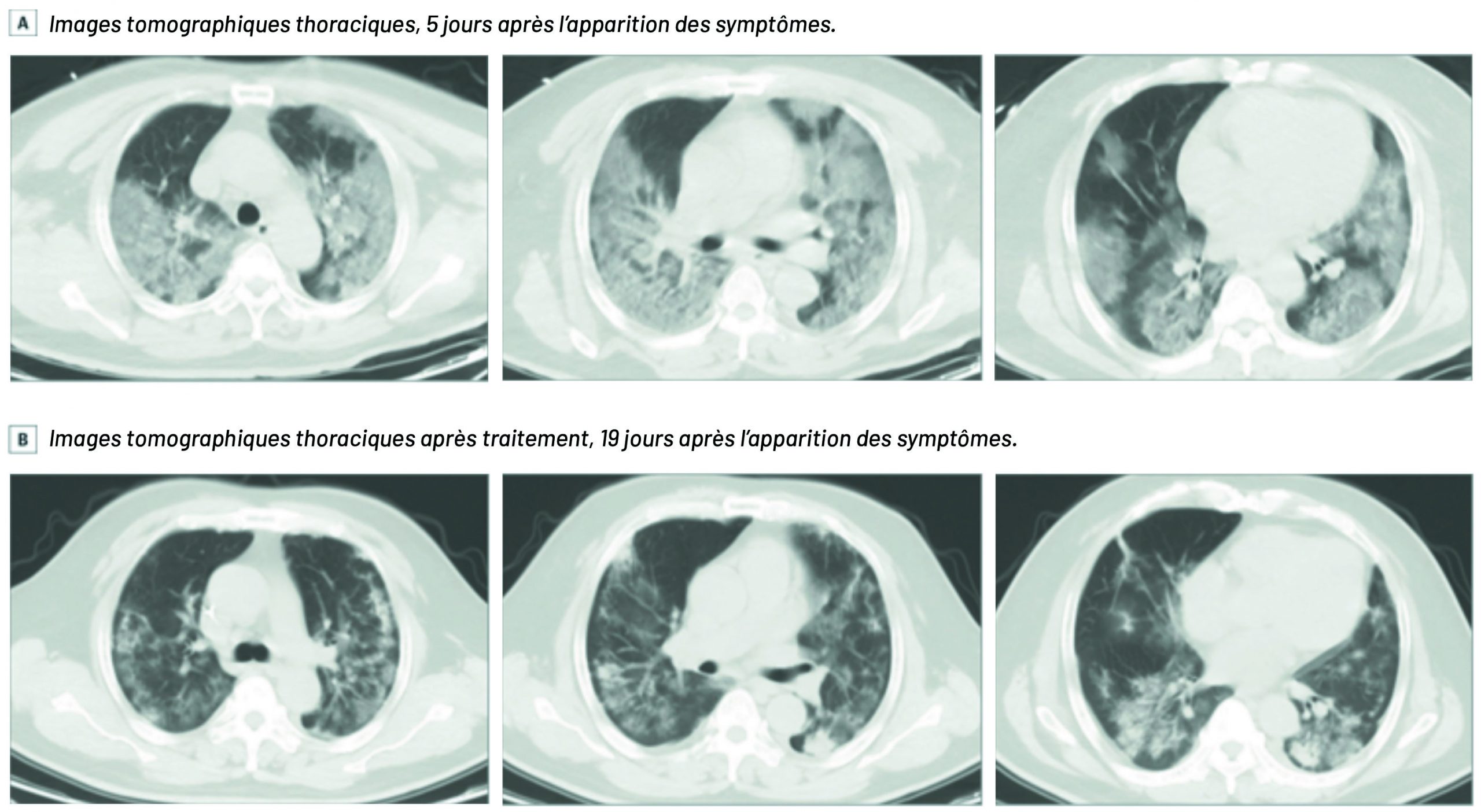
Figure 3– Caractéristiques de la pneumonie COVID au scanner (6).
Quels sont les sujets à risque de formes sévères ?
Les sujets âgés
Les sujets à risque sont donc essentiellement les sujets âgés de plus de 70 ans.
Certaines maladies chroniques
D’autres facteurs de risque ont été identifiés, parmi lesquels certaines maladies chroniques : les maladies cardiovasculaires (10,5 % de mortalité), le diabète (7,3 %), les pathologies respiratoires chroniques – BPCO, asthme, pneumopathie interstitielle – (6,3 %), l’hypertension (6 %) et les cancers (5,6 %). Ces maladies à risque reflètent peut-être la distribution de l’ACE2 dans l’organisme : coeur, rein, cellules alvéolaires du poumon, testicules, cerveau, îlots pancréatiques dans le diabète de type 2.
Cancers
D’un part, il a été rapporté un risque de détresse respiratoire et de décès plus important en cas de cancer par rapport au reste de la population concernant la grippe saisonnière (7). S’agissant du COVID-19, d’après les données initiales chinoises, le taux de mortalité serait inférieur à 2 %, mais avec une grande hétérogénéité (mortalité supérieure chez les patients les plus âgés et/ou avec comorbidités). Le taux d’infection semble plus important (1 vs. 0,29 %) que dans la population générale. Parmi les patients infectés, le risque de faire des complications respiratoires sévères imposant une prise en charge en réanimation était plus élevé que chez les patients non ateints de cancer (39 vs. 8 %, p = 0,0003). Un antécédent de chimiothérapie ou de chirurgie dans les mois précédents était un facteur pronostique important de développer des complications respiratoires sévères (OR = 5,34 ; p = 0,0026). De même, la vitesse de détérioration respiratoire était plus rapide de 13 versus 43 jours (HR = 3,56, IC 95 % [1,65-7,69]) (8).
Maladies inflammatoires de l’intestin
Une autre donnée mérite d’être rapportée : les observations restituées par les gastro-entérologues chinois concernant les patients atteints de maladies inflammatoires de l’intestin qui reçoivent fréquemment des agents immunosuppresseurs, dont des biothérapies, à l’instar de nos patients. Au sein des sept centres de gastro-entérologie les plus importants de Chine, concentrant plus de 20 000 patients présentant une MICI, dont les trois principaux centres de Wuhan, aucun cas d’infection avérée par le SARS-CoV-2 n’a été rapporté, notamment aucun patient sous biothérapie (9).
Mode de transmission et délai d’incubation de l’infection
La transmission interhumaine du virus se fait essentiellement par voie aérienne (gouttelettes de Pflügge), ou par contact cutané après toux ou éternuement. Une transmission fécale serait également possible. La contagiosité (taux de transmission) est estimée entre 1,4 et 5 sujets à partir d’une personne infectée. Si la transmission se fait le plus souvent pendant la phase symptomatique de l’infection, de nombreuses observations montrent qu’elle peut s’effectuer avant l’apparition des premiers symptômes (10), et qu’elle peut également se faire à partir de porteurs sains (11, 12). Le risque de transmission par des porteurs sains demeure encore mal évalué. Enfin, il n’est pas inutile de rappeler que, dans les premières séries rapportées, près d’un tiers des patients ont été contaminés à l’hôpital ou dans un centre de soins (4).
Les enfants et les sujets jeunes sont-ils protégés du COVID-19 ?
Nous avons vu que les observations chez les enfants de moins de 10 ans sont rares (inférieures à 1 %), à peine plus élevées dans la deuxième décennie (1,2 %), pour atteindre 8 % des cas décrits au cours de la troisième décennie. Cette protection relative des jeunes enfants avait déjà été notée au cours de l’épidémie de SRAS en 2002, et pourrait s’expliquer par l’effet partiellement immunisant des multiples infections à coronavirus peu pathogènes durant l’enfance. D’autres ont évoqué l’influence de la persistance du thymus chez les plus jeunes.
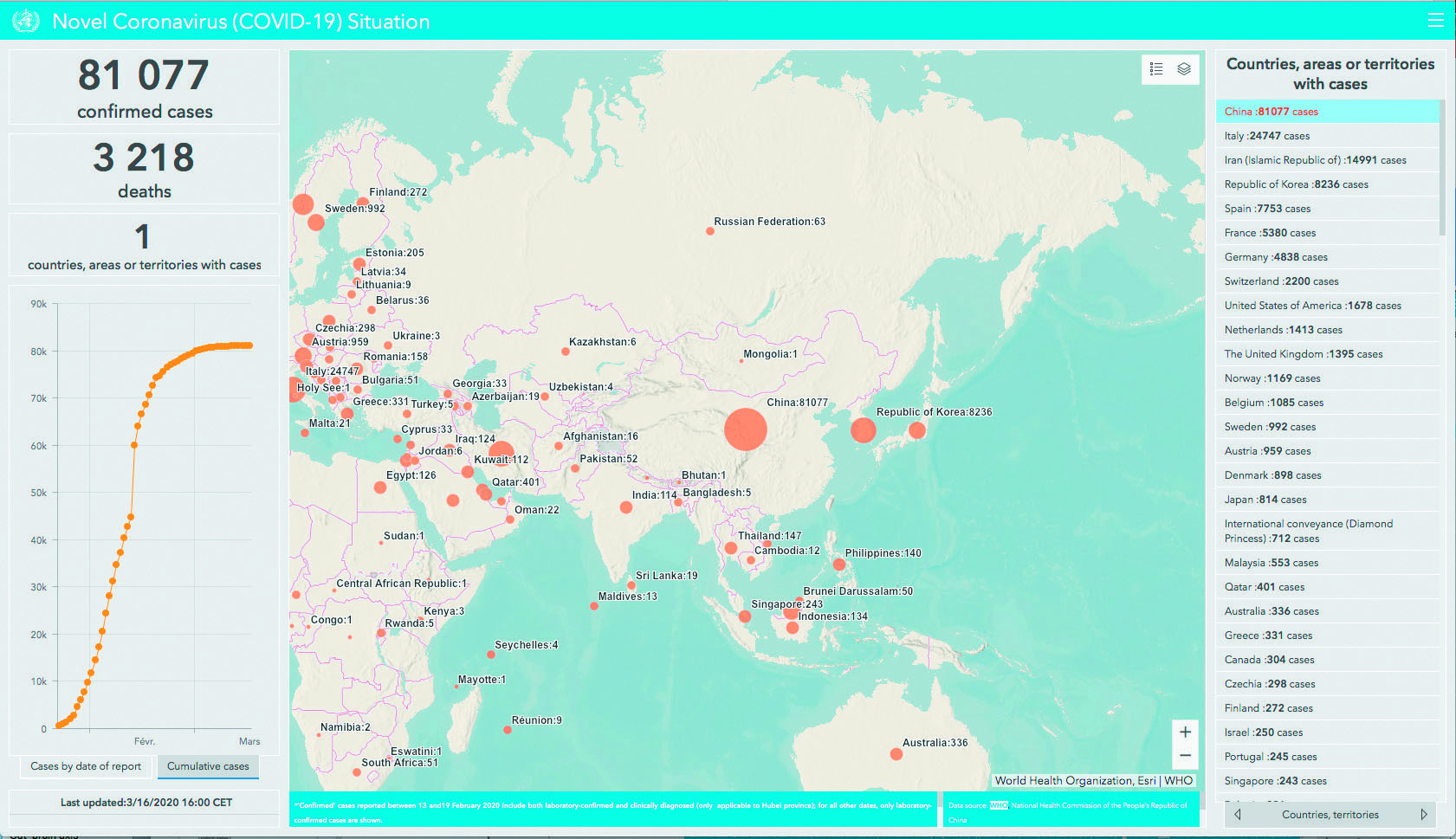
Figure 4 – L’épidémie maîtrisée en Chine. Notez l’inflexion brutale de la courbe de cas cumulés après la mise en place des mesures de confinement (données OMS).
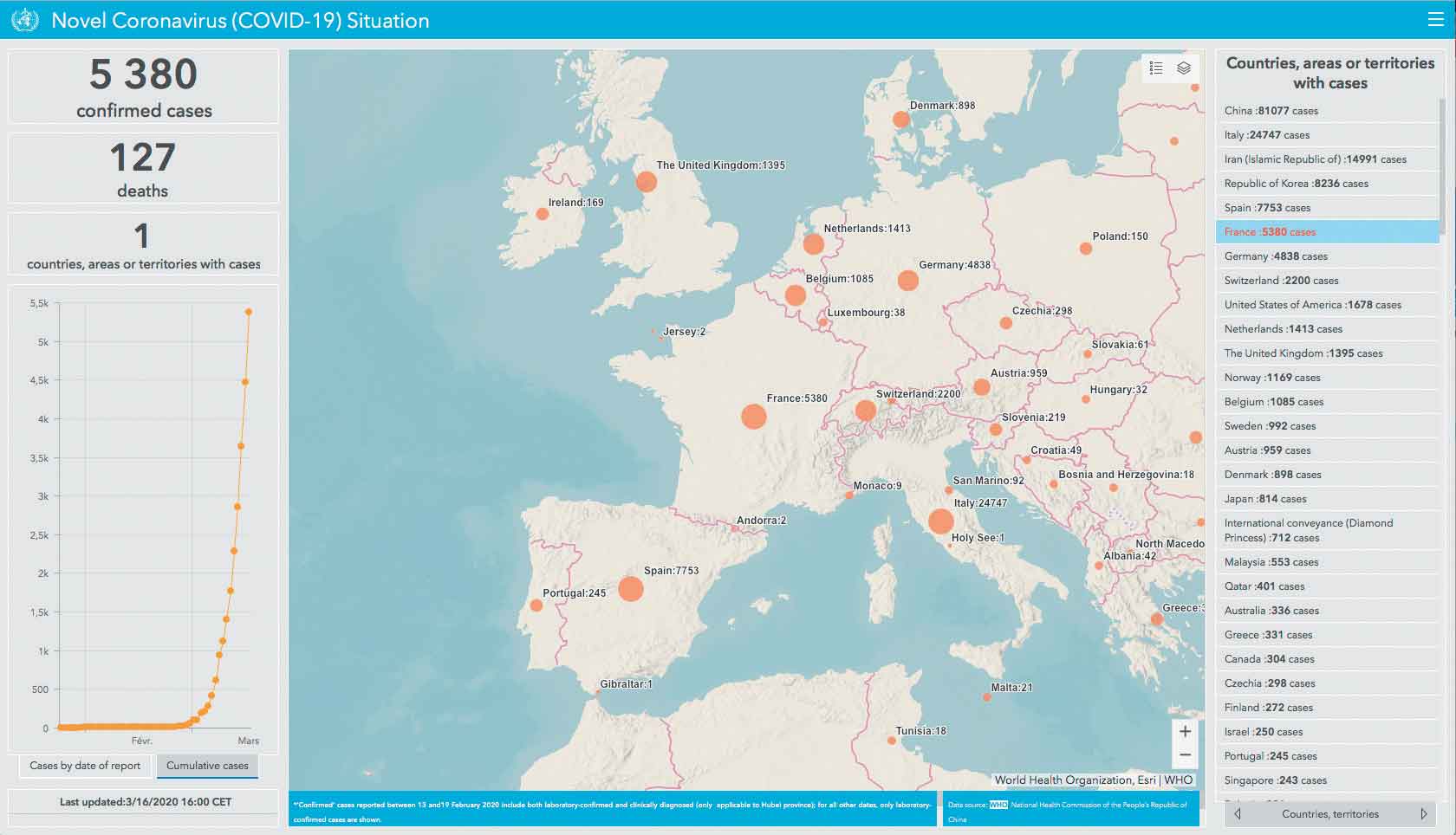 Figure 5 – L’épidémie de COVID-19 en France, au 16 mars 2020 (données de l’OMS). Nous sommes en pleine phase ascendante.
Figure 5 – L’épidémie de COVID-19 en France, au 16 mars 2020 (données de l’OMS). Nous sommes en pleine phase ascendante.
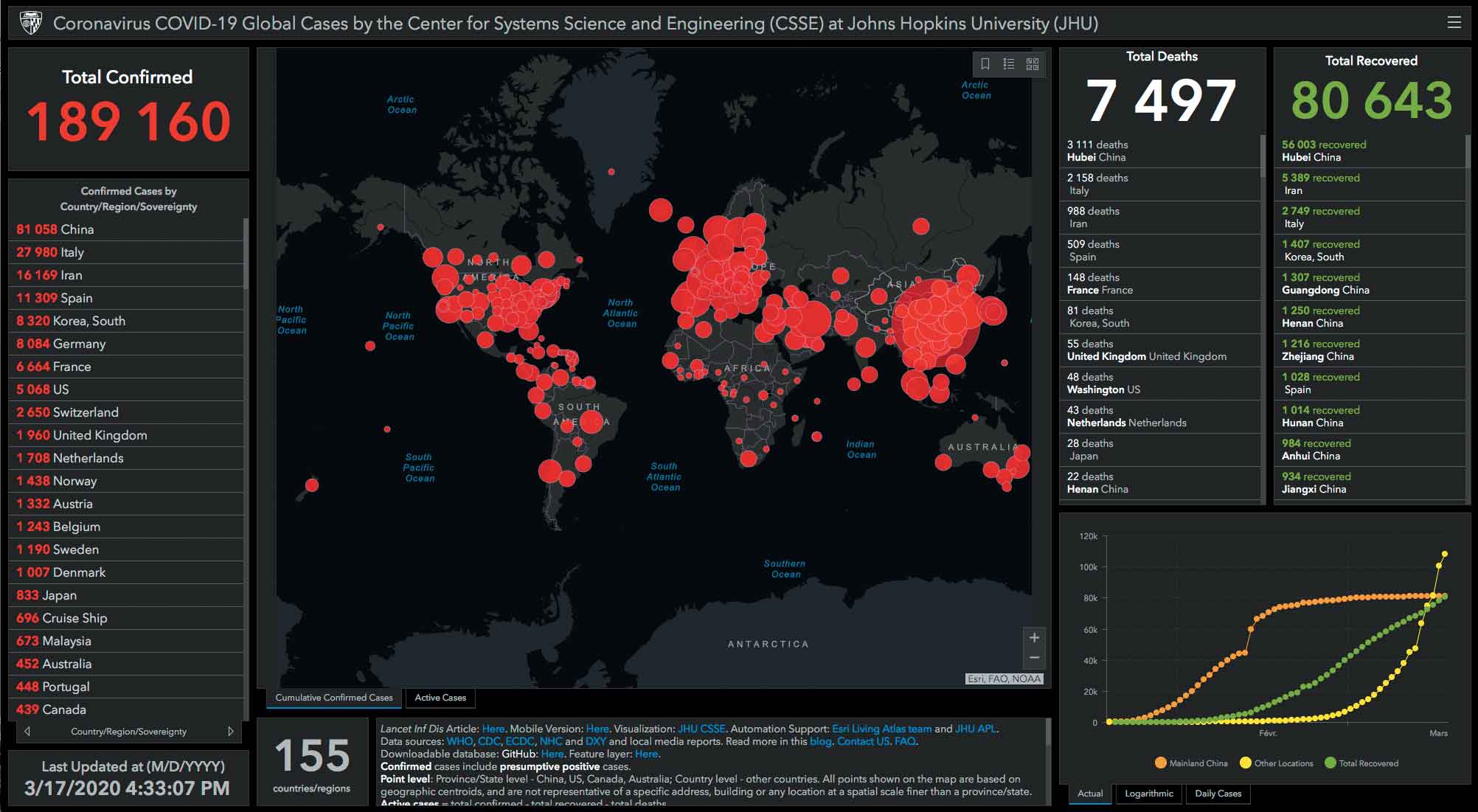
Figure 6– Distribution de la pandémie de coronavirus dans le monde. Données du John Hopkins Hospital. L’Europe est clairement le second foyer majeur de l’infection (17/03/2020).
Les traitements du COVID-19
Le COVID-19, comme le SRAS, induit une réponse inflammatoire exubérante qui se traduit par une détresse respiratoire dans les formes sévères (SDRA). Cette réponse inflammatoire et la sévérité des symptômes ne sont pas corrélées à la charge virale.
Mesures de réanimation, traitements anti-viral et anti-inflammatoires
Le traitement comprend des mesures de réanimation, essentiellement une oxygénothérapie, un traitement antiviral et l’utilisation de traitements anti-inflammatoires, depuis les corticoïdes jusqu’à des biothérapies (notamment les inhibiteurs de l’IL-6) pour traiter l’orage cytokinique. Parmi les antiviraux, le remdésivir paraît être le plus actif (13).
Chloroquine et hydroxychloroquine
D’autres stratégies thérapeutiques ont été suggérées ou proposées, dans l’espoir de limiter la diffusion ou la réplication du virus. Parmi ces traitements, on peut citer la chloroquine et l’hydroxychloroquine. Des études in vitro ont montré que ces molécules, en alcalinisant la vacuole d’endocytose contenant les particules virales, inhibent la protéolyse de capside virale et la libération de l’acide nucléique. Ce traitement a déjà été proposé dans d’autres viroses, notamment le Zika (14), mais nous manquons d’études cliniques sérieuses pour confirmer son intérêt dans le COVID.
Inhibiteurs de JAK
D’autres molécules d’intérêt pourraient être les inhibiteurs de JAK. L’endocytose qui permet d’intégrer les particules virales dans les cellules fait intervenir des régulateurs de kinase, AAK1 et GAK. Le screening de potentiels inhibiteurs de ces molécules par un logiciel d’intelligence artificielle a permis de retenir trois molécules d’intérêt : le baricitinib, le febratinib et le ruxolitinib (15). Le meilleur inhibiteur semble être le baricitinib, qui aurait de plus l’intérêt d’avoir une action anti-
inflammatoire puissante susceptible de participer au contrôle du SRAS. Là encore, nous manquons d’études cliniques pour confirmer l’intérêt de ces molécules en pratique.
Autres stratégies
D’autres stratégies sont à l’étude : des vaccins bien sûr (16), mais également l’utilisation d’inhibiteurs de l’ACE2 ou d’ACE2 soluble pour prévenir la fixation du virus sur son récepteur (17).
À quoi devons-nous nous attendre dans les prochaines semaines ?
L’exemple de la Chine
La Chine a mis 3 semaines à réagir aux alertes du Dr Li Wenliang et de ses collègues, mais les mesures draconiennes de confinement de la population ont permis d’enrayer la progression de l’épidémie, qui paraît désormais totalement maîtrisée sur son territoire (Fig. 4). Le bilan est cependant lourd : 81 000 cas confirmés et 3 218 patients décédés, pour 1,44 milliard d’habitants.
L’exemple de la Corée
Les mesures de confinement très strictes prises immédiatement en Corée du Sud ont permis d’enrayer rapidement l’épidémie : 8 236 cas confirmés, 75 décès pour une population de 51 millions d’habitants.
L’exemple de l’Italie
Plus près de nous, l’Italie, qui a tardé à mettre en oeuvre ce type de mesure, connaît un bilan terrifiant avec 24 747 personnes infectées et 1 809 décès au 16 mars 2020, pour 60 millions d’habitants, et l’épidémie est toujours pleinement active. La rapidité de la diffusion de l’épidémie aboutit à un afflux massif de patients dans les hôpitaux, les unités de réanimation sont totalement débordées et un tri dramatique doit être fait à l’arrivée des patients.
En France
Nous semblons malheureusement suivre la même direction. Les mesures de confinement viennent juste d’être annoncées, moins strictes qu’en Chine où le confinement a mis plus de 10 jours à produire ses effets. Au rythme actuel de l’épidémie, le nombre de sujets infectés double toutes les 72 heures. Au moment d’écrire ces lignes, nous en sommes officiellement à 6 610 cas confirmés et 148 décès. Tout le monde n’est pas diagnostiqué, il y a des formes paucisymptomatiques, des porteurs sains. Le chiffre de 10 000 sujets contaminés est donc réaliste. S’il faut 10 jours pour que le confinement produise ses effets, le doublement de ce chiffre toutes les 72 heures nous projette à 100 000 personnes. Cinq pour cent de cette population en réanimation représente donc 25 000 patients en urgence absolue (Fig. 5). Nous disposons de 5 300 lits de réanimation à l’échelon national. Nous apprenons déjà que les services de réanimation du Grand Est de la France sont au bord de la rupture…
 Une crise du monde hospitalier
Une crise du monde hospitalier
Cette crise sanitaire majeure arrive alors que nous traversons une crise sans précédent du monde hospitalier, et dans la santé en général. La gestion comptable que subit l’hôpital public depuis l’avènement de la T2A a abouti à une restriction importante du nombre de lits
(y compris en réanimation). L’inflation du personnel administratif se fait aux dépens des soignants. Nous croulons sous les agences : Drees, IRDES, HAS, HCAAM, DGS, DSS, DGOS, ANSM, ANSP, ANS… notre préférée est l’ANAP, l’Agence nationale d’appui à la performance. Cette dernière nous explique comment améliorer la gestion des lits, impose des ratios optimaux d’effectifs dans les services de soin, fixe les objectifs de taux d’occupation des lits : 92 % pour un service d’hospitalisation conventionnel, à peine moins pour un service de réanimation, 120 % de taux d’occupation de lits d’ambulatoire… Les soignants se sentent dévalorisés, perdus dans des charges administratives, la rédaction de documents assurant la traçabilité du moindre soin ou de la plus petite toilette. Que reste-t-il de la dimension sociale ? Du dialogue entre soignants et patients ? Quelle place pour la prévention, l’information ? La perte du sens de notre travail est catastrophique et aboutit à des démissions et une multiplication de postes non pourvus faute de candidats.
Une crise de la médecine de ville
La médecine de ville traverse une crise non moins sévère. Des années de numerus clausus (le terme a été supprimé, mais les possibilités de formation restent les mêmes… et donc le nombre d’étudiants n’évoluera pas beaucoup) ont abouti à une diminution de « l’offre » médicale, du nombre de médecins, à la désertification médicale dans les zones rurales et certaines zones péri-urbaines. C’est dans ce contexte que nos collègues généralistes vont subir une vague sans précédent d’appels en urgence, quasiment sans coordination. Imaginez la vie du généraliste depuis quelques jours, appelé constamment au chevet de patients inquiets, présentant des symptômes ORL ou grippaux particulièrement fréquents en cette saison, ne sachant que faire de leur traitement habituel, alors que circulent des informations contradictoires. Imaginez un généraliste appelé pour un infarctus du myocarde : il faut actuellement trois quarts d’heure pour parvenir à avoir en ligne le 15, la régulation du SAMU…
Nos concitoyens paieront peut-être très cher la guerre aux services publics que mènent nos gouvernements successifs depuis près de trois décennies.
Nous découvrons aussi notre dépendance économique dans ces périodes de confinement : nous ne sommes plus capables de produire nos médicaments. Même quand ils sont estampillés des grands noms de notre industrie pharmaceutique occidentale, 80 % des principes actifs viennent de pays tiers (60 % de Chine)… Le libéralisme économique sans limites et la mondialisation « heureuse » ont également peut-être vécu.
Encadré 2 – COVID-19 et cancers solides : synthèse des recommandations du Haut conseil de la santé publique.
Ces règles sont consultatives. La décision finale appartiendra au médecin référent des patients concernés et selon les spécificités locales, des établissements de soins et l’ARS.
Prévention de la contamination
- Impérativement éviter le contact de patients infectés avec des patients atteints de cancer.
- Favoriser le maintien à domicile et la télémédecine.
- Anticiper les stocks d’antiviraux à visée prophylactique.
- Privilégier les alternatives à l’hospitalisation conventionnelle (formes orales, HAD…).
- Limiter les hospitalisations dans les services d’oncologie et de radiothérapie pour les soins de support ou de confort (privilégier les autres structures de soins).
- Favoriser les pauses thérapeutiques en cas de cancer métastatique d’évolution lente.
- Prescrire la prophylaxie de la neutropénie fébrile par GCSF en cas de chimiothérapie associée à un risque de neutropénie fébrile ≥ 20 % ; l’étudier si entre 10 et 20 %, voire < 10 %, ainsi qu’en cas d’antécédent.
- S’assurer que les patients ne présentent pas de symptôme évocateur du virus, avant de les autoriser à venir dans le service oncologie ou radiothérapie.
- Éviter tout risque de contamination auprès des patients âgés (> 70 ans) et/ou porteurs de multiples comorbidités atteints de cancer.
Hiérarchisation des soins
Ces propositions ne s’appliquent pas aux patients pédiatriques et aux patients suivis en hématologie. • Prioriser les prises en charge des patients en traitement curatif selon les recommandations classiques, puis les prises en charge non curatives en début de traitement (1re ligne) ou chez les patients < 60 ans et/ou avec une espérance de vie est supérieure à 5 ans.
- Pour la chirurgie : limiter les temps d’hospitalisation, prioriser les populations et pathologies définies ci-dessus et déprogrammer les interventions non urgentes.
- Pour la radiothérapie curative : ajustements éventuels à discrétion du médecin référent.
- Pour la radiothérapie antalgique : renforcer au maximum le traitement antalgique et ajustements éventuels à discrétion du médecin référent (hypofractionnement notamment).
- Pour la chimiothérapie : privilégier la chimiothérapie à visée curative (pré ou post-opératoire) et éviter les protocoles hebdomadaires.
Organisation de la prise charge des patients par les établissements
Patients atteints de cancers non touchés par le virus, ou guéris : continuer les soins en prenant en compte les ajustements proposés ci-dessus.
Patients atteints de cancers infectés par le virus : sauf exception, arrêter les traitements oncologiques le temps de la prise en charge de l’infection virale. Si une hospitalisation est nécessaire, les patients seront pris en charge dans d’autres services de médecine impliqués dans la lutte contre le virus. Ils devront être prioritaires puisqu’ils sont plus à risque de développer des formes graves du virus.
Gestion des services d’oncologie et radiothérapie :
idéalement, aucun patient atteint du virus ne sera pris en charge dans ces services, le cas échéant, ils devront être isolés. En cas de personnel réduit, fonctionnement en mode « dégradé » adapté à l’organisation de chaque service.
L’ensemble des recommandations est consultable sur le site du Haut conseil de la santé publique.
Pour tous
- Évitez les déplacements, les rassemblements.
- Évitez les contacts (poignées de main, embrassades…).
- Lavez-vous fréquemment les mains (eau et savon) ou utilisez une solution hydroalcoolique.
- Surveillez votre température.
- Les patients les plus fragiles, notamment les plus de 70 ans, doivent restreindre drastiquement leurs interactions sociales et reporter les soins non urgents afin d’éviter les sorties et les salles d’attente.
Encadré 3 – Comment expliquer les variations importantes dans l’estimation de la mortalité ?
D’une publication à l’autre, d’un pays à l’autre, on observe une variabilité très importante du taux de mortalité. Même si l’on se restreint aux études chinoises, on constate que ce taux varie de 4 % pour la population de la région de Hubei (dont la capitale est Wuhan), à 0,84 % (18). Comment expliquer de telles différences ? Façon de comptabiliser les sujets infectés ? Mutations du virus avec des variants plus ou moins agressifs ?
Génétique du virus ?
Écartons d’emblée la question des mutations. Un travail a permis de comparer 86 génomes de souches du SARS-CoV-2 prélevées dans plusieurs pays du globe (19). Ce travail met en évidence pas moins de 93 mutations ! Délétions, substitutions… Ce virus est en train de passer de l’animal à l’Homme, le taux de mutations est obligatoirement très important, et il se stabilisera lorsque l’adaptation sera faite. Rien ne permet d’affirmer pour l’instant qu’une souche de Sars-CoV-2 est plus dangereuse qu’une autre.
Modalités d’estimation de la mortalité ?
L’exemple de la grippe saisonnière
L’estimation du nombre de sujets infectés se fait par le réseau sentinelle, qui comprend des généralistes et des pédiatres répartis sur le territoire national, et dont la mission est de rapporter les données des patients qu’ils ont vus en consultation pour une série de dix indicateurs, dont les syndromes grippaux. Tous les syndromes grippaux sont donc attribués à la grippe.
L’estimation de la mortalité peut se faire de deux manières :
− l’analyse des certificats de décès (CépiDc), qui comptabilise les décès directement attribués à la grippe. Mais imaginons un certificat de décès rédigé rapidement une nuit par un interne de garde ne sachant pas pourquoi un sujet âgé était hospitalisé… il conclura probablement à un arrêt cardiaque ! Un trouble fréquemment associé au décès…
− une méthode épidémiologique : on évalue la période d’épidémie en fonction des relevés du réseau sentinelle et on compare la surmortalité observée globalement dans cette période.
Le numérateur comme le dénominateur sont donc très imprécis. Par exemple, les cas de grippe ont été estimés à 1,8 million l’hiver 2018-2019. L’estimation de la mortalité est de 431 cas par le CépiDc (taux de létalité = 0,024 %), il est de 1 830 décès avec la méthode épidémiologique (taux de létalité = 0,1 %).
Qu’en est-il pour le COVID-19 ?
Si la mortalité attribuée au virus correspond certainement à la réalité, la comptabilisation des sujets infectés varie de façon considérable selon les conditions dans lesquelles la confirmation du diagnostic virologique a été effectuée, se limitant vraisemblablement aux formes très symptomatiques à Wuhan, beaucoup plus rigoureuses ; par exemple, à Singapour ou en Corée, où le taux de mortalité est beaucoup plus faible. Une « expérience » intéressante concerne le bateau de croisière japonais, le Diamond Princess, sur lequel 3 711 passagers ont été placés en quarantaine, ainsi que l’équipage (4 200 personnes à bord), du fait de l’identification de dix cas de COVID-19 durant les premiers jours de la traversée les ramenant de Chine au Japon, le 4 février 2020. Il est à noter que les passagers étaient dans la tranche d’âge habituelle de la clientèle des bateaux de croisière (200 sujets de plus de 80 ans), donc dans la population à risque de forme sévère. Enfin, l’espace restreint à bord augmente évidemment le risque de contagion. La contamination progresse de jour en jour. Seuls sont débarqués les malades nécessitant formellement une prise en charge médicale. Malgré ces conditions de promiscuité incroyables, seules 696 personnes contracteront la maladie, dont sept décès, et avec un recul de quelques semaines, 325 personnes sont considérées guéries au 14 mars 2020. Malgré l’âge des personnes à bord, la mortalité est de 1 % si l’on ne considère que les cas diagnostiqués infectés, 1,66 pour mille si l’on prend en compte la totalité des sujets fortement exposés.
Mais un autre élément entre en compte : la capacité d’accueil dans des unités de soins intensifs. Souhaitons qu’en France ce facteur ne soit pas déterminant.
L’auteur déclare ne pas avoir de lien d’intérêt.
Bibliographie
1. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA 2020 [Online Ahead of Print].
2. Wan Y, Shang J, Graham R, Baric RS, Li F. Receptor recognition by novel coronavirus from Wuhan: An analysis based on decade-long structural studies of SARS. J Virol 2020 ; 94.
3. Savarino A, Boelaert JR, Cassone A et al. Effects of chloroquine on viral infections: an old drug against today’s diseases? Lancet Infect Dis 2003 ; 3 : 722–7.
4. Wang D, Hu B, Hu C et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA 2020 [Epub Ahead of Print].
5. Lai CC, Shih T-P, Ko W-C et al. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019 (COVID-19): The epidemic and the challenges. Int J Antimicrob Agents 2020 ; 55 : 105924.
6. Shi H, Han X, Jiang N et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis 2020.
7. Bitterman R, Eliakim-Raz N, Vinograd I et al. Influenza vaccines in immunosuppressed adults with cancer. Cochrane Database Syst Rev 2018 ; 2 : CD008983.
8. Liang W, Guan W, Chen R et al. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol 2020 ; 21 : 335-7.
9. Mao R, Liang J, Shen J et al. Comment Implications of COVID-19 for patients with pre-existing digestive diseases. The Lancet Gastroenterology & Hepatology. Elsevier Ltd 2020 ; 10 : 1–3.
10. Rothe C, Schunk M, Sothmann P et al. Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany. N Engl J Med 2020 ; 382 : 970–1.
11. Bai Y, Yao L, Wei T et al. Presumed Asymptomatic Carrier Transmission of COVID-19. JAMA 2020.
12. Kam K-Q, Yung CF, Cui L et al. A Well Infant with Coronavirus Disease 2019 (COVID- 19) with High Viral Load. Clin Infect Dis 2020 [Epub Ahead of Print].
13. Sheahan TP, Sims AC, Leist SR et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun 2020 ; 11 : 222.
14. Li C, Zhu X, Ji X et al. Chloroquine, a FDA-approved Drug, Prevents Zika Virus Infection and its Associated Congenital Microcephaly in Mice. EBioMedicine ; 24 : 189–94.
15. Stebbing J, Phelan A, Griffin I et al. COVID-19: combining antiviral and anti-inflammatory treatments. Lancet Infect Dis 2020 [Epub Ahead of Print].
16. Bhattacharya M, Sharma AR, Patra P et al. Development of epitope-based peptide vaccine against novel coronavirus 2019 (SARS-COV-2): Immunoinformatics approach. J Med Virol 2020 [Epub Ahead of Print].
17. Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug Dev Res 2020 [Epub Ahead of Print].
18. Wang Y, Wang Y, Chen Y, Qin Q. Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures. J Med Virol 2020 [Epub ahead of print].
19. Phan T. Genetic diversity and evolution of SARS-CoV-2. Infect Genet Evol 2020 ; 81 : 104260 [Epub Ahead of Print].


