Prise en charge des formes métastatiques
Résumé
Les tumeurs neuroendocrines (TNE) de l’intestin grêle et du pancréas sont rares, mais leur prévalence est en augmentation. Environ la moitié des patients développent des métastases à distance. Les TNE peuvent être associées à des syndromes fonctionnels, à risque élevé de complications, parfois graves. L’analyse anatomopathologique est indispensable à leur caractérisation diagnostique et histopronostique. La chromogranine A est le principal marqueur biochimique des TNE. Leur bilan d’extension repose principalement sur l’imagerie morphologique (scanographie, imagerie par résonance magnétique) et l’imagerie nucléaire des récepteurs de la somatostatine. Le traitement des patients atteints de TNE métastatiques doit être discuté au cas par cas en réunion de concertation pluridisciplinaire experte. La résection chirurgicale complète de la TNE primitive et des métastases associées peut permettre une survie prolongée, mais la récidive est quasi constante. Les traitements des formes non résécables incluent les analogues de la somatostatine, la chimiothérapie, l’embolisation intra-artérielle hépatique, les thérapies ciblées orales (évérolimus, sunitinib) et la radiothérapie interne vectorisée. La stratégie thérapeutique dépend de la localisation de la tumeur primitive, du grade histopronostique, de la pente évolutive et du volume tumoral dont la présence de métastases extra-hépatiques. Elle doit prendre en compte le risque de toxicité cumulée à long terme, car la survie des patients est généralement prolongée.
Abstract
Neuroendocrine tumors of the pancreas and small intestine
Neuroendocrine tumors (NETs) of the small intestine and pancreas are rare, but their prevalence is increasing. Approximately half of patients develop distant metastases. NETs can be associated with functioning syndromes with high risk of complications which can be severe. Pathological analysis is essential for their diagnostic and histoprognostic characterization. Chromogranin A is the main biochemical marker of NETs. The imaging work-up is mainly based on morphological imaging (CT scan, magnetic resonance imaging) and nuclear imaging of somatostatin receptors. The treatment of patients with metastatic NETs must be discussed during expert multidisciplinary meetings. Complete surgical resection of primary NETs and associated metastases can prolong survival, but recurrence is almost inevitable. Therapeutic options for non-resectable disease include somatostatin analogues, chemotherapy, hepatic transarterial embolization, oral targeted therapies (everolimus, sunitinib) and peptide-radionuclide radiation therapy. The therapeutic strategy depends on primary tumor origin, histoprognostic grade, tumor growth rate and volume including the presence of extra-hepatic metastases. The risk of long-term cumulative toxicity must be taken into account since survival is generally prolonged.
Introduction
Les tumeurs neuroendocrines
Les tumeurs neuroendocrines (TNE) sont un groupe hétérogène de tumeurs rares, mais dont l’incidence augmente (1). Elles sont développées aux dépens des cellules endocrines et capables de fabriquer des peptides hormonaux en excès. Elles ont un potentiel de malignité élevé, mais une évolution généralement lente et un pronostic favorable en comparaison aux carcinomes de mêmes localisations. La rareté et l’hétérogénéité des TNE justifient la prise en charge des patients au sein de centres experts.
Les tumeurs neuroendocrines de l’intestin grêle et du pancréas
Les TNE de l’intestin grêle (TNEG) et les TNE pancréatiques (TNEP) sont parmi les plus fréquentes et sont associées à des métastases à distance chez environ la moitié des patients. Le taux de survie à 5 ans des patients ayant une TNEG ou une TNEP métastatique est respectivement d’environ 70-80 % et 50-60 %.
Cet article a pour objectif de résumer la prise en charge des patients atteints de TNEG ou TNEP métastatiques, en s’appuyant sur les dernières recommandations françaises et européennes (2, 3).
Caractérisation pré-thérapeutique des TNE métastatiques
Diagnostic et classification anatomopathologique
Les TNE sont toujours bien différenciées par opposition aux carcinomes neuroendocrines peu différenciés qui sont des cancers de pronostic sombre et de prise en charge différente, non abordés ici. Tout cas difficile de néoplasie neuroendocrine peut être adressé pour relecture anatomopathologique dans le cadre du réseau expert TENPATH (www.tenpath.org) (3).
La détermination du grade histopathologique (G) est incontournable pour la classification, l’évaluation du pronostic et la décision thérapeutique. Il est déterminé par l’indice de prolifération Ki-67 (et/ou par l’indice mitotique). D’après la classification OMS 2019 des néoplasies neuroendocrines, les TNE sont classées en G1 (Ki-67 < 3 %), G2 (Ki-67 = 3-20 %) ou G3 (Ki-67 > 20 %).
À retenir
Le grade histopronostique des TNE repose sur la différenciation et le grade qui est déterminé par l’index de prolifération (Ki-67 ou index mitotique).
Particularités cliniques des TNE
Les symptômes
Les symptômes liés aux tumeurs primitives dépendent de leur localisation et sont souvent aspécifiques comme des douleurs abdominales, des troubles du transit ou des nausées. Les TNEP peuvent causer un ictère, une intolérance alimentaire ou une pancréatite aiguë. Les TNEG peuvent être responsables d’un syndrome occlusif ou plus rarement de saignement digestif. Les symptômes peuvent aussi être liés aux localisations secondaires, en particulier hépatiques, péritonéales et osseuses.
Les syndromes fonctionnels
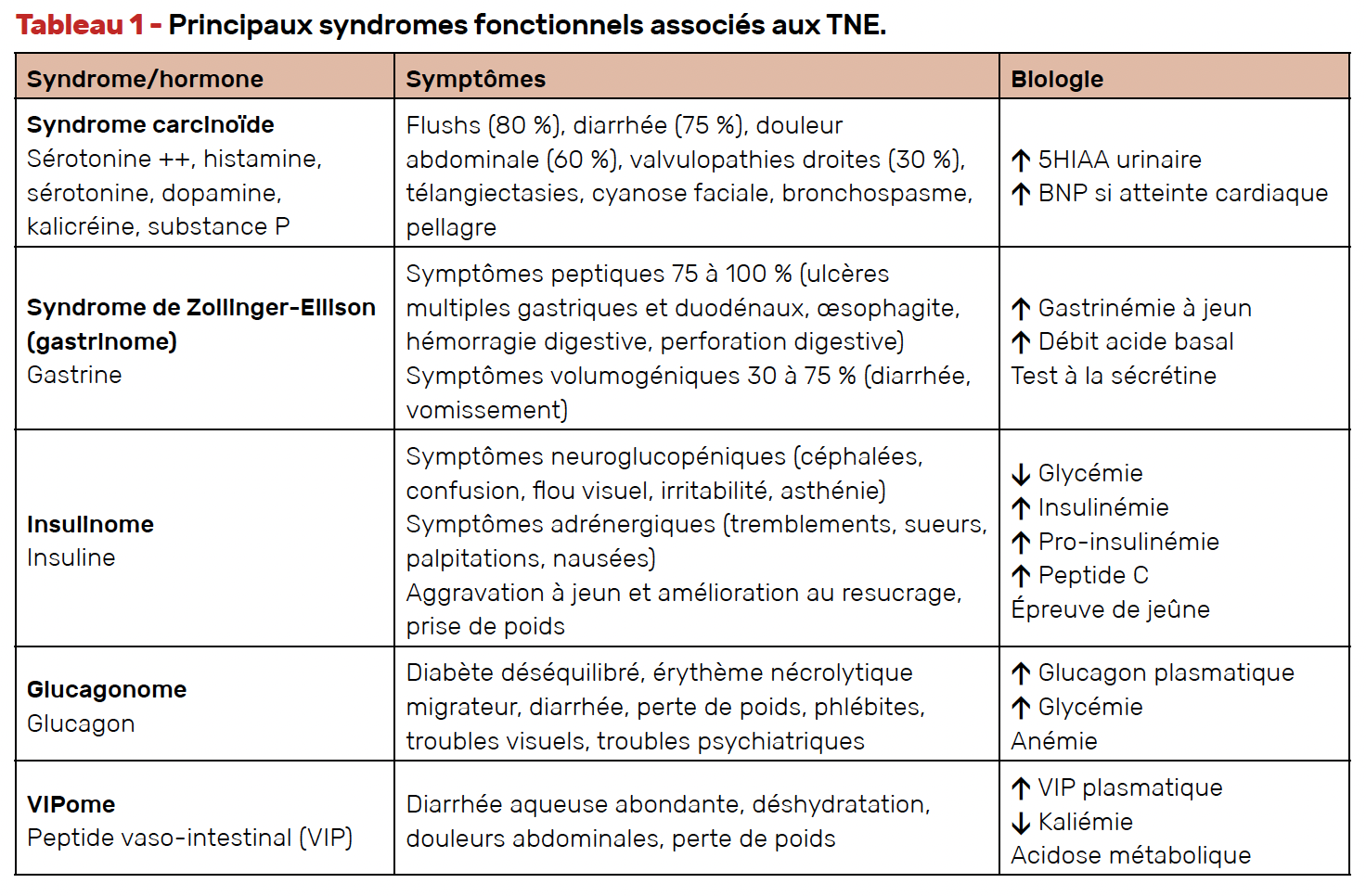
Environ 15-20 % des TNE intestinales et pancréatiques sont dites fonctionnelles, lorsqu’elles sont associées à des symptômes en rapport avec l’hypersécrétion tumorale d’hormones et/ou de peptides (Tab. 1). Un syndrome fonctionnel doit être cherché systématiquement et traité en urgence, car il peut parfois mettre en jeu le pronostic vital. Les syndromes fonctionnels les plus souvent associés aux TNEP sont l’insulinome (le plus souvent bénin) et le syndrome de Zollinger-Ellison. Le glucagonome et le VIPome, tous deux associés à une malignité élevée, sont plus rares. Le syndrome carcinoïde est le résultat de l’hypersécrétion d’hormones et de peptides, en particulier la sérotonine, par des TNEG métastatiques (ou d’origine bronchique, colique ou ovarienne par exemple). Sa principale complication est la cardiopathie carcinoïde, qui se manifeste principalement par des valvulopathies droites et doit être dépistée régulièrement chez ces patients (4).
À retenir
Les TNE peuvent occasionner des symptômes en lien avec la tumeur primitive ou les métastases, et/ou liés à une hypersécrétion tumorale pour les TNE fonctionnelles.
Marqueurs biochimiques des TNE
La chromogranine
La chromogranine A (CgA) est un marqueur général des TNE. Sa mesure plasmatique est simple, mais les variations inter- et intra-individuelles sont importantes. Les faux positifs sont fréquents, en particulier en cas de prise d’inhibiteurs de la pompe à protons (qui doivent être arrêtés 7-10 jours avant dosage, sauf en cas de gastrinome), de gastrite (quelle qu’en soit la cause : infection à H. Pylori, maladie de Biermer) et/ou d’insuffisance rénale (3). Bien que peu utile au diagnostic, le taux plasmatique de CgA est corrélé à l’importance de la masse tumorale, et est donc utile au pronostic et pour le suivi sous traitement.
L’acide 5-indroxyindolacétique
Le dosage de l’acide 5-indroxyindolacétique (5HIAA), produit de dégradation de la sérotonine, est utile au diagnostic et au suivi des TNEG associées à un syndrome carcinoïde, mais n’a pas sa place chez les patients ayant une TNEP. Il est réalisé sur des urines de 24 h après régime d’exclusion des aliments riches en tryptophanes. Son taux est également corrélé au volume métastatique et à la survenue d’une cardiopathie carcinoïde (3, 4).
À retenir
La chromogranine A est un marqueur général des TNE avec des variations inter- et intra-individuelles importantes. Le dosage systématique des hormones pancréatiques spécifiques est inutile en l’absence de syndrome fonctionnel.
Bilan de l’extension métastatique des TNE
Les TNE métastatiques doivent être classées selon leur stade Tumor-Nodes-Metastases (TNM), d’après la classification UICC 2017, en :
• M1a (métastases hépatiques uniquement),
• M1b (métastases extra-hépatiques uniquement)
• ou M1c (métastases hépatiques et extra-hépatiques).
Les métastases extra-hépatiques sont en effet associées à un pronostic péjoratif, en particulier les localisations osseuses et péritonéales (2, 3).
La TDM et l’IRM
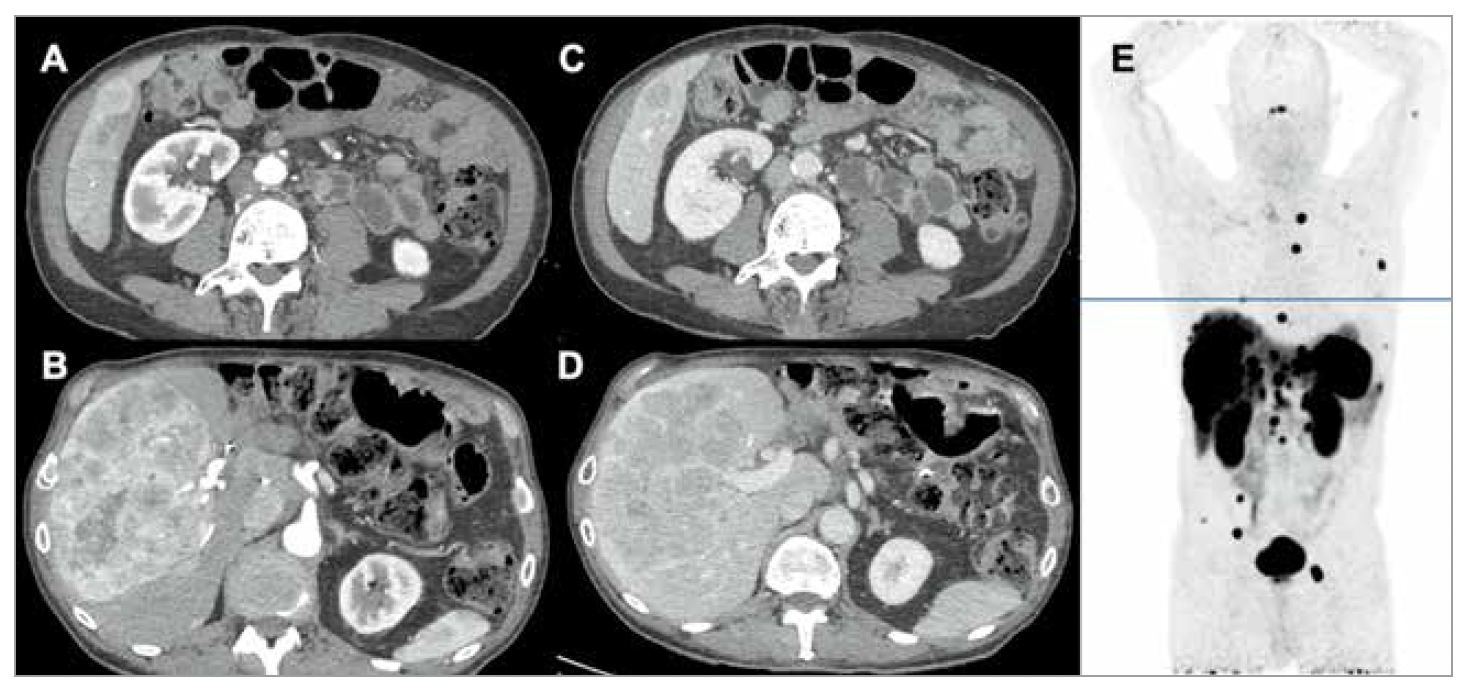
La scanographie (TDM) et l’imagerie par résonance magnétique (IRM) sont les meilleures modalités d’examen morphologique de l’abdomen et sont donc utilisées en routine pour le diagnostic initial, le bilan d’extension et le suivi des TNEG et TNEP (5). Les TNE étant typiquement hypervasculaires, elles se rehaussent fortement après injection de produit de contraste à la phase artérielle, et leur densité diminue progressivement à la phase portale (Fig. 1). Ainsi, il est recommandé de réaliser une TDM thoraco-abdomino-pelvienne avec des temps d’injection artériel tardif puis portal. L’IRM hépatique est indispensable au bilan d’extension, en particulier lorsque les métastases paraissent résécables (2, 3). Sa sensibilité est supérieure à la TDM pour la détection et la caractérisation des métastases hépatiques. Les séquences les plus performantes sont le T1 avec injection de gadolinium et la séquence T2 fast spin-echo, mais surtout les séquences de diffusion (5). L’imagerie morphologique est également utile à la détermination du volume tumoral hépatique et de la pente évolutive, qui sont des facteurs pronostiques importants, et à l’évaluation de la réponse sous traitement (critères RECIST).
Figure 1 – Patient de 57 ans ayant une tumeur neuroendocrine pancréatique G2 non fonctionnelle avec métastases hépatiques, ganglionnaires, péritonéales et osseuses.
A et B : Scanner abdominal avec injection de produit de contraste à la phase artérielle, montrant un rehaussement lésionnel franc. C et D : Scanner abdominal avec injection de produit de contraste à la phase portale, montrant des lésions iso-, voire hypodenses. E : TEP au 68Ga-DOTATOC montrant une fixation intense et homogène de toutes les localisations tumorales.
La TEP-TDM aux analogues de la SST marqués au 68Gallium
La grande majorité des TNEG et TNEP expriment à leur surface des récepteurs de la somastostatine (SST) qui peuvent être visualisés par fixation d’un analogue radioactif de la SST. La tomographie par émission de positrons (TEP) couplée à la TDM utilisant les analogues de la SST marqués au 68Gallium (en France, 68Ga-DOTATOC) a de meilleures performances diagnostiques et est moins irradiante que l’Octréoscan® à l’111Indium-pentetreotide, qu’elle remplace désormais dans toutes ses indications (Fig. 1). Elle est indispensable au bilan d’extension précis de toute TNE bien différenciée (3, 5). De plus, l’intensité de fixation tumorale est corrélée à un bon pronostic et prédit une bonne efficacité de la radiothérapie interne vectorisée.
La TEP-TDM à la 18Fluoro-dihydroxy-phénylalanine
La TEP-TDM à la 18Fluoro-dihydroxy-phénylalanine (18FDOPA) est une imagerie spécifique du métabolisme des acides aminés, qui est élevé dans les TNEG. Ses performances pour le bilan d’extension sont meilleures que l’imagerie conventionnelle et l’Octréoscan®, et au moins aussi bonnes que celles de la TEP-TDM au 68Ga-DOTATOC (Fig. 1). Elle peut être réalisée lorsqu’un bilan d’extension précis est indispensable, notamment dans le cadre du bilan d’imagerie initial et/ou en péri-opératoire des TNEG, mais a peu de place dans les TNEP (3).
La TEP-TDM à la 18Fluoro-déoxyglucose
La TEP-TDM au 18Fluoro-déoxyglucose (18FDG) n’est pas spécifique des TNE. Son intensité de fixation est corrélée à l’agressivité biologique et au pronostic des TNE. Ainsi, une TEP-TDM au FDG est indiquée pour le bilan d’extension des TNE ne fixant pas en imagerie des récepteurs de la SST. Elle peut également être réalisée à visée pronostique, indépendamment du grade histopronostique et de l’imagerie des récepteurs de la SST, si le résultat est susceptible d’influencer la prise en charge (3, 5).
À retenir
Le bilan d’extension des TNE repose sur l’imagerie morphologique (scanographie, imagerie par résonance magnétique) et l’imagerie nucléaire des récepteurs de la somatostatine.
Éléments nécessaires au choix thérapeutique
Toute décision thérapeutique concernant un patient ayant une TNE métastatique doit être prise en réunion de concertation pluridisciplinaire experte du réseau RENATEN/ENDOCAN (www.renaten.org). La décision au cas par cas dépend de plusieurs éléments :
• localisation de la tumeur primitive (TNEP versus TNEG),
• grade histopronostique,
• présence d’un syndrome hormonal,
• intervalle sans maladie et/ou taux de croissance tumorale,
• expression des récepteurs à la SST en imagerie nucléaire,
• fixation en TEP-TDM au 18FDG,
• volume tumoral (notamment hépatique) et métastases extra-hépatiques,
• résécabilité de la tumeur primitive et des métastases,
• caractéristiques du patient (âge, comorbidités, état général),
• traitements antérieurs et toxicité cumulative,
• objectif thérapeutique chez un patient donné (stabilisation prolongée, obtention d’une réponse objective, résection de toute maladie visible, symptômes, etc.) (2, 3).
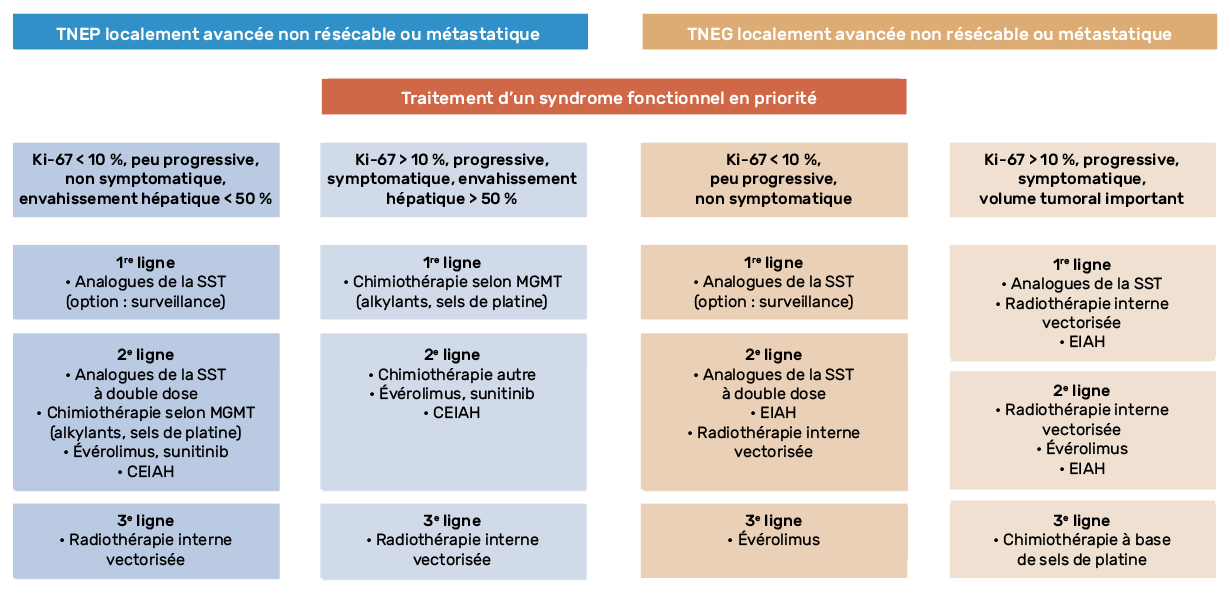
Les algorithmes de prise en charge des patients atteints de TNEG ou TNEP métastatiques sont présentés en figure 2. La plupart des TNEP et TNEG métastatiques ne sont pas accessibles à un traitement chirurgical à visée curative, et relèvent d’une stratégie thérapeutique médicale. La survie de ces patients pouvant être très prolongée, le risque de toxicité séquellaire doit être évité au maximum pour ne pas contre-indiquer d’autres traitements ultérieurs.
Figure 2 – Algorithme de prise en charge des tumeurs neuroendocrines pancréatiques ou de l’intestin grêle localement avancées ou métastatiques.
TNEG : tumeur neuroendocrine de l’intestin grêle ; TNEP : TNE pancréatiques ; SST : somatostatine ; CEIAH : chimio-embolisation intra-artérielle hépatique ; EIAH : embolisation intra-artérielle hépatique.
À retenir
Toute décision thérapeutique doit être issue d’une discussion en réunion de concertation pluridisciplinaire experte du réseau RENATEN/ENDOCAN en raison de l’hétérogénéité des TNE.
Traitement des symptômes liés aux syndromes fonctionnels
Le traitement des symptômes d’hypersécrétion hormonale est le traitement le plus urgent car ils peuvent être à l’origine de complications graves, voire mortelles.
Syndrome carcinoïde
Le traitement du syndrome carcinoïde repose sur les analogues de la SST à libération prolongée, sous forme d’injection sous-cutanée (lanréotide) ou intramusculaire (octréotide) tous les 28 jours. Ils sont efficaces dans la majorité des cas sur les flushs et la diarrhée et améliorent la qualité de vie (6). Ils sont généralement bien tolérés, mais peuvent causer une stéatorrhée par insuffisance pancréatique exocrine, une hyperglycémie et favorisent la formation de calculs vésiculaires.
En cas de symptômes carcinoïdes insuffisamment contrôlés, les injections d’analogues de la SST à libération prolongée peuvent être rapprochées ou leur dose augmentée, voire complétées par des injections d’analogues de la SST à libération immédiate.
Une crise carcinoïde aiguë peut être provoquée par tout traitement des métastases hépatiques, notamment chirurgical ou intra-artériel, et toute anesthésie générale, et peut entraîner une instabilité, voire un collapsus cardiovasculaire potentiellement mortel. Sa prévention repose sur l’administration péri-interventionnelle d’octréotide et d’antihistaminiques.
Syndrome de Zollinger-Ellison
Le traitement du syndrome de Zollinger-Ellison fait appel aux inhibiteurs de la pompe à protons qui doivent être débutés en urgence dès le diagnostic suspecté et ne doivent jamais être interrompus. La posologie utile est celle permettant de contrôler les symptômes, sans dose maximale à ne pas dépasser.
Insulinome, glucagonome et VIPome
Les agents hyperglycémiants (diazoxide) sont généralement efficaces pour contrôler les symptômes d’une hypersécrétion tumorale d’insuline. Le traitement de première intention des glucagonomes et des VIPomes repose également sur les analogues de la SST à libération prolongée, voire immédiate (2, 3).
En cas d’inefficacité des traitements antisécrétoires usuels, il est licite de discuter d’une embolisation intra-artérielle hépatique (EIAH) ou d’une chirurgie, qui peuvent avoir une efficacité antisécrétoire par réduction du volume tumoral global.
À retenir
Le traitement des symptômes d’hypersécrétion hormonale est le traitement le plus urgent.
Traitement chirurgical des TNEG et TNEP métastatiques
Résection chirurgicale de la tumeur primitive
La TNEG primitive et les métastases ganglionnaires mésentériques
La résection de la TNEG primitive et des métastases ganglionnaires mésentériques associées peut être envisagée en routine, en particulier chez les patients symptomatiques, car elle peut permettre d’éviter les complications locorégionales ultérieures (obstruction digestive, mésentérite rétractile), sauf chez les patients en mauvais état général et/ou présentant un risque élevé de syndrome du grêle court (2, 3). En revanche, l’effet pronostique de cette attitude chez des patients asymptomatiques est incertain.
La TNEP primitive
La chirurgie de la TNEP primitive dans les formes métastatiques n’est pas indiquée, sauf exception, car le risque de complications est souvent supérieur au bénéfice en termes de survie. Les candidats les plus appropriés pourraient être ceux avec une TNEP corporéocaudale de bas grade, avec une progression de la maladie nulle ou faible.
La cholécystectomie
La cholécystectomie doit toujours être envisagée lors d’une chirurgie de TNE, car elle permet de prévenir les risques ultérieurs de lithiase vésiculaire associés aux analogues de la SST et de cholécystite ischémique liée à l’EIAH.
Traitement chirurgical ou d’ablation des métastases hépatiques
La résection en totalité
La résection en totalité des métastases hépatiques des TNE est associée à une survie prolongée. Elle doit être envisagée chez les patients opérables, en l’absence de métastases extra-hépatiques, présentant une croissance tumorale lente et un volume hépatique résiduel suffisant (2, 3). Cette chirurgie peut être réalisée en deux temps après une technique de préservation parenchymateuse (embolisation ou ligature portale) si l’atteinte est bilobaire. Néanmoins, ce traitement, souvent lourd, doit être mis en balance avec le risque quasi inéluctable de récidive.
La destruction par radio-fréquence ou micro-ondes
Les techniques de destruction par radiofréquence ou micro-ondes sont une alternative à la chirurgie des métastases hépatiques. Réalisées par voie percutanée ou en per-opératoire, elles sont discutées lorsqu’il existe moins de cinq métastases hépatiques mesurant moins de 5 cm.
La transplantation hépatique
Les métastases de TNE sont une indication validée (mais exceptionnelle) de transplantation hépatique, en raison de leur faible agressivité et leur lente évolution habituelles. Les meilleurs candidats sont probablement les patients âgés de moins de 55-60 ans, présentant une TNE lentement progressive à Ki-67 < 10 %, un envahissement hépatique < 50 % sans métastases extrahépatiques et ayant reçu au moins deux ou trois lignes différentes de traitement systémique (2, 3).
Traitement des métastases non résécables de TNEG ou TNEP
Analogues de la SST à visée antitumorale
Ils ont une action antiproliférative sur les TNE, par des mécanismes directs sur la signalisation et le métabolisme cellulaire, et indirects sur le microenvironnement tumoral. L’efficacité antitumorale de l’octréotide et du lanréotide a été démontrée dans des études de phase III contre placebo (7, 8). Ils sont généralement utilisés en première ligne thérapeutique chez les patients ayant une TNE métastatique G1 ou G2, non ou faiblement progressive et d’envahissement hépatique < 50 % (2, 3).
En cas de progression lente sous analogues de la SST à dose standard, les intervalles entre les injections peuvent être rapprochés ou la dose peut être doublée, permettant de retarder l’utilisation de traitements plus toxiques.
Chimiothérapie
Les TNEP présentent une relativement bonne chimiosensibilité. La chimiothérapie est le traitement de première ligne des patients ayant une TNEP métastatique et progressive, ayant un indice Ki-67 élevé, de volume tumoral élevé, et/ou symptomatique. Elle est également indiquée si l’objectif thérapeutique principal est la réduction de la masse tumorale, ou en seconde ligne après échec des analogues de la SST (2, 3).
Les chimiothérapies dont l’efficacité antitumorale est la mieux documentée dans les TNEP sont des combinaisons d’alkylants (streptozotocine, témozolomide ou dacarbazine) et de fluoropyrimidines (5-fluorouracile ou capécitabine) (2, 3). L’efficacité des alkylants semble plus importante chez les patients dont la TNEP présente une diminution de l’expression tumorale de la O6méthylguanine-méthyltransférase (MGMT) (9). Les chimiothérapies à base de sels de platine (FOLFOX, GEMOX) sont des alternatives intéressantes, en particulier en l’absence de déficience mgMT. L’association du bévacizumab à la chimiothérapie pourrait en augmenter l’efficacité.
Au contraire, aucune chimiothérapie n’a démontré son efficacité chez les patients ayant une TNEG métastatique. Ainsi, elle ne doit être envisagée que chez les patients ayant une TNEG métastatique à Ki-67 élevé, rapidement progressive et/ou symptomatique, après échec des autres thérapies (2, 3).
Embolisation intra-artérielle hépatique
L’embolisation intra-artérielle hépatique (EIAH) consiste en l’embolisation radiologique des branches de l’artère hépatique responsables de la vascularisation des métastases hépatiques, induisant ainsi une ischémie tumorale (10). Ses principales contre-indications sont la thrombose portale complète, l’insuffisance hépatique et l’ictère. Les bons candidats sont les patients ayant des métastases hépatiques exclusives (ou majoritaires) non résécables, progressives et éventuellement symptomatiques et/ou fonctionnelles. Son taux d’efficacité est important (60-70 % de réponse symptomatique et 40-50 % de réponse morphologique), mais la tolérance peut être difficile (syndrome post-embolisation avec douleurs, fièvre et cytolyse hépatique). Ainsi, le geste est généralement réalisé en plusieurs fois, chaque session intéressant différents segments ou secteurs hépatiques, en particulier en cas d’envahissement hépatique important.
L’intérêt de l’injection intra-artérielle hépatique d’une chimiothérapie (principalement la streptozotocine) couplée à l’EIAH n’a jamais été démontré dans les TNEG, alors que celle-ci pourrait permettre d’augmenter le taux de réponse et la survie dans les TNEP (10). La radiothérapie intra-artérielle hépatique à l’90Yttrium n’est pas disponible en routine en France, mais semble d’efficacité similaire à l’EIAH, avec une meilleure tolérance à court terme.
Thérapies ciblées orales
L’évérolimus, inhibiteur oral de la voie mTOR, a démontré son efficacité dans des études de phase III contre placebo ayant inclus des patients avec une TNE métastatique et progressive (11, 12). Le sunitinib est un inhibiteur oral des tyrosines kinases associées aux récepteurs impliqués dans l’angiogenèse, dont l’efficacité a été démontrée dans une étude de phase III contre placebo chez des patients ayant une TNEP progressive (13).
Ces traitements peuvent donc être utilisés dans cette indication, généralement en seconde ou troisième ligne, néanmoins au prix d’une tolérance parfois difficile nécessitant une surveillance régulière et des adaptations de dose fréquentes.
Radiothérapie interne vectorisée
Les patients ayant une TNE métastatique présentant une fixation intense et homogène en imagerie des récepteurs de la SST sont de bons candidats à la radiothérapie interne vectorisée (RIV) utilisant un analogue de la SST marqué au 177Lutetium. L’efficacité du 177Lu-DOTATATE (quatre injections intraveineuses à 8 semaines d’intervalle, en combinaison à l’octréotide à libération prolongée) a été démontrée en comparaison à l’octréotide double dose chez des patients ayant une TNEG métastatique et progressive (14), et son efficacité est en cours d’étude dans les TNEP.
La RIV peut donc être utilisée dans cette indication, le plus souvent après échec d’au moins une ligne thérapeutique, généralement les analogues de la SST à libération prolongée. Bien que sa tolérance soit généralement excellente, elle justifie d’une surveillance rénale et surtout hématologique (risque accru d’hémopathie maligne ultérieure), en particulier chez les patients ayant reçu une chimiothérapie au préalable.
À retenir
Les traitements possibles des TNEP et TNEG métastatiques non résécables sont les analogues de la somatostatine, la chimiothérapie, les thérapies ciblées orales, l’embolisation intra-artérielle hépatique et la radiothérapie interne vectorisée.
Anaïs Jenvrin déclare ne pas avoir de lien d’intérêt en rapport avec le sujet. Louis de Mestier déclare avoir des liens d’intérêt avec AAA, Ipsen, Esteve, Sirtex (consultant).
Bibliographie
1. Dasari A, Shen C, Halperin D et al. Trends in the incidence, prevalence, and survival outcomes in patients with neuroendocrine tumors in the United States. JAMA Oncol 2017 ; 3 : 1335-42.
2. Pavel M, O’Toole D, Costa F et al. ENETS consensus guidelines update for the management of distant metastatic disease of intestinal, pancreatic, bronchial neuroendocrine neoplasms (NEN) and NEN of unknown primary site. Neuroendocrinology 2016 ; 103 : 172-85.
3. de Mestier L, Lepage C, Baudin E et al. Digestive neuroendocrine neoplasms (NEN): French Intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, GTE, RENATEN, TENPATH, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFR). Dig Liver Dis 2020 ; 52 : 473-92.
4. Grozinsky-Glasberg S, Davar J, Hofland J et al. European Neuroendocrine Tumor Society (ENETS) 2022 guidance paper for carcinoid syndrome and carcinoid heart disease. J Neuroendocrinol 2022 : e13146.
5. Sundin A, Arnold R, Baudin E et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: radiological, nuclear medicine and hybrid imaging. Neuroendocrinology 2017 ; 105 : 212-44.
6. Modlin IM, Pavel M, Kidd M, Gustafsson BI. Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacol Ther 2010 ; 31 : 169-88.
7. Rinke A, Wittenberg M, Schade-Brittinger C et al. Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors (PROMID): results of long-term survival. Neuroendocrinology 2017 ; 104 : 26-32.
8. Caplin ME, Pavel M, Ćwikła JB et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014 ; 371 : 224-33.
9. de Mestier L, Couvelard A, Blazevic A et al. Critical appraisal of mgMT in digestive NET treated with alkylating agents. Endocr Relat Cancer 2020 ; 27 : R391-405.
10. de Mestier L, Zappa M, Hentic O et al. Liver transarterial embolizations in metastatic neuroendocrine tumors. Rev Endocr Metab Disord 2017 ; 18 : 459-71.
11. Yao JC, Fazio N, Singh S et al. Everolimus for the treatment of advanced, non-functional neuroendocrine tumours of the lung or gastrointestinal tract (RADIANT-4): a randomised, placebo-controlled, phase 3 study. Lancet Lond Engl 2016 ; 387 : 968-77.
12. Yao JC, Shah MH, Ito T et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011 ; 364 : 514-23.
13. Raymond E, Dahan L, Raoul J-L et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med 2011 ; 364 : 501-13.
14. Strosberg J, El-Haddad G, Wolin E et al. Phase 3 trial of 177Lu-Dotatate for midgut neuroendocrine tumors. N Engl J Med 2017 ; 376 : 125-35.