L’essentiel en un clin d’œil
Lors du congrès de l’ASCO 2025 des résultats majeurs ont été présentés en oncologie thoracique, notamment en situation de cancer bronchique à petites cellules, conduisant à de nouveaux standards thérapeutiques.
TOP 1 – Tarlatamab et lurbinectédine, nouveaux standards en seconde ligne et en maintenance pour les cancers bronchiques à petites cellules
En situation de cancer bronchique à petites cellules (CBPC) métastatique, le standard de traitement actuel, sur la base des remboursements en France, repose sur une association de chimiothérapie avec sels de platine et étoposide, associée au durvalumab ou à l’atézolizumab, en première ligne, avec quatre cycles d’induction suivis d’une maintenance avec l’immunothérapie, jusqu’à progression tumorale. En seconde ligne, les agents possibles, outre le rechallenge des sels de platine et de l’étoposide en situation de récidive après au moins 3 mois d’intervalle libre de chimiothérapie, sont le topotécan et la lurbinectédine.
L’essai DeLLphi-304
Lors du congrès de l’ASCO, les résultats de l’essai DeLLphi-304 ont été présentés avec le tarlatamab, anticorps bispécifique de type T-cell engager, ciblant CD3 sur les lymphocytes T, et DLL3 à la surface des cellules tumorales. L’essai s’est inscrit en seconde ligne, avec une randomisation en comparaison à la lurbinectédine ou au topotécan, et un critère de jugement principal sur la survie globale (SG).
Au total, 509 patients ont été randomisés.
Résultats
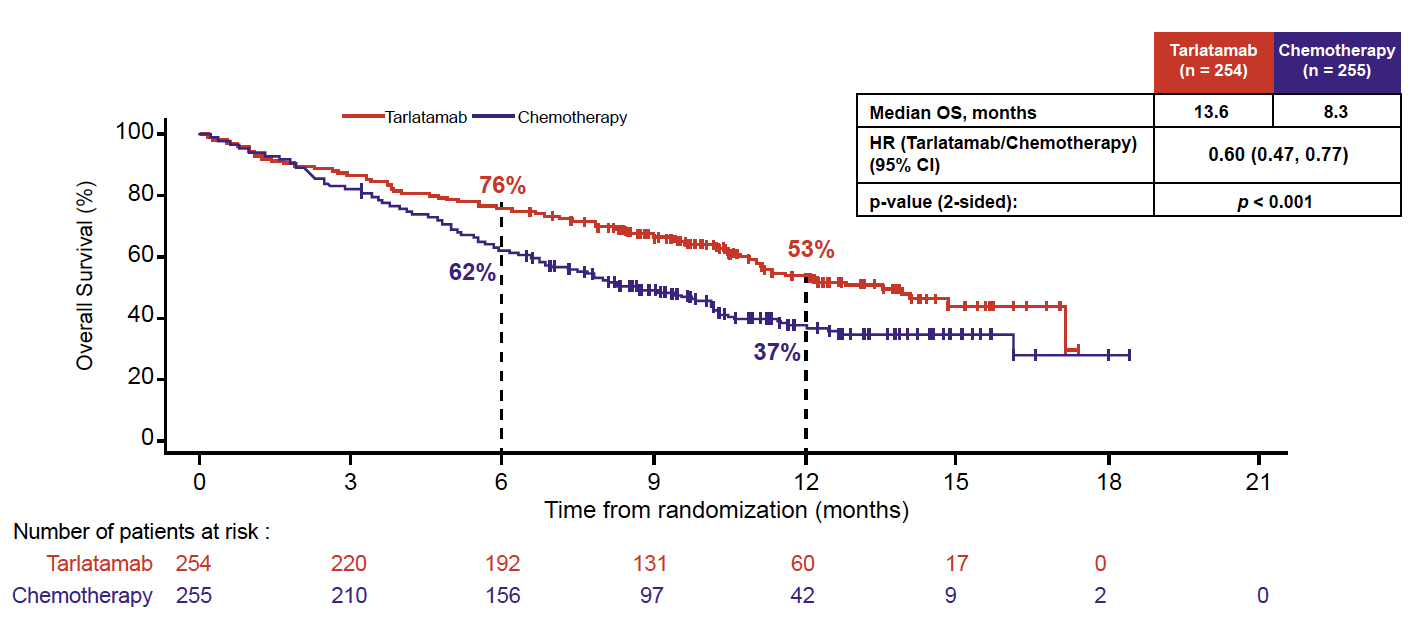
Après un suivi médian de plus de 11 mois dans les deux bras, les résultats montrent un bénéfice majeur de SG avec le tarlatamab (SG médiane de 13,6 versus 8,3 mois ; HR = 0,60 ; IC 95 % = 0,47-0,77 ; p < 0,001) (Fig. 1).
Figure 1 – DeLLphi-304 : survie globale.
Tolérance
En outre, les effets indésirables liés au traitement de grade 3 ou plus étaient deux fois plus rares avec le tarlatamab (27 versus 62 %) ; le syndrome de relargage de cytokines associé au tarlatamab était le plus souvent de faible grade (42 % de grade 1 ; 13 % de grade 2 ; 1 % de grade 3).
En pratique
Il s’agit de la première étude de phase III positive en seconde ligne dans les CBPC depuis la comparaison du topotécan au placebo ; le bénéfice est majeur en termes d’efficacité et de tolérance. Disponible dans plusieurs pays, le tarlatamab pose plusieurs questions, à la fois dans le parcours patient, avec l’évaluation récente, aux États-Unis, d’une surveillance non plus hospitalière, mais ambulatoire après l’injection, sur les symptômes du syndrome de relargage de cytokines, et dans le positionnement de ce traitement, puisque plusieurs essais sont en cours, à la fois en maintenance après la phase d’induction en première ligne, et en combinaison à la chimiothérapie et l’immunothérapie pendant l’induction.
L’essai IMforte
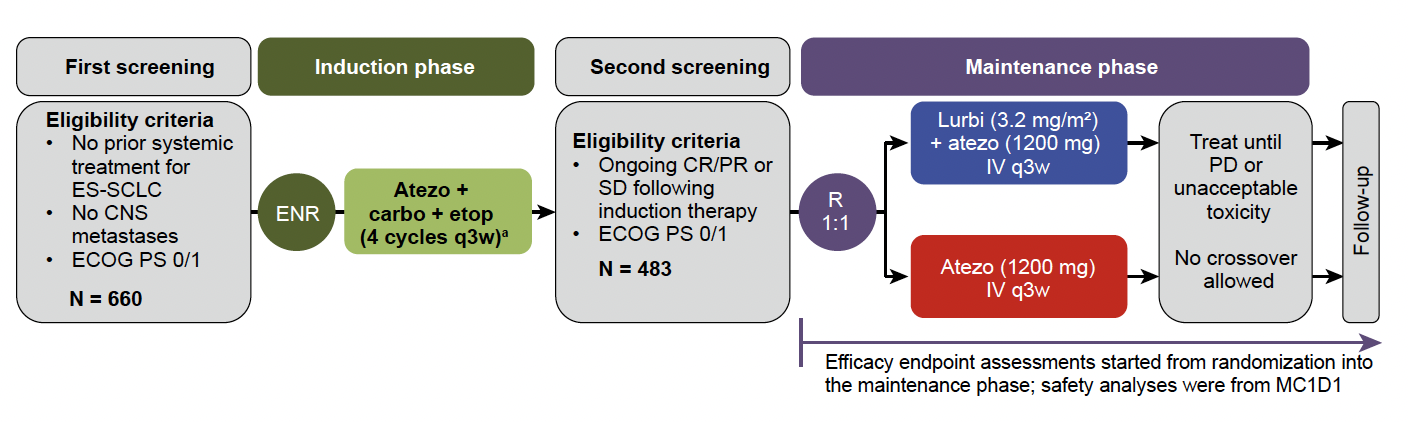
La seconde étude dans les CBPC est l’essai IMforte, qui a évalué la lurbinectédine en maintenance après la phase d’induction, en association à l’atézolizumab. Essai de phase III en ouvert, IMforte a inclus 483 patients, non progresseurs après quatre cycles de chimiothérapie et atézolizumab, pour recevoir soit l’atézolizumab seul, soit l’association. Les patients porteurs de métastases cérébrales étaient exclus (Fig. 2).
Figure 2 – IMforte : schéma de l’essai.
Résultats
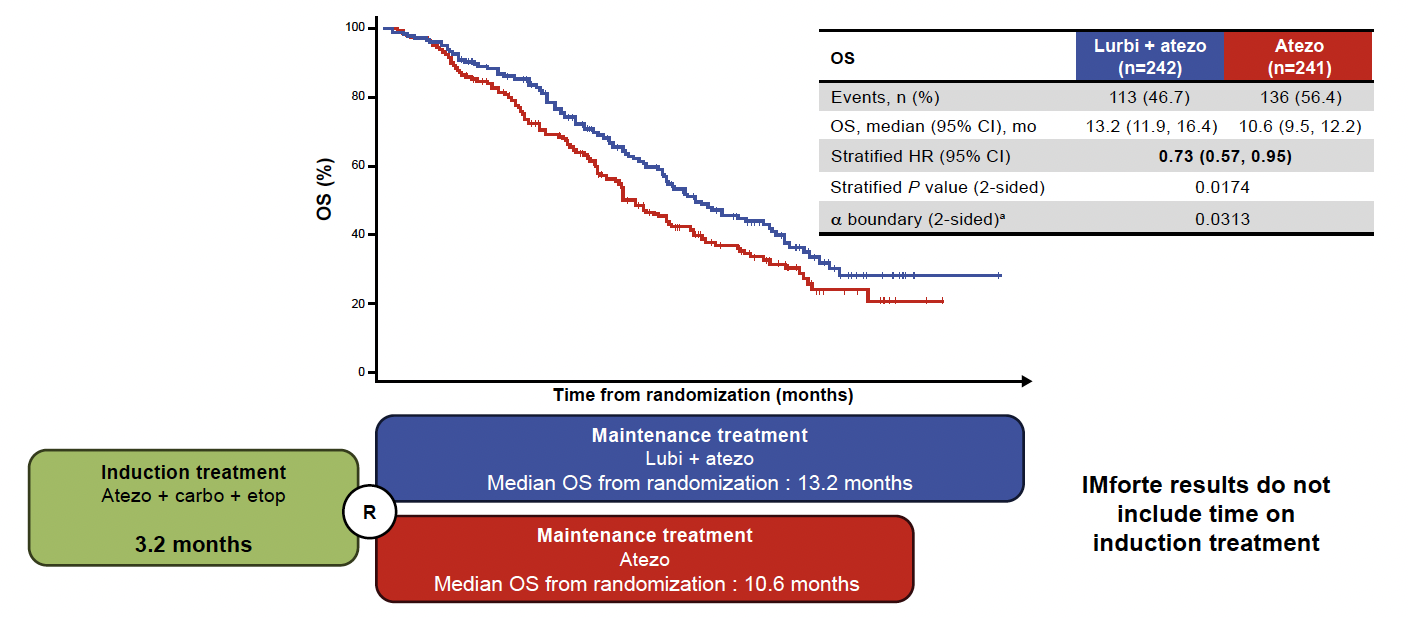
Après un suivi médian de 15 mois, l’association lurbinectédine et atézolizumab réduisait de façon significative le risque de progression (survie sans progression (SSP) médiane de 5,4 versus 2,1 mois ; HR = 0,54 ; IC 95 % = 0,43-0,67 ; p < 0,0001) et de décès (SG médiane de 13,2 versus 10,6 mois ; HR = 0,73 ; IC 95 % = 0,57-0,95 ; p = 0,0174) (Fig. 3). Ceci correspond à une amélioration aussi importante que celle apportée par l’adjonction de l’immunothérapie à la chimiothérapie en première ligne, dans le sous-groupe des patients non progresseurs après l’induction, et sans métastases cérébrales.
Figure 3 – IMforte : survie globale.
Tolérance
La tolérance correspond à celle de l’association, avec un doublement du risque d’effets indésirables liés au traitement, passant de 40 % sous immunothérapie à 84 % sous immunothérapie et lurbinectédine.
En pratique
Ces données sont les premières à montrer l’intérêt d’une switch maintenance, ou seconde ligne précoce, dans les CBPC, avec un bénéfice cliniquement d’autant plus pertinent que le risque d’attrition est fort avec plus de 25 % de patients ne recevant pas de seconde ligne du fait de dégradation de l’état général.
• Dingemans AC, Früh M, Ardizzoni A et al. Small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021 ; 32 : 839-53.
• Rudin C, Mountzios G, Sun L et al. Tarlatamab versus chemotherapy (CTx) as second-line (2L) treatment for small cell lung cancer (SCLC): Primary analysis of Ph3 DeLLphi-304. J Clin Oncol 2025 ; 43 : LBA8008.
• Mountzios G, Sun L, Cho BC et al. Tarlatamab in small-cell lung cancer after platinum-based chemotherapy. N Engl J Med 2025 ; Online ahead of print.
• Paz-Ares L, Borghaei H, Liu SV et al. Lurbinectedin (lurbi) + atezolizumab (atezo) as first-line (1L) maintenance treatment (tx) in patients (pts) with extensive-stage small cell lung cancer (ES-SCLC): Primary results of the phase 3 IMforte trial. J Clin Oncol 2025 ; 43 : 8006.
• Paz-Ares L, Borghaei H, Liu SV et al. Efficacy and safety of first-line maintenance therapy with lurbinectedin plus atezolizumab in extensive-stage small-cell lung cancer (IMforte): a randomised, multicentre, open-label, phase 3 trial. Lancet 2025 ; 405 : 2129-43.
TOP 2 – Amélioration significative de la survie globale après chimiothérapie et nivolumab en situation néoadjuvante des cancers bronchiques non à petites cellules
L’essai CheckMate-816
En situation néoadjuvante, l’essai randomisé de phase III CheckMate-816 a démontré l’intérêt de l’adjonction de nivolumab à la chimiothérapie, chez 358 patients atteints de cancer bronchique non à petites cellules (CBNPC) résécable de stade IB à IIIA dans la 7e édition de la classification TNM, à la fois en termes de réponse pathologique complète (24 % avec l’association versus 2 % avec la chimiothérapie seule) et de survie sans événement (SSE), (respectivement à 2 ans de 64 versus 45 %).
Résultats actualisés
Les résultats actualisés ont été présentés lors du congrès de l’ASCO. Après un suivi médian de 68 mois, l’adjonction du nivolumab à la chimiothérapie néoadjuvante démontre un bénéfice en termes de SG par rapport à la chimiothérapie seule (SG médiane non atteinte, versus 74 mois ; HR = 0,72 ; IC 95 % = 0,523-0,998 ; p = 0,0479) ; les taux de SG à 5 ans étaient de 65 versus 55 %. L’effet pronostique majeur de la réponse pathologique complète était retrouvé, avec un taux de SG à 5 ans de 95 % pour les patients avec une réponse pathologique complète, et de 56 % pour les autres (HR = 0,11 ; IC 95 % = 0,04-0,36). L’association chimiothérapie et nivolumab réduisait à long terme le risque d’événement de rechute (SSE de 59,6 versus 21,1 mois ; HR = 0,68 ; IC 95 % = 0,51-0,91).
En pratique
Ces résultats renforcent notre standard thérapeutique actuel de chimiothérapie et nivolumab en néoadjuvant, pour les patients avec un CBNPC opérable de stades II et III, avec un remboursement en France uniquement en situation d’expression de PD-L1. Dans ce sous-groupe, le bénéfice de SG était encore plus important (SG à 5 ans de 78 versus 58 % avec la chimiothérapie seule).
• Forde PM, Spicer J, Lu S et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022 ; 386 : 1973-85.
• Forde PM, Spicer J, Provencio M et al. Overall survival with neoadjuvant nivolumab (NIVO) + chemotherapy (chemo) in patients with resectable NSCLC in CheckMate 816. J Clin Oncol 2025 ; 43 : LBA8000.
• Forde PM, Spicer J, Provencio M et al. Overall survival with neoadjuvant nivolumab plus chemotherapy in lung cancer. N Engl J Med 2025 ; Online ahead of print.
TOP 3 – L’association savolitinib et osimertinib, une seconde ligne pour les cancers bronchiques non à petites cellules EGFR mutés
Le savolitinib est un inhibiteur de tyrosine kinase ciblant MET, dont les premiers résultats en situation de résistance acquise à l’osimertinib avec émergence d’une activation de la voie MET avaient été rapportés lors du congrès de l’ELCC dans le cadre de l’essai SAVANNAH.
L’essai SACHI
Lors du congrès de l’ASCO 2025, les résultats de l’essai de phase III SACHI ont été présentés. L’essai s’inscrit en seconde ligne après inhibiteurs de tyrosine kinase de l’EGFR, chez 211 patients dont la tumeur a fait l’objet d’une rebiopsie tumorale à la progression avec mise en évidence d’une amplification de MET (au moins cinq copies, ou rapport gène/centromère d’au moins 2), avec la comparaison de la chimiothérapie à base de sels de platine, à l’association savolitinib et osimertinib. Le taux d’échec d’inclusion était important, car la sélection sur le critère d’amplification de MET conduisait à exclure plus de 80 % des patients ayant fait l’objet d’un screening.
Résultats
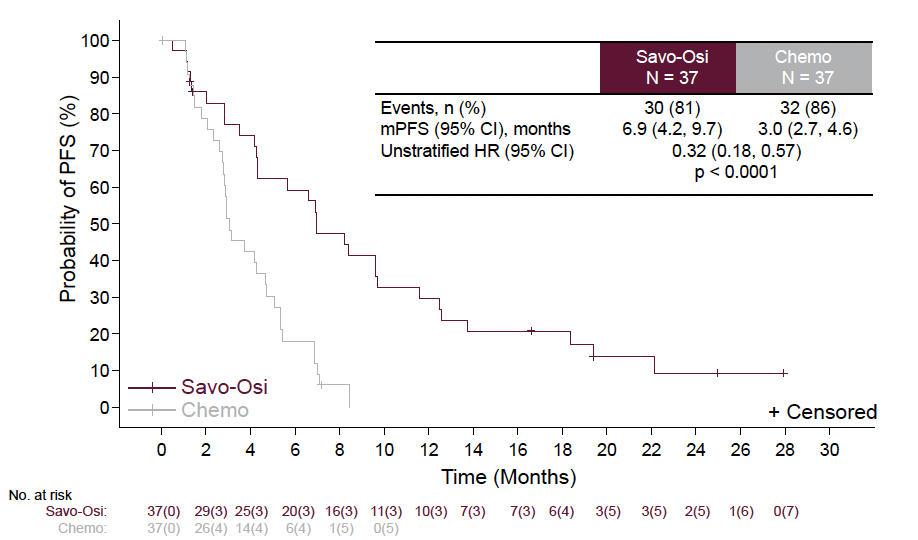
Les résultats montrent un bénéfice significatif de SSP avec l’association savolitinib et osimertinib (p < 0,0001). Chez les patients traités par inhibiteur de tyrosine kinase de troisième génération, standard actuel, la SSP médiane était plus que doublée par rapport à la chimiothérapie (6,9 versus 3,0 mois ; HR = 0,32 ; p < 0,0001). La SG n’était pas mature à ce stade (Fig. 4).
Figure 4 – SACHI : survie sans progression.
Le profil de tolérance était gérable.
En pratique
Ces données montrent l’intérêt de la rebiopsie tumorale pour sélectionner les patients après progression tumorale sous inhibiteurs de tyrosine kinase en première ligne, avec un bénéfice important du ciblage par savolitinib et osimertinib en cas d’amplification de MET. Cette étude asiatique est en cours de confirmation avec l’essai SAFFRON, ouvert en France, et évaluant cette même stratégie avec la même association, dans une population plus large, à la fois avec identification, à la résistance à l’osimertinib, d’une amplification de MET, et aussi avec une surexpression de MET en immunohistochimie.
• de Marinis F, Kim TM, Bonnano L et al. Savolitinib plus osimertinib in epidermal growth factor receptor (EGFR)-mutated advanced non-small cell lung cancer with MET overexpression and/or amplification following disease progression on osimertinib: primary results from the phase II SAVANNAH study. Ann Oncol 2025 : S0923-7534(25)00157-7.
• Lu S, Wang J, Yang N et al. Savolitinib (Savo) combined with osimertinib (osi) versus chemotherapy (chemo) in EGFR-mutant (EGFRm) and MET-amplification (METamp) advanced NSCLC after disease progression (PD) on EGFR tyrosine kinase inhibitor (TKI): Results from a randomized phase 3 SACHI study. J Clin Oncol 2025 ; 43 : LBA8505.
TOP 4 – Le patritumab déruxtécan, déception en seconde ligne des cancers bronchiques non à petites cellules EGFR mutés
Lors du congrès de l’ASCO 2025, l’autre stratégie évaluée en seconde ligne de traitement des CBNPC EGFR mutés après osimertinib est celle du ciblage de HER3 avec un anticorps conjugué, le patritumab déruxtécan, qui avait montré une efficacité prometteuse dans l’étude HERTHENA-Lung01 en lignes avancées, avec un taux de réponse à plus de 40 %.
L’essai HERTHENA-Lung02
HERTHENA-Lung02 est une étude de phase III, randomisée et ouverte, comparant le patritumab déruxtécan à la chimiothérapie à base de sels de platine après progression sous inhibiteur de tyrosine kinase de troisième génération, sans sélection sur un quelconque biomarqueur. Au total, 586 patients ont été randomisés.
Résultats
Après un suivi médian de 10,7 mois, il existait une amélioration statistiquement significative de la SSP avec le patritumab déruxtécan par rapport à la chimiothérapie (HR = 0,77 ; IC 95 % : 0,63-0,94 ; p = 0,011), mais qui n’était pas cliniquement très pertinente, avec des médianes à 5,8 versus 5,4 mois, respectivement.
En pratique
Un communiqué de presse a dans le même temps rapporté l’absence de bénéfice de SG avec le patritumab déruxtécan, ce qui compromet le positionnement de cet agent dans la stratégie thérapeutique. Le standard actuel, en l’absence de sélection sur l’identification d’un mécanisme de résistance, est l’association chimiothérapie et amivantamab, sur la base de l’essai MARIPOSA2.
• Mok T, Yu H, Min Lim S et al. Patritumab deruxtecan (HER3-DXd) in resistant EGFR-mutated (EGFRm) advanced non-small cell lung cancer (NSCLC) after a third-generation EGFR TKI: The phase 3 HERTHENA-Lung02 study. J Clin Oncol 2025 ; 43 : 8506.
• Hendriks LEL, Cortiuma F, Martins-Branco D et al. Updated treatment recommendation for systemic treatment: from the ESMO oncogene-addicted metastatic NSCLC Living Guideline. Ann Oncol 2025 : S0923-7534(25)00813-0.
TOP 5 – L’horaire d’administration de l’immunothérapie, un facteur pronostique majeur en oncologie thoracique ?
Plusieurs études rétrospectives avaient suggéré une efficacité accrue des immunothérapies administrées le matin plutôt que l’après-midi, mais les biais potentiels en limitaient la portée clinique.
L’essai
Lors du congrès de l’ASCO 2025, un essai de phase III randomisé, conduit en Chine, a randomisé 210 patients pour recevoir l’immunothérapie, par pembrolizumab ou sintilimab, en association à la chimiothérapie, pour le traitement de première ligne d’un CBNPC métastatique, soit avant 15 h, soit après 15 h.
Résultats
Après un suivi médian de 18,9 mois, la SSP médiane était de 13,2 mois pour les patients “du matin” versus 6,5 mois pour les patients “du soir” (HR = 0,43 ; IC 95 % = 0,31-0,60 ; p < 0,0001). La SG médiane n’a pas été atteinte pour les patients “du matin” et est de 17,8 mois pour les patients “du soir” (HR = 0,43 ; IC 95 % = 0,27-0,69 ; p = 0,0003).
En pratique
Ces données, inattendues, suggèrent une influence des rythmes circadiens sur l’immunité antit-umorale, et posent la question de renouveler des essais cliniques pour évaluer la question des horaires d’administration ; en France, l’essai IMMUNOTIME est en cours.
• Zhang Y, Huang Z, Zeng L et al. Randomized trial of relevance of time-of-day of immunochemotherapy for progression-free and overall survival in patients with non-small cell lung cancer. J Clin Oncol 2025 ; 8516.
Nicolas Girard déclare avoir des liens d’intérêt avec Abbvie, Amgen, AstraZeneca, BeiGene, Boehringer Ingelheim, BMS, Daiichi Sankyo, Eli Lilly, Gilead, Hoffmann-La Roche, Ipsen, Janssen, Leo Pharma, Metronic, Merck, Merck Sharp & Dohme, Novartis, Pfizer, Sanofi, Sivan et Takeda.