L’essentiel en un clin d’œil
Rejeté dans l’ombre ces dernières années par les succès spectaculaires de l’immunothérapie dans les cancers du col et de l’endomètre, le cancer de l’ovaire a été cette fois-ci la vedette de l’onco-gynécologie, avec des résultats d’efficacité significatifs pour de nombreuses drogues évaluées sur le terrain pourtant difficile du cancer de l’ovaire résistant (PROC). Et même la vague de l’immunothérapie est venue lécher le PROC avec l’étude B96 présentée en présidentielle.
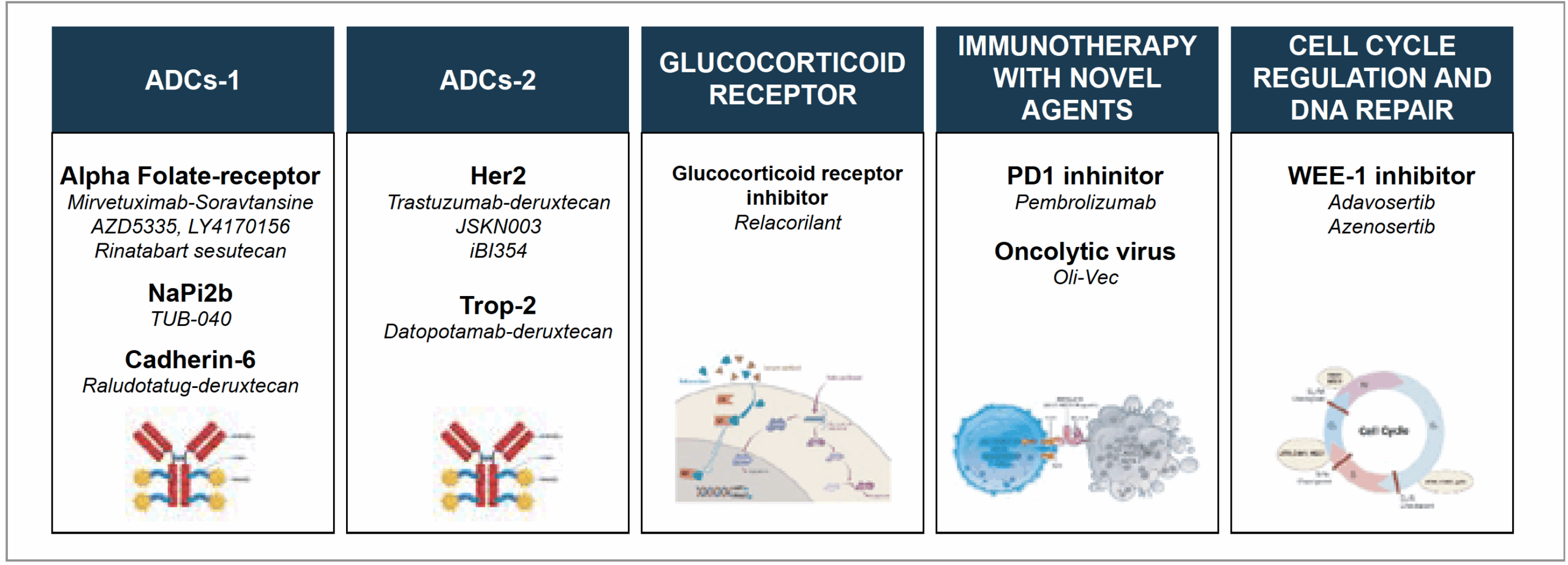
Figure 1 – Drogues ayant montré leur efficacité dans les cancers de l’ovaire résistants et leur mécanisme d’action.
TOP 1 – L’avion de combat B96 avec le pembrolizumab a ciblé la présidentielle
L’immunothérapie dans les cancers de l’ovaire résistants (PROC) n’avait jamais réussi à passer la marche de la signification statistique, malgré un hazard ratio (HR) de 0,78 dans JAVELIN 200, avec l’addition d’avélumab à la doxorubicine liposomale pégylée, tandis que l’addition d’atézolizumab à la chimiothérapie ne semblait apporter un bénéfice que dans le sous-groupe traité par le paclitaxel (HR = 0,75 ; 0,57-0,98).
L’étude KEYNOTE-B96
Le 3e essai phase III (ENGOT-ov65/KEYNOTE-B96) a été le bon avec 643 patientes PROC randomisées entre le pembrolizumab 400 mg IV toutes les 6 semaines ou le placebo en combinaison avec le paclitaxel hebdomadaire (80 mg/m² les jours 1, 8 et 15 d’un cycle de 3 semaines) ± bévacizumab (10 mg/kg toutes les 2 semaines).
Les résultats
Le pembrolizumab a significativement prolongé la survie sans progression (SSP) dans la population ITT (8,3 versus 6,4 mois ; HR : 0,70 ; IC 95 % : 0,58-0,84 ; p < 0,0001). Une augmentation de la survie globale (SG) a été observée non seulement chez les patientes PD-L1 CPS ≥ 1 (18,2 versus 14 mois ; HR : 0,76 ; IC 95 % : 0,61-0,94 ; p = 0,0053) (Fig. 2), mais aussi dans la population ITT (17,7 versus 14 mois ; HR : 0,81 ; IC 95 % : 0,68-0,97 ; p = 0,0114).
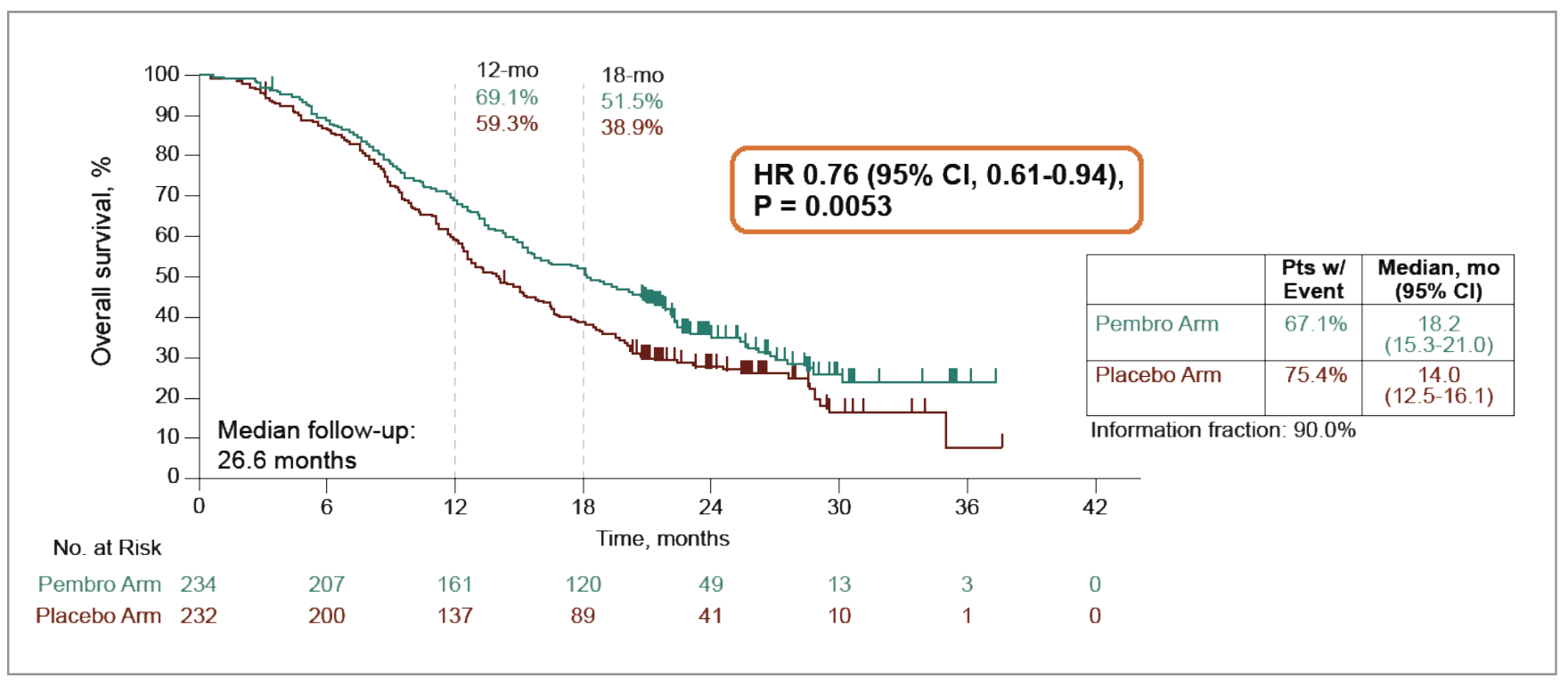
Figure 2 – KEYNOTE-B96 : survie globale des patientes PROC (CPS > 1) traitées par paclitaxel hebdomadaire ± bévacizumab avec ou sans pembrolizumab.
En pratique
Au total, paclitaxel hebdomadaire + pembrolizumab ± bévacizumab devrait être le nouveau standard de prise en charge initiale des patientes PROC.
• Colombo N, Zsiros E, Sebastianelli A et al. Pembrolizumab vs placebo plus weekly paclitaxel ± bevacizumab in platinum-resistant recurrent ovarian cancer: results from the randomized double-blind phase 3 ENGOT-ov65/KEYNOTE-B96 study. Ann Oncol 2025 ; 36 : LBA3.
TOP 2 – La résistance au PARPi ne résiste pas au rélacorilant
Cet inhibiteur des récepteurs aux glucocorticoïdes qui sont exprimés dans l’extrême majorité des cancers de l’ovaire avait montré son efficacité dans la phase III ROSELLA chez les patientes en rechute de cancer de l’ovaire.
L’étude
L’étude de sous-groupe de patientes PROC présentée à l’ESMO 2025 est particulièrement pertinente. Chez les patientes qui rechutent sous traitement par PARPi, et dont on sait que la tumeur est également résistante à la chimiothérapie, cette analyse montre que le rélacorilant combiné au nab-paclitaxel garde toute son efficacité comparée au nab-paclitaxel seul avec un HR de 0,56 (0,57-0,84) (Fig. 3).
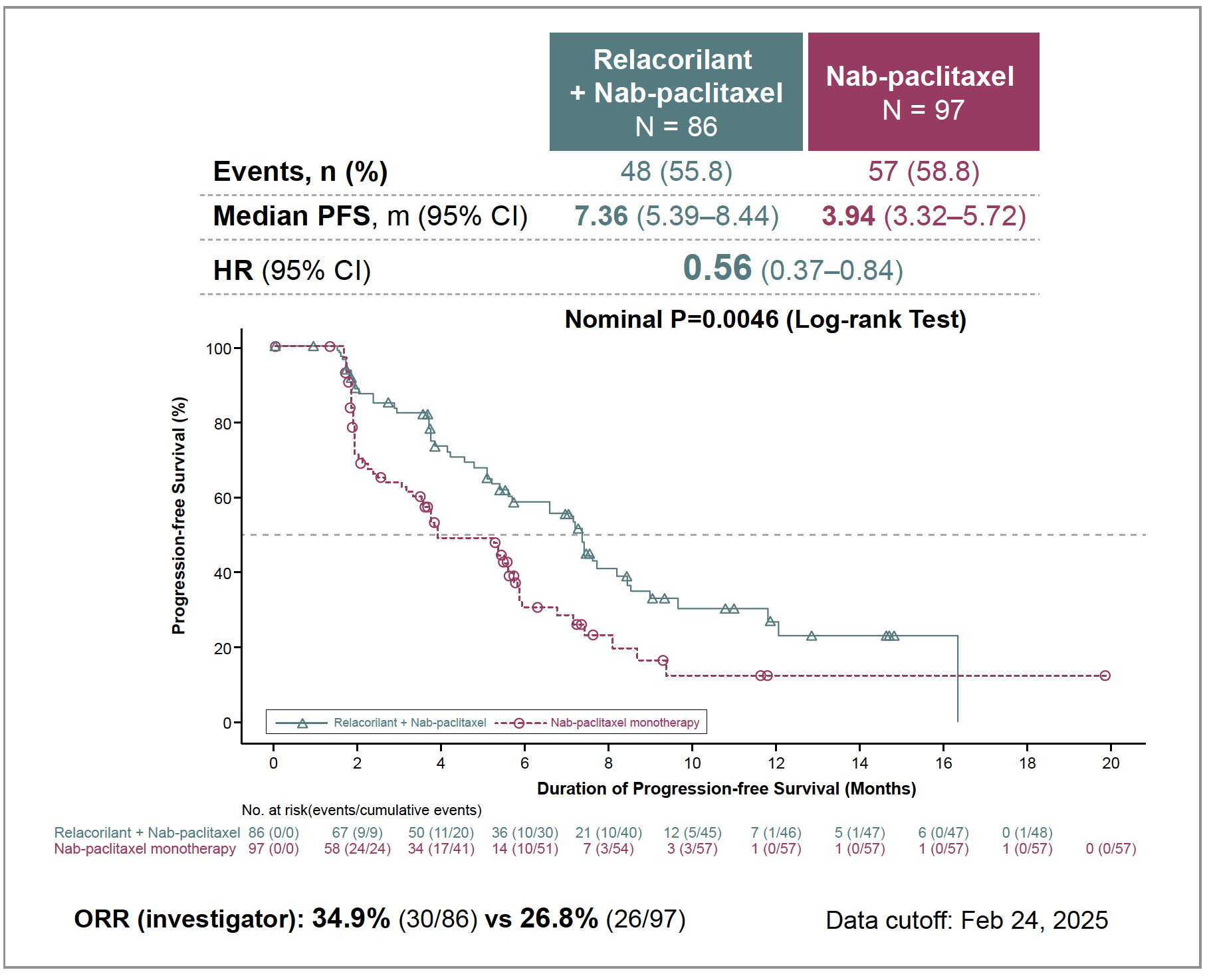
Figure 3 – ROSELLA : survie sans progression chez les patientes PROC recevant ou non du rélacorilant avec le nab-paclitaxel et rechutant sous traitement par PARPi.
En pratique
Mais pour combler ce besoin thérapeutique important des patientes résistantes au PARPi, il faudrait disposer en plus du nab-paclitaxel.
• Lorusso D, Quesada S, Chan JK et al. ROSELLA (GOG3073, ENGOTov72, APGOT-OV10): relacorilant + nab-paclitaxel in the subgroup of patients with platinum-resistant ovarian cancer (PROC) previously exposed to a PARP inhibitor. Ann Oncol 2025 ; 36 : LBA45.
TOP 3 – Les ADC en foule
La figure 1 donne une idée du nombre d’anticorps drogue-conjugués (ADC) qui ont démontré leur efficacité dans les PROC, auxquels ont été ajoutés les ADC présentés à l’ESMO 2025.
Les inhibiteurs des récepteurs aux folates
Le seul ADC commercialisé à ce jour cible le récepteur alpha des folates (mirvétuximab soravtansine). Il n’est efficace que chez les patientes ayant une forte expression du récepteur et est associé avec un payload inhibant les microtubules induisant troubles oculaires et neuropathie. Il est concurrencé par une série d’ADC ciblant le même récepteur, mais avec un payload d’inhibiteur de la topoisomérase 1 induisant de façon variable une hématotoxicité et des troubles digestifs, mais pas de neuropathie ou de troubles oculaires. En outre, ils sont le plus souvent efficaces même en cas d’expression faible du récepteur.
L’AZD5335
Ont été ainsi présentés les résultats de la phase I/IIa de l’AZD5335 I.V. q3 semaines chez 169 patientes PROC avec un taux de FRα > 25 % traitées par trois différentes doses. Le taux de réponse est de 53,6 % et, à 7,8 mois, 56 % des patientes n’ont pas rechuté.
Le LY4170156
Le LY4170156 est également prometteur dans cette phase I de
95 patientes PROC ayant reçu en médiane cinq lignes de traitement, avec notamment un taux de réponse de 50 % chez les 26 patientes évaluables avec un taux bas d’expression de FRα (< 75 %).
L’inhibiteur de la cadhérine 6 (CDH6)
La CDH6 est exprimée dans 65 à 85 % des cancers de l’ovaire. L’étude de phase I du raludotatug déruxtécan (R-DXd) I.V. q3 semaines ciblant la CDH6, couplé avec un inhibiteur de la topo-1, a inclus 106 patientes PROC ayant reçu un nombre médian de trois lignes de traitement qui comprenaient en très grande majorité du bévacizumab et un PARPi. Le taux global de réponse est de 50,5 % et la dose de 5,5 mg/kg a été sélectionnée pour la poursuite des essais.
L’inhibiteur de la protéine de transport du phosphate dépendante du sodium (NaPi2b)
Le TUB-040 est un ADC couplé avec un inhibiteur de la topo-1 et ciblant NAPi2b surexprimé dans la plupart des cancers de l’ovaire. Il a été administré en I.V. q3 semaines à 67 patientes PROC ayant reçu une médiane de quatre lignes antérieures comprenant dans la majorité des cas du bévacizumab et un PARPi. Le taux de réponse chez les 55 patientes évaluables a été de 33 %.
• Oaknin A, Perets R, Shapira-Frommer R et al. First-in-human study of AZD5335, a folate receptor α (FRα)-targeted antibody-drug conjugate, in patients with platinum-resistant recurrent ovarian cancer. Ann Oncol 2025 ; 36 : 1065MO.
• Ray-Coquard IL, Kyi C, Pothuri B et al. Results from the first-in-human phase I study of LY4170156, an antibody drug conjugate (ADC) targeting folate receptor alpha in recurrent platinum resistant high-grade serous ovarian cancer (HGSOC Ann Oncol 2025 ; 36 : 1067P.
• Ray-Coquard IL, Hasegawa K, Colombo N et al. Raludotatug deruxtecan (R-DXd) in patients (pts) with platinum-resistant ovarian cancer (PROC): primary analysis of the Phase 2 dose-optimization part of REJOICE-Ovarian01. Ann Oncol 2025 ; 36 : LBA42.
• González-Martín A, Sehouli J, Braicu EI et al. NAPISTAR 1-01: A Phase 1 dose escalation study of TUB-040, a novel NaPi2b-targeting exatecan antibody-drug conjugate (ADC) in patients with platinum-resistant ovarian (PROC) high grade serous carcinoma (HGSC). Ann Oncol 2025 ; 36 :LBA43.
TOP 4 – Les inhibiteurs de voie de signalisation (inhibiteur de mTOR) repointent leur bout du nez
On pensait que les inhibiteurs de la voie PI3K/AKT/mTOR n’offriraient dans les cancers de l’ovaire que des résultats plutôt en dessous des espoirs jusqu’à l’étude de phase II randomisée DICE. Un total de 134 patientes PROC ont été randomisées pour recevoir le TAK228 (inhibiteur sélectif du complexe mTOR 1 & 2) ou du placebo pendant 3 jours P.O. hebdomadaire après chacune des perfusions de paclitaxel hebdomadaire. Le HR est de 0,66 (0,45-0,96) et la tolérance semble très satisfaisante, avec certes plus de toxicité gastro-intestinales (11,4 versus 0 %) et rash (2,9 versus 0 %), mais un taux équivalent de grade 3-4.
• Krell J, Tookman L, Banerjee S et al. DICE trial: An international multi-centre randomised phase II study to assess the efficacy of TAK228 in combination with intravenous weekly paclitaxel compared with weekly paclitaxel alone in women with advanced/recurrent epithelial ovarian or fallopian tube cancer. Ann Oncol 2025 ; 36 : LBA46.
TOP 5 – L’Asie n’est pas le Caucase
Le poids croissant de l’Asie, et de la Chine en particulier, dans les essais de cancérologie pose la question de la transposition aux populations d’origine européenne des résultats obtenus dans les essais incluant uniquement des patientes asiatiques.
Avec les inhibiteurs de tyrosine kinase
Une différence de métabolisme entre les deux populations vis-à-vis des médicaments avait déjà été notée lors de l’essai international de l’inhibiteur de tyrosine kinase pazopanib en maintenance de première ligne de cancer de l’ovaire AGO-OVAR16. La population asiatique avait montré une toxicité supérieure à la population d’origine européenne, avec une diminution de dose plus importante du pazopanib et finalement un effet négatif sur la survie globale.
Cette observation doit être prise en compte pour analyser les résultats de l’étude chinoise présentée à l’ESMO où l’addition d’un autre inhibiteur de tyrosine kinase anti-VEGFR2 (apatinib) à un PARPi (fuzuloparib) ne montre pas de bénéfice en maintenance de première ligne de cancer de l’ovaire.
Avec l’immunothérapie
Mais la différence entre population d’Asie et d’origine européenne ne se limite pas aux inhibiteurs de tyrosine kinase, et semble s’étendre aussi à l’immunothérapie. Dans l’étude AtTEnd, l’addition de l’atézolizumab à la chimiothérapie de première ligne de cancer de l’endomètre avancé est associée dans la population asiatique à une SG inférieure par rapport au placebo dans la cohorte non-dMMR, mais aussi dans la cohorte MMRd, celle qui bénéficie le plus de l’immunothérapie dans la population caucasienne.
• Li N, Wu L, Wang J, et al. Fuzuloparib (FZPL) monotherapy or in combination with apatinib (APA) as first-line (1L) maintenance therapy in advanced ovarian cancer (OC): Final analysis of the FZOCUS-1 trial. Ann Oncol 2025 ; 36 : 1063O.
• Ginesta MPB, Biagioli E, Harano K et al. Final overall survival results from the randomized double-blind phase III AtTEnd/ENGOT-EN7 trial evaluating atezolizumab in combination with paclitaxel and carboplatin in women with advanced/recurrent endometrial cancer. Ann Oncol 2025 ; 36 : LBA39.
Éric Pujade-Lauraine déclare avoir des liens d’intérêt avec Roche, AstraZeneca, Pfizer, Merck, Incyte, Agenus.



