L’essentiel en un clin d’œil
Que retenir de cette nouvelle édition de l’ESMO 2025 en onco-dermatologie à Berlin ?
• L’intérêt toujours majeur des stratégies néoadjuvantes dans les mélanomes de stade III résécables avec les résultats actualisés à 2 ans de l’étude NADINA (ipilimumab + nivolumab en néoadjuvant) qui semble bénéficier essentiellement aux patients avec une réponse histologique complète.
• Les données à 3 ans de l’étude SWOG S1801 avec le pembrolizumab néoadjuvant versus adjuvant ont été également présentées et confirment un bénéfice en termes de survie sans événement avec une survie globale qui semble favorable au bras néoadjuvant.
• En adjuvant, les résultats à 9 ans de l’essai de phase III CheckMate 238 comparant le nivolumab à l’ipilimumab en traitement adjuvant du mélanome réséqué de stade IIIB-C ou IV. Cette étude montre une supériorité du nivolumab en termes de survie sans rechute et de survie sans maladie métastatique à distance et peut-être un intérêt à l’administration du traitement le matin plutôt que l’après-midi.
• Le mélanome uvéal, quant à lui, a été à l’honneur avec une session présidentielle sur les résultats préliminaires prometteurs de l’efficacité et la sécurité d’IMA203, une thérapie cellulaire dirigée contre PRAME dans les formes avancées.
• Pour finir, une étude de preuve de concept chez des patients très âgés, qui étaient traités avec des doses réduites de nivolumab (20 mg toutes les 3 semaines) pour des carcinomes épidermoïdes cutanés non résécables ou récurrents. Les résultats préliminaires montrent des réponses assez spectaculaires avec une toxicité réduite.
TOP 1 – Actualisation des données à 2 ans de l’étude NADINA des mélanomes de stade III macroscopiques opérables
Il s’agit d’une mise à jour de l’étude NADINA, qui compare une stratégie néoadjuvante par ipilimumab + nivolumab (Ipi + Nivo) à un traitement adjuvant par Nivo seul pour des mélanomes de stade III résécables.
L’étude NADINA
Pour rappel, dans cette étude de phase III, 419 patients avec un mélanome de novo ou récidivant de stade III macroscopique opérable, naïfs de traitement, avec au moins une métastase ganglionnaire ont été inclus (212 dans le bras néoadjuvant et 207 dans le bras adjuvant) avec des caractéristiques similaires.
• Dans le bras A, ils recevaient deux cycles d’Ipi 80 mg + Nivo 240 mg toutes les 3 semaines suivis d’un curage ganglionnaire. En cas de réponse pathologique majeure pCR ou near pCR (≤ 10 % de cellules tumorales viables résiduelles majeure), il n’y avait pas de traitement adjuvant. Dans le cas contraire, au choix de l’investigateur, ils débutaient dans les 12 semaines du Nivo 480 mg toutes les 4 semaines, 11 cycles (n = 21) ou l’association dabrafénib + tramétinib en cas de mutation BRAF V600 pour 48 semaines (n = 43).
• Dans le bras B, les patients avaient un curage ganglionnaire d’emblée suivi de 12 cycles de Nivo
480 mg débutés dans les 12 semaines avec ou sans radiothérapie.
L’objectif principal de l’étude était la survie sans événement (SSE), les objectifs secondaires : survie sans métastase à distance (SSMD) et tolérance.
Les résultats
Le suivi médian était de 25 mois.
La SSE reste toujours supérieure dans le bras néoadjuvant : 77,3 versus 55,7 % à 24 mois (Fig. 1), de même la SSMD à 82,8 versus 63,9 % (Fig. 2).
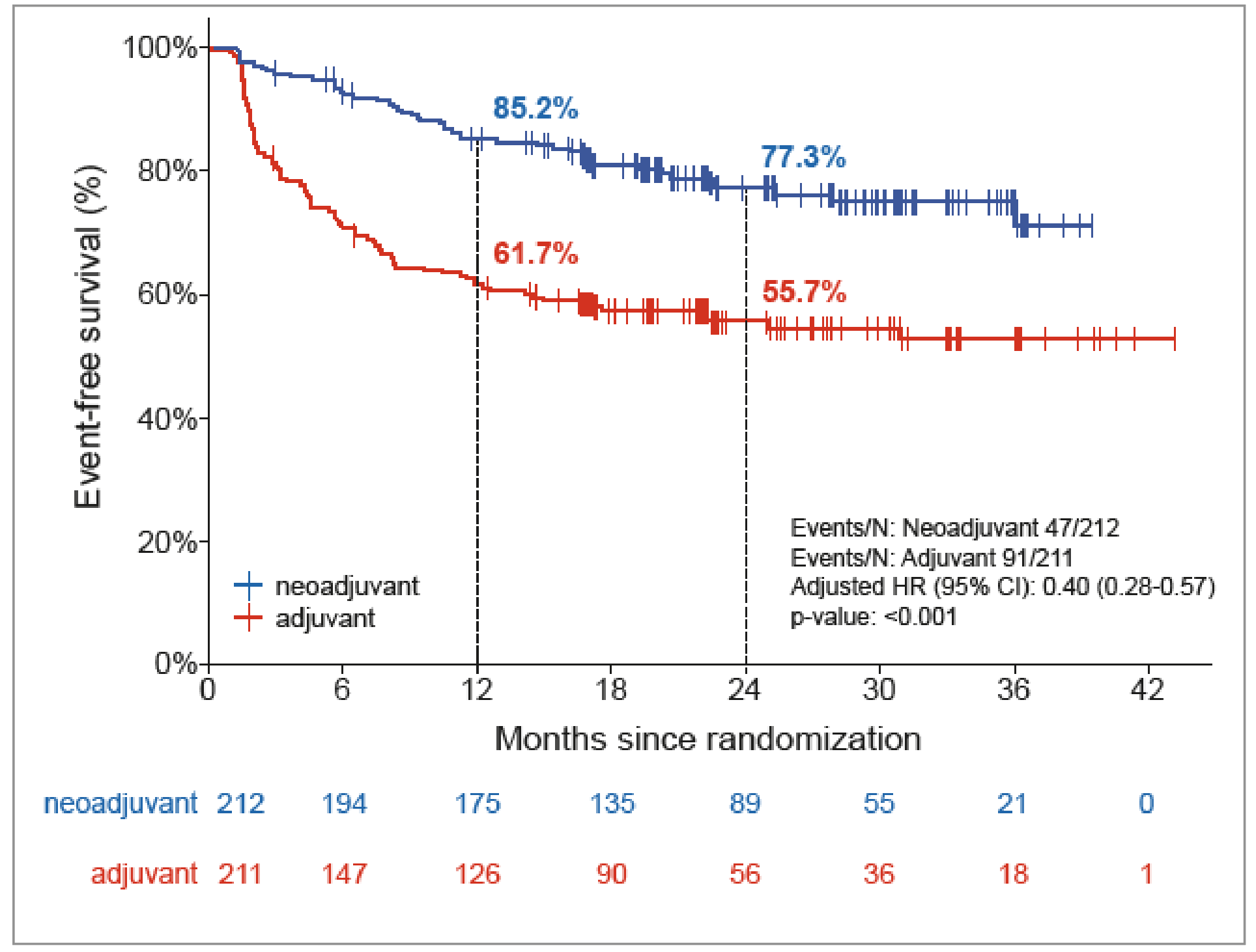
Figure 1 – NADINA : courbe de Kaplan-Meier de la survie sans événement des patients (HR = 0,40).

Figure 2 – NADINA : courbe de Kaplan-Meier de la survie sans métastase à distance actualisée des patients (HR = 0,43).
• En cas de réponse pathologique complète, la survie sans récidive (SSR) et la SSMD sont excellentes (95,1 et 98 % respectivement).
• Cela paraît moins évident pour les patients avec une réponse quasi complète (moins de 10 % de cellules tumorales vivaces) qui n’ont pas reçu de traitement adjuvant et qui semblent aller moins bien avec des courbes qui se croisent : la SSR est à 69,4 contre 81,2 % des patients avec une réponse partielle qui eux ont reçu un traitement adjuvant. La SSMD est équivalente pour ces deux populations : 78,5 et 81,2 % respectivement (Fig. 3).
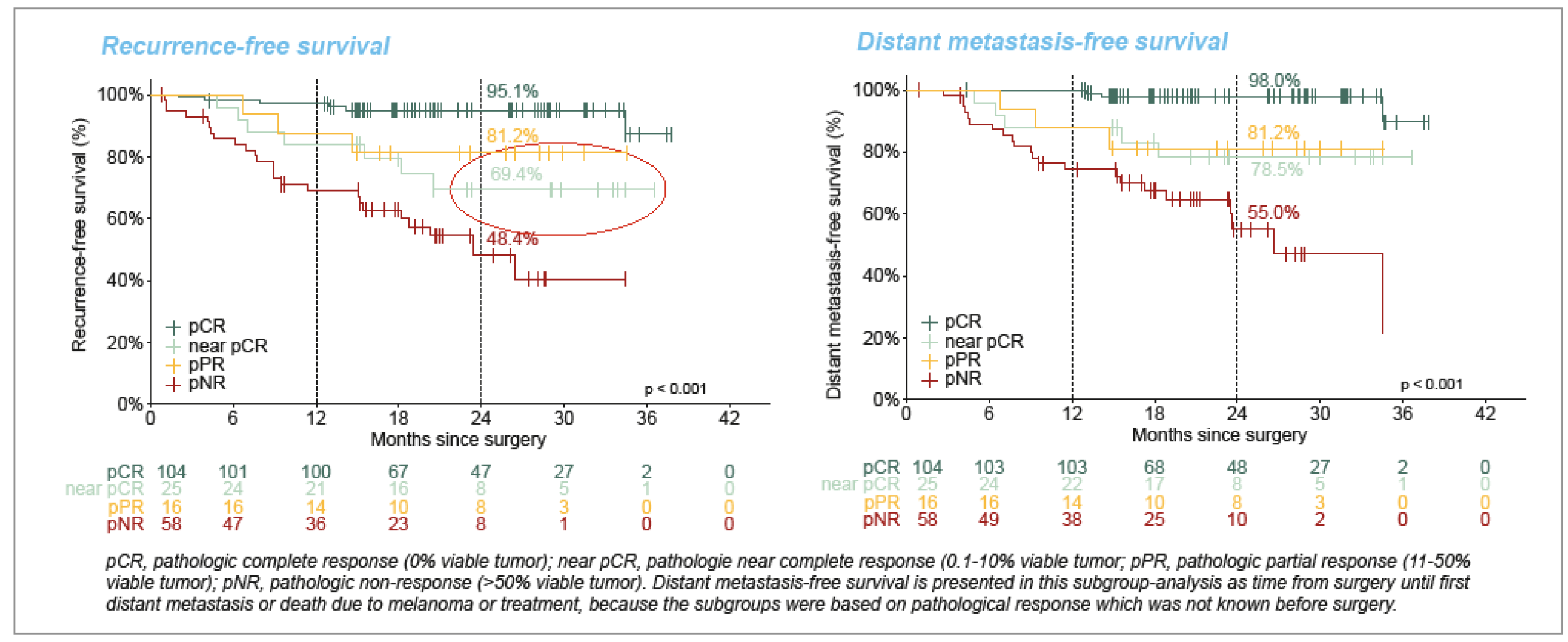
Figure 3 – NADINA : survie sans récidive et survie sans maladie à distance selon la réponse pathologique dans le bras néoadjuvant.
On constate chez les patients traités dans le bras néoadjuvant après chirurgie par une thérapie ciblée un taux de récidive de près d’un tiers.
La tolérance
Quant à la tolérance, on retrouve logiquement plus d’événements de grade supérieur ou égal à 3 dans le bras néoadjuvant (31,1 versus 15,9 %) par rapport au bras adjuvant.
Les signatures IFN-γ, TMB et PD-L1
Des analyses exploratoires ont montré l’intérêt des signatures IFN-γ, TMB et du niveau d’expression de PD-L1 : dans le bras néoadjuvant, une signature IFN-γ positive, un TMB élevé et une forte expression de PD-L1 sont corrélés à une meilleure SSE, alors que, dans le bras adjuvant, ressortent essentiellement la signature IFN-γ et l’expression de PD-L1.
Ces signatures ne sont malheureusement pas disponibles en pratique courante.
En pratique
D’excellent résultats du traitement néoadjuvant par ipilimumab + nivolumab en cas de réponse histologique complète, en revanche, en cas de réponse quasi complète (moins de 10 % de cellules tumorales vivaces), les courbes sont un peu préoccupantes et posent la question de la poursuite d’un traitement adjuvant.
• Lucas MW, Menzies AM, Dimitriadis P et al. Two-year clinical update and first biomarker analyses of the phase III NADINA trial comparing neoadjuvant nivolumab plus ipilimumab versus adjuvant nivolumab in resectable stage III melanoma. Ann Oncol 2025 ; 36 : LBA57.
TOP 2 – Données à 3 ans du pembrolizumab en néoadjuvant de l’étude SWOG S1801
Il s’agit de la première étude qui a proposé l’évaluation d’une stratégie néoadjuvante dans les mélanomes de stade III macroscopiques.
L’étude SWOG S1801
Dans cette étude de phase II, des patients présentant un mélanome de stade IIIB-IV opérable, cutané, acral ou muqueux, ont été randomisés (1:1) entre :
• un schéma adjuvant, chirurgie suivie de 18 cycles de pembrolizumab/3 semaines,
• un schéma néoadjuvant, trois cycles de pembrolizumab avant chirurgie puis 15 nouveaux cycles.
Le critère principal était la SSE. Dans cette actualisation à 3 ans, la définition de la SSE a été harmonisée avec celle de l’étude NADINA (progression avant la chirurgie, récidive après chirurgie, et décès de toute cause). Une revue centralisée de la réponse pathologique a été réalisée. Une analyse exploratoire des sous-groupes des patients avec un mélanome muqueux, acral ou de stade IV réséqué a été également menée.
Les résultats
• Le bénéfice en SSE est toujours présent à 3 ans dans le groupe néoadjuvant (HR = 0,67 ; IC 95 % : 0,42-0,94) : 68 % (IC 95 % : 62-76) versus 56 % (IC 95 % : 48-64) (Fig. 4).
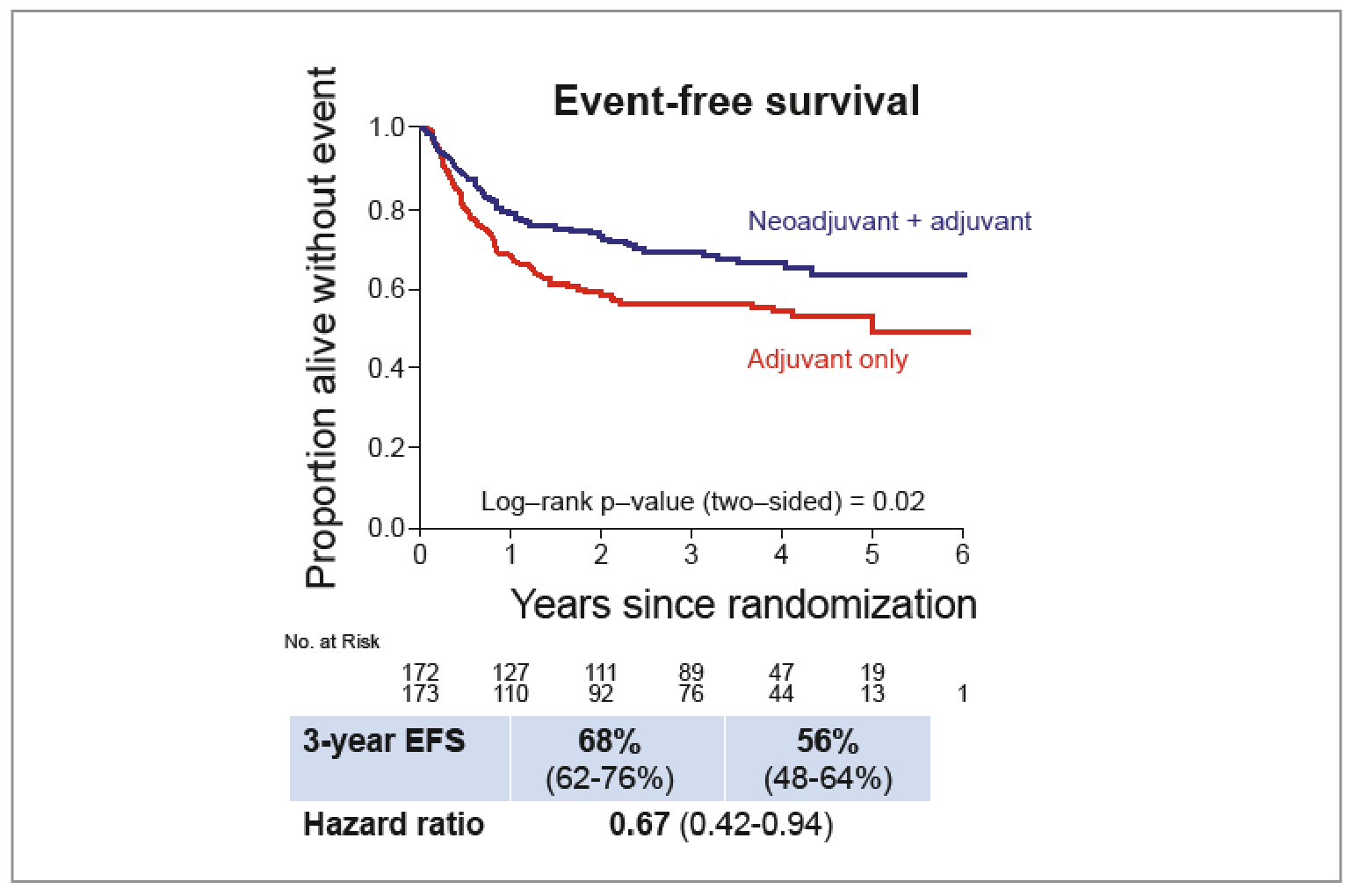
Figure 4 – SWOG S1801 : données de survie sans événement à 3 ans.
• Il existait aussi un gain en SSR supérieur dans le groupe néoadjuvant + adjuvant avec un HR de 0,42 (IC 95 % : 0,27-0,67 ; p = 0,0002), et une SSR à 3 ans de 80 contre 60 % pour l’adjuvant.
• Quant à la SG, pas encore mature, elle semble néanmoins favorable dans le groupe néoadjuvant + adjuvant, avec un HR de 0,66 (IC 95 % : 0,42-1,02 ; p = 0,06), et une SG à 3 ans de 84 contre 73 % (Fig. 5).
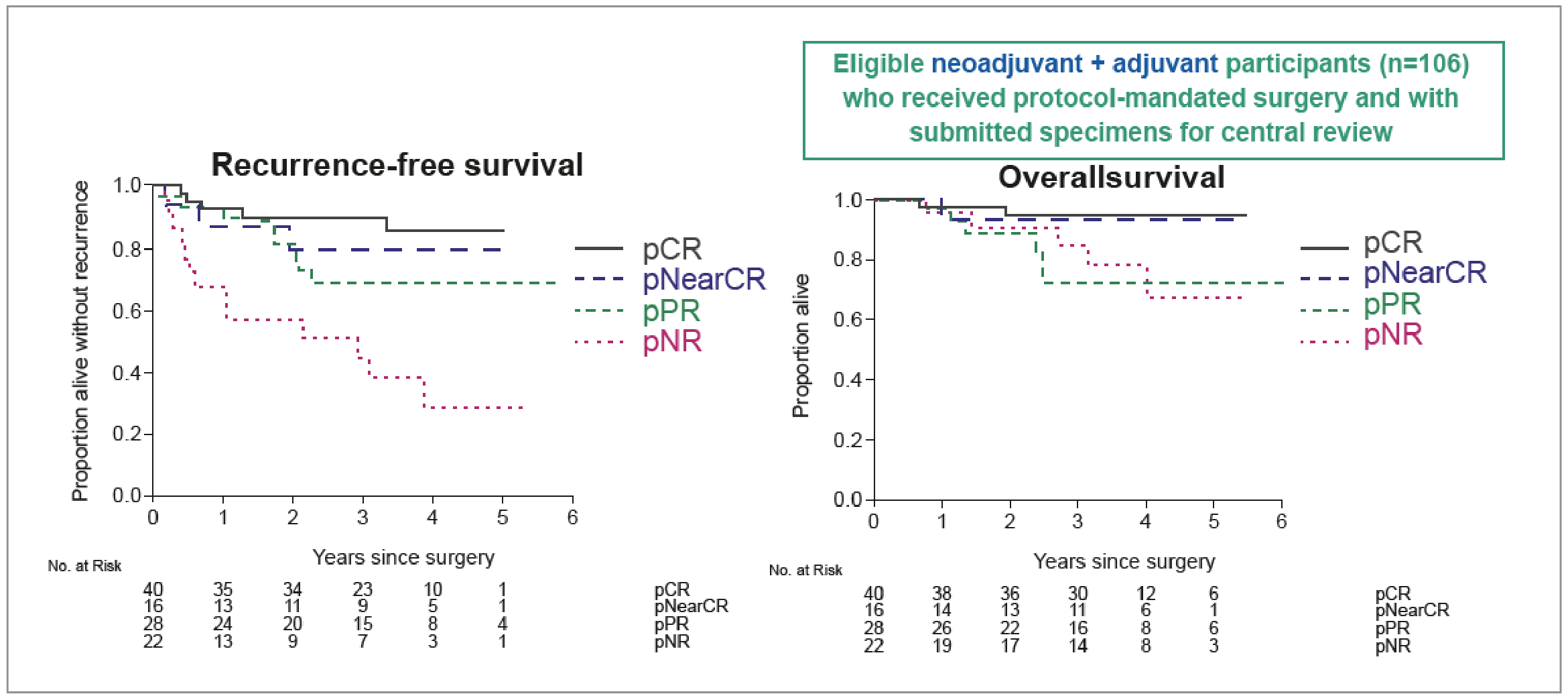
Figure 5 – SWOG S1801 : survie sans récidive et survie globale en fonction de la réponse pathologique.
• Pas de nouveau signal de toxicité (événements indésirables de grades 3-4 : 21 versus 18 %).
• Un bénéfice est retrouvé pour les stades IV (n = 32), mélanome acral (n = 9) et muqueux (n = 5), mais sur de petits effectifs.
• L’évaluation de la réponse pathologique (relecture centralisée chez 106 patients) a montré que l’obtention d’une réponse complète est un marqueur prédictif de réponse. Les taux de réponse complète (RC) histologique ont été de 37,7 % et ceux de quasi RC de 52,8 %. Contrairement à l’étude NADINA, les courbes de SSR et de SG restent tout à fait favorables en cas de quasi RC.
En pratique
Ces résultats avec le pembrolizumab sont tout à fait encourageants, mais vers quelle stratégie s’orienter dans les stades III ? On constate avec Ipi + Nivo un plus grand nombre de réponses complètes histologiques (52 versus 37,7 %), avec des patients qui ont dans cette situation un pronostic excellent, mais au prix d’une toxicité deux fois plus importante à prendre en compte. Un bémol, en France, il n’y a pas de remboursement actuellement de l’Ipi + Nivo dans cette indication.
• Sondak VK, Patel SP, Othus M et al. 3-year survival with neoadjuvant-adjuvant pembrolizumab from SWOG S1801. Ann Oncol 2025 ; 36 : 1601O.
TOP 3– En adjuvant, les résultats à 9 ans de l’essai de phase III CheckMate 238 comparant le nivolumab à l’ipilimumab dans le mélanome réséqué de stade IIIB-C ou IV
Pour rappel, il s’agit d’un essai pivotal qui a conduit à l’AMM du nivolumab en situation adjuvante sur des données de SSR/SSMD (FDA 2017, EMA 2018). Les résultats finaux à 9 ans ont été présentés ainsi que des analyses post hoc incluant la SSP jusqu’à la ligne suivante (SSP2), la survie spécifique au mélanome (SSM) et l’effet du calendrier d’administration des doses.
L’étude CheckMate 238
Cette étude proposait à des patients avec un mélanome de stade IIIB-C ou stade IV réséqués de recevoir soit du nivolumab 3 mg/kg toutes les 2 semaines (n = 453), soit de l’ipilimumab 10 mg/kg toutes les 3 semaines, quatre cycles puis toutes les 12 semaines (n = 453), pendant 1 an ou jusqu’à récidive/toxicité inacceptable.
L’objectif principal était la SSR et, les objectifs secondaires, la SG et la tolérance. Dans les analyses exploratoires étaient évaluées la SSMD, la SSP2 et la SSM.
Il s’agit de l’étude en situation adjuvante avec le plus long recul, dont les résultats ont été publiés le même jour que la présentation dans le New England Journal of Medicine.
Les résultats
Les données de suivi à 9 ans montrent tout d’abord que la moitié des patients ont récidivé.
• La SSR et la SSMD sous nivolumab restent supérieures à celles sous ipilimumab (HR : 0,76 et HR : 0,81 ; IC 95 % : 0,65-1,00) (Fig. 6).
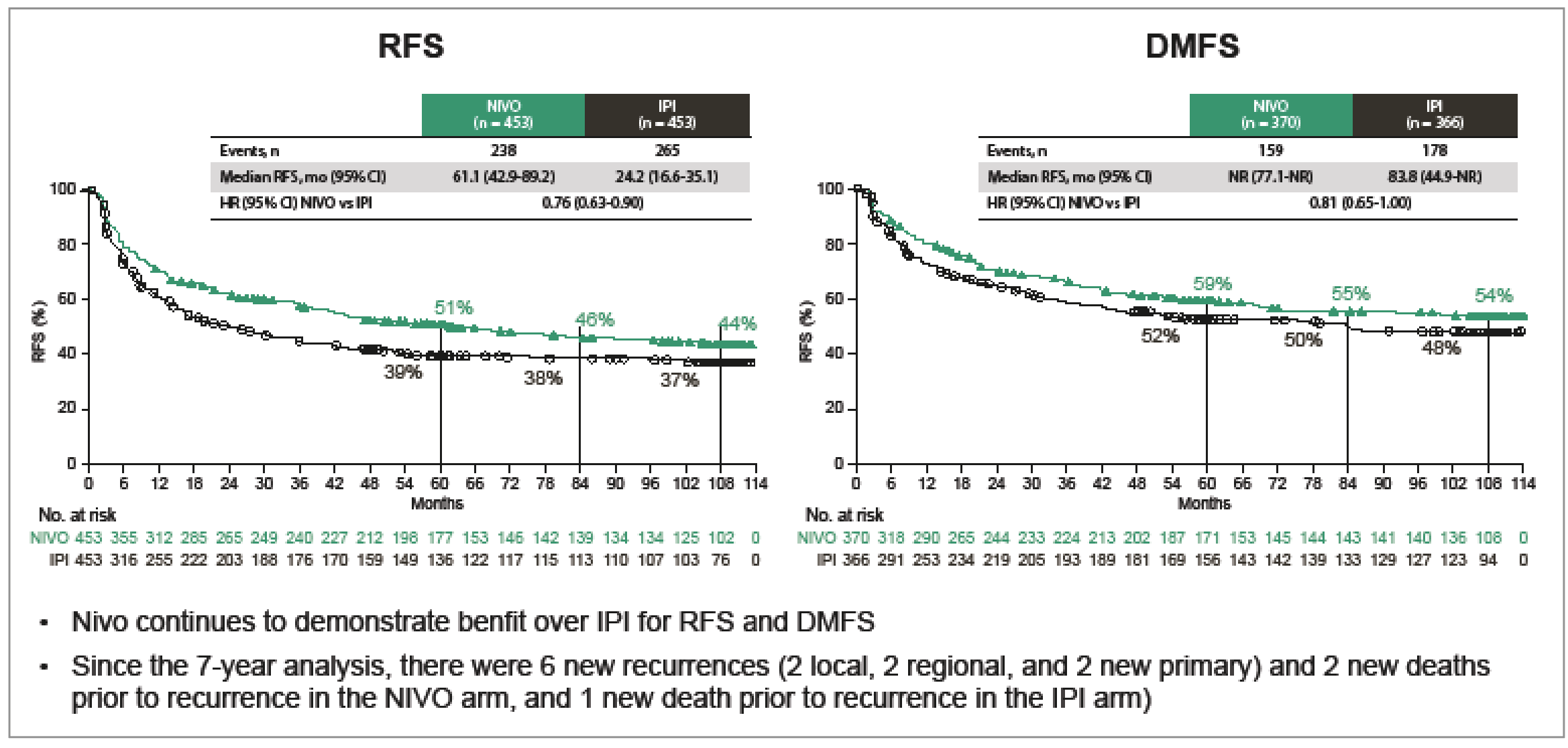
Figure 6 – CheckMate 238 : données de survie sans récidive et survie sans maladie à distance.
• Les médianes de SG et de SSM n’étaient pas encore atteintes, les taux demeuraient élevés, pour la SG : 69 versus 65 % et pour la SSM : 74 versus 70 % (Fig. 7), mais pas de gain en SG ou SSM du nivolumab par rapport à l’ipilimumab.
 Figure 7 – CheckMate 238 : données de survie globale et de survie spécifique au mélanome.
Figure 7 – CheckMate 238 : données de survie globale et de survie spécifique au mélanome.
• Il a été constaté que les patients recevaient moins de traitements systémiques ultérieurs après nivolumab (45 versus 51 %).
• Dans les analyses post hoc, il existait une tendance à l’amélioration de la SSR (avec une médiane quasi doublée) en cas d’administration le matin avant 13 h, mais non significative (Fig. 8), ainsi qu’une amélioration de la tolérance.
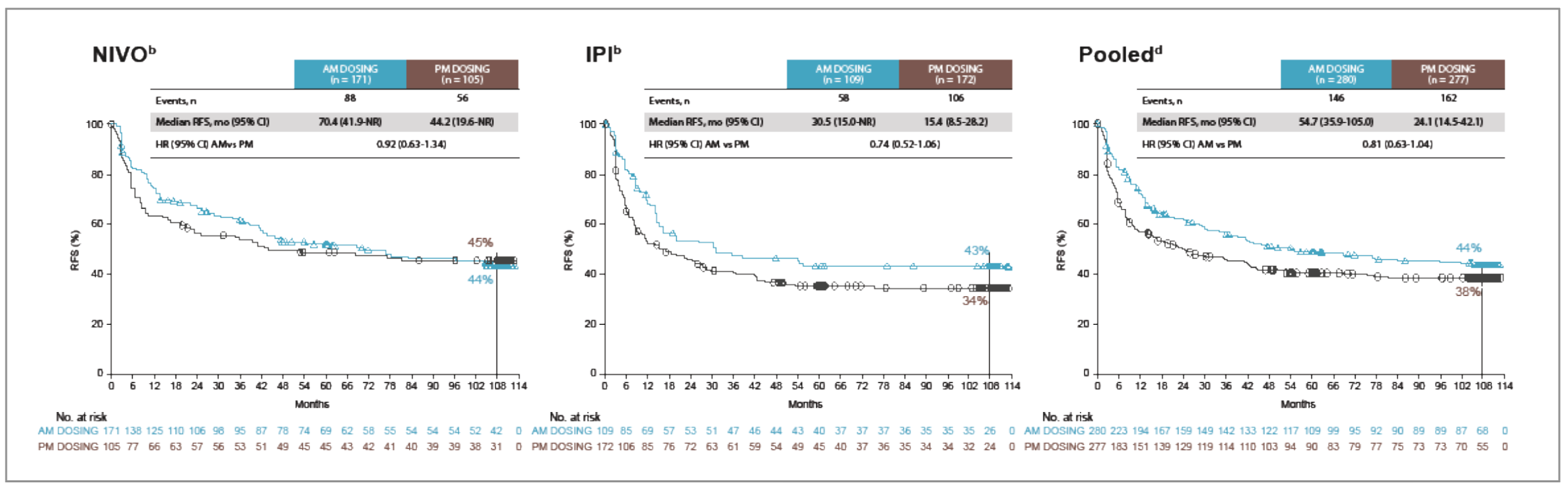
Figure 8 – CheckMate 238 : survie sans récidive ipilimumab et nivolumab en fonction de l’heure d’administration.
Des résultats équivalents avaient d’ailleurs été constatés dans les cancers métastatiques du poumon.
En pratique
En adjuvant, le nivolumab reste supérieur à l’ipilimumab en termes de SSR et de survie sans maladie à distance, mais sans bénéfice en termes de survie. Les données sur un éventuel bénéfice sur une administration le matin sont probablement encore insuffisantes pour nous faire changer nos pratiques.
• Ascierto PA, Del Vecchio M, Merelli B A et al. Final, 9-year results from the CheckMate 238 phase III trial of adjuvant nivolumab vs ipilimumab in resected stage IIIB–C or IV melanoma. Ann Oncol 2025 ; 36 : 1609MO.
TOP 4– Évaluation de l’efficacité et de la sécurité de l’IMA203, une thérapie cellulaire T dirigée contre PRAME dans le mélanome uvéal avancé ou métastatique
Le mélanome uvéal est une tumeur rare, qui se caractérise par une charge mutationnelle très faible avec peu d’efficacité des inhibiteurs de checkpoint, anti-PD-1 et anti-PD-1 + anti-CTLA4.
Près de la moitié des patients vont développer une maladie métastatique avec, dans plus de 90 % des cas, une atteinte hépatique. Le pronostic à ce stade est très défavorable.
PRAME (Preferentially Expressed Antigen in MElanoma) est exprimé dans 90 % des mélanomes uvéaux et constitue un biomarqueur pronostic. Anzu-cel (ou IMA203) est une immunothérapie cellulaire utilisant les lymphocytes T du patient dont le récepteur T a été modifié génétiquement pour reconnaître les peptides de PRAME présentés par les molécules HLA A*02:01 à la surface des cellules tumorales.
L’étude
Dans cette étude de phase I, les patients avec un mélanome uvéal métastatique devaient être HLA A*02:01 et la tumeur exprimer PRAME. Dans les critères d’inclusion, il y avait : une maladie mesurable, un ECOG 0 à 1, l’absence de métastase cérébrale active.
L’objectif principal était la tolérance et, l’objectif secondaire, l’efficacité.
Les lymphocytes T périphériques autologues étaient prélevés par leucaphérèse puis génétiquement modifiés (procédure d’environ 2 semaines). Les patients subissaient une lymphodéplétion (cyclophosphamide 500 mg/m2 et fludarabine 30 mg/m2 pendant 4 jours), puis recevaient une seule administration d’IMA203 avec de l’IL-2 à faible dose en sous-cutané (1 million UI par jour pendant 5 jours puis deux fois par jour pendant 5 jours) (Fig. 9).
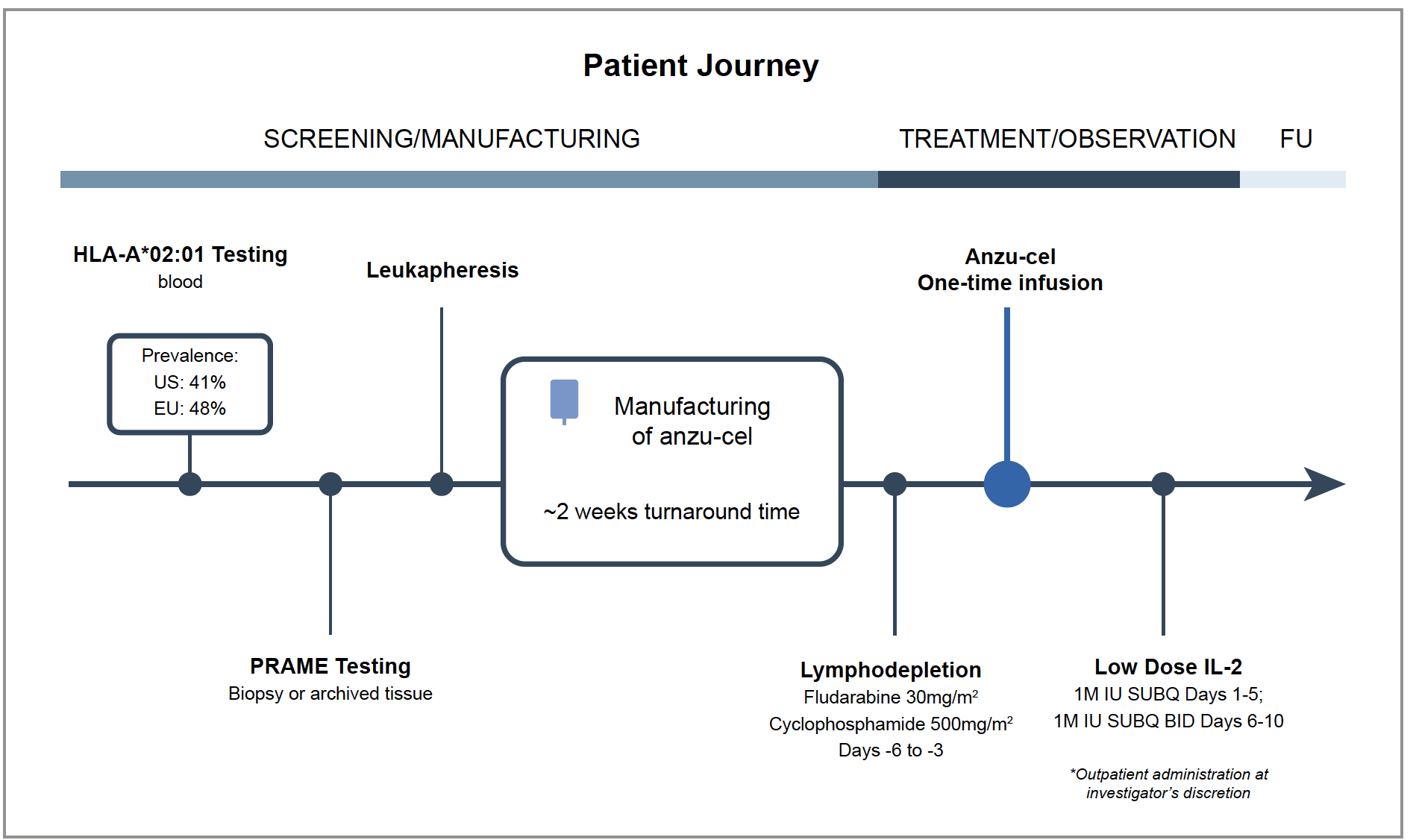
Figure 9 – Procédure et schéma de l’étude.
Les résultats
Les résultats des 16 patients avec un mélanome uvéal évaluable de la phase Ib d’expansion ont été présentés.
Les LDH étaient augmentées dans 56 % des cas, une majorité de stade M1b, 81 % présentaient une atteinte à la fois hépatique et extra-hépatique. Les patients avaient reçu en moyenne deux lignes de traitement antérieur et 62,5 % le tébentafusp.
La tolérance
Dans les effets secondaires, essentiellement des cytopénies de grades 3-4 (neutropénie et anémie), en lien avec la lymphodéplétion chez 99 % des patients. Un syndrome de relargage cytokinique a été constaté chez 95 % des patients, avec seulement 11 % de grade 3. Des manifestations neurotoxiques (ICANS) de grade 2 sont survenues chez deux patients. Aucun décès toxique n’a été rapporté.
Les réponses
• En termes de réponse, 67 % des patients ont présenté une réponse objective confirmée avec, pour tous, une diminution du volume tumoral (Fig. 10). La durée médiane de réponse était de 11 mois (intervalle : 4,4-31,6).
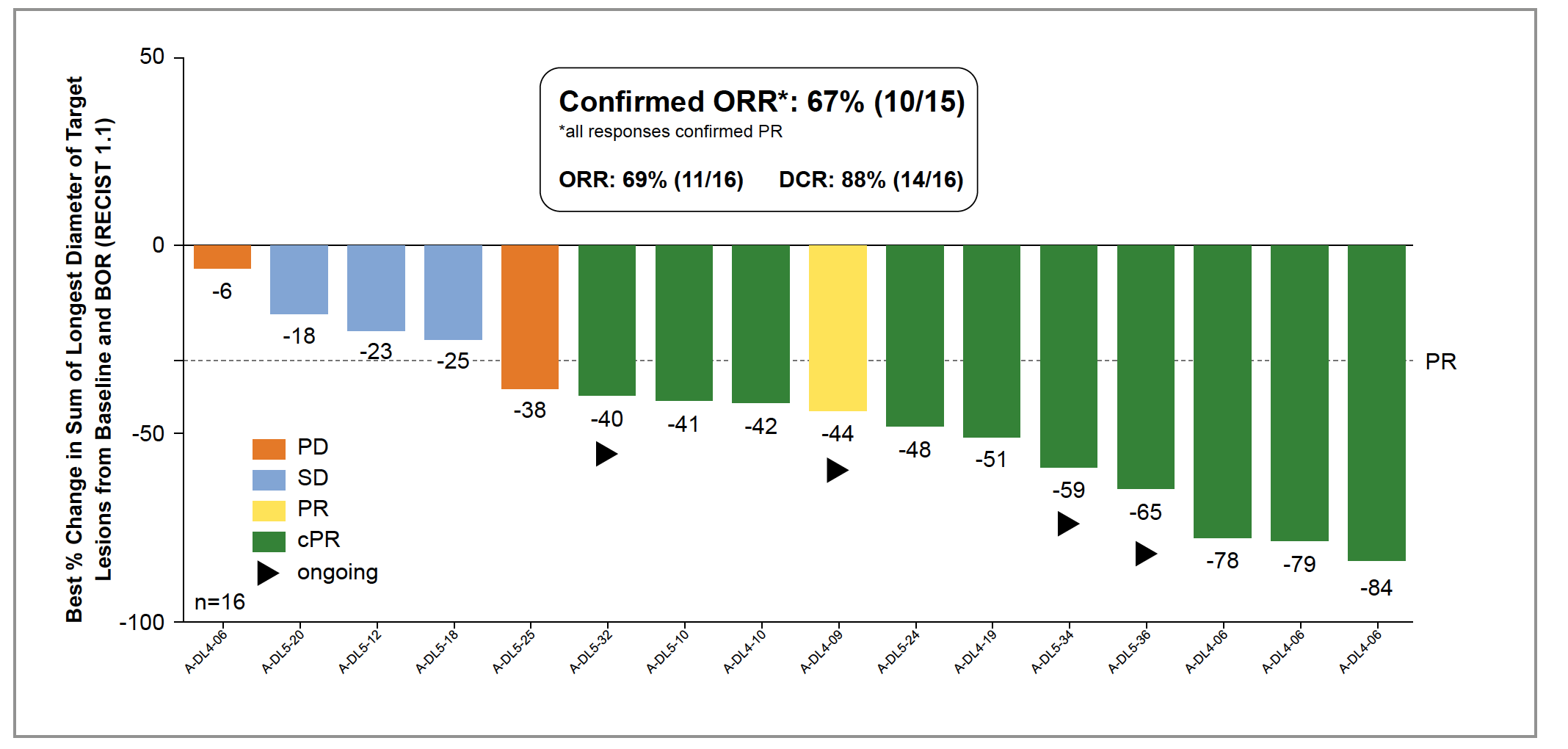
Figure 10 – Taux de réponse.
• Avec une médiane de suivi de 10,4 mois, la SSP médiane était de 8,5 mois. La SSP à 6 mois était de 69 % et à 12 mois de 39 %.
• Avec une médiane de suivi de 14,3 mois, la médiane de survie globale n’a pas été atteinte (4,3+-34,2+) avec une SG à 1 an estimée à 71 %.
En pratique
En conclusion, le profil de tolérance paraît acceptable, avec des CRS majoritairement de grades 1-2 , un taux de réponse important de 67 %, avec une durée médiane de réponse de 11 mois et une médiane de survie globale non atteinte. C’est une approche prometteuse, mais il s’agit de résultats préliminaires sur un faible nombre de patients et accessible à une population sélectionnée du fait d’une procédure lourde.
• Patel SP, Tsimberidou AM, Like JJ et al. Efficacy and safety of IMA203, a PRAME-directed T-cell receptor (TCR) T-cell therapy, in patients with previously treated advanced or metastatic uveal melanoma from a Ph 1 trial. Ann Oncol 2025 ; 36 : 1600O.
TOP 5– Une étude de preuve de concept chez des patients très âgés traités pour des carcinomes épidermoïdes cutanés non résécables ou récurrents avec des doses réduites de nivolumab, avec des résultats assez spectaculaires et très peu de toxicité
Il existe des données de pharmacocinétique qui montrent qu’une saturation des récepteurs PD-1 est possible avec des doses bien inférieures aux standards. Une publication d’une équipe indienne a rapporté une efficacité avec du nivolumab à la dose de 20 mg/m2 toutes les 3 semaines avec moins d’effets secondaires. Il y a eu également, à un moment donné, en France, des problèmes d’accès au cémiplimab qui n’étaient plus pris en charge dans cette indication.
L’étude
Dans cette étude rétrospective monocentrique portant sur 18 patients, la population était particulièrement âgée, avec un âge moyen de 88 ans et, de ce fait, de grandes fragilités. Les patients devaient avoir reçu au moins deux cycles de nivolumab à la dose de 20 mg à 3 semaines d’intervalle.
Ils présentaient une évolution cutanée ou ganglionnaire d’un carcinome épidermoïde cutané au niveau tête et cou, zones particulièrement exposées aux UV, avec une forte charge mutationnelle.
Le critère de jugement principal était la SSP à 6 mois. Ont été évaluées également la réponse selon RECIST et la tolérance.
Les résultats
Le nombre de cycles administrés a été en moyenne de six, la SSP à 6 mois était à 72 %, mais avec six patients dont le suivi était de moins de 6 mois. Le taux de réponse était de 72 % (10 RP et 3 RC). Il n’y a eu aucun effet secondaire de grade III/IV (Fig. 11).
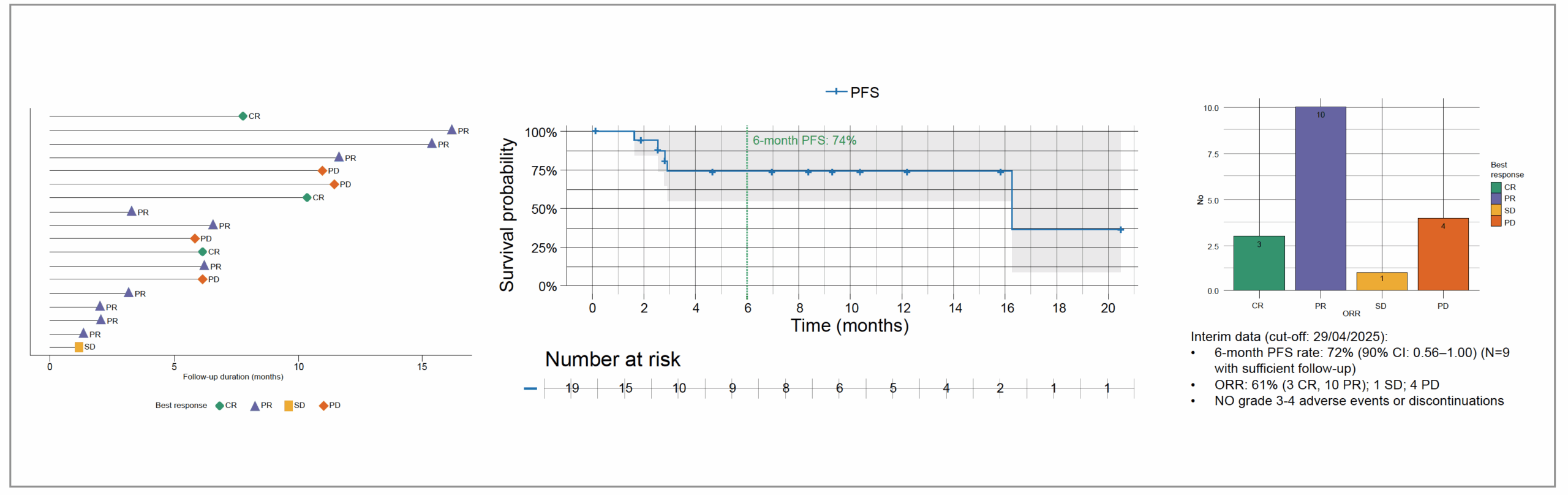
Figure 11 – Données de suivi, de survie sans progression et taux de réponse du nivolumab à dose réduite.
En pratique
Ces résultats sont donc très encourageants avec une SSP au moins équivalente à celle du cémiplimab et un réel intérêt médico-économique. Une confirmation est nécessaire avec la mise en place d’essais prospectifs.
• Patil VM, Noronha V, Menon N et al. Low-dose immunotherapy in head and neck cancer: a randomized study. J Clin Oncol 2023 ; 41 : 222-32.
• Gauduchon T, Amini Adle M, Neidhardt EM et al. Proof of concept study of low-dose nivolumab in cancers with unresectable cutaneous squamous cell carcinoma. Ann Oncol 2025 ; 36 : 1663P.
Ève-Marie Neidhardt-Bérard déclare avoir des liens d’intérêt avec Immunocore, Novartis, BMS.


