Résumé
Le cancer du sein avec amplification de HER2 constitue environ 20 % de l’ensemble des cancers du sein. Les thérapeutiques anti-HER2 ont révolutionné la prise en charge de ces cancers et ainsi modifié leur pronostic, avec notamment l’avènement des anticorps monoclonaux anti-HER2 à partir des années 2000, en situation métastatique, adjuvante et néoadjuvante. Si l’arsenal thérapeutique s’est progressivement enrichi dans le ciblage des récepteurs de la famille HER, l’apparition de phénomènes d’échappement au cours des traitements anti-HER2 a conduit au développement de nouvelles stratégies thérapeutiques. Le développement de nouveaux anticorps conjugués ciblant HER2, avec de nouvelles propriétés de relargage intracellulaire et une charge plus forte en chimiothérapie a permis d’élargir à la fois le spectre nosologique et thérapeutique. Cette revue propose un état des lieux des nouvelles stratégies thérapeutiques ainsi que les perspectives dans la prise en charge des cancers du sein HER2-positifs en situation adjuvante et métastatique.
Abstract
Therapeutic strategies in HER2-positive breast cancer: where do we stand?
Breast cancer with HER2-amplification accounts for 20% of breast cancers. The management of patients has dramatically changed with the advent of anti-HER2 treatment, especially the monoclonal antibodies since 2000 in the metastatic and (neo)-adjuvant setting, leading to an improvement of patient outcomes. If therapeutic arsenal has been gradually enhanced with the targeting of HER receptor’s family, resistances to these treatments are observed, hence the development of new therapeutic strategies. The advent of new conjugated antibodies targeting HER2, with new intracellular release properties and a higher load in chemotherapy has allowed to broaden both the nosological and therapeutic spectrum. This review provides an updated look of novel therapeutic strategies in HER2-positive breast cancer, as well as future perspectives, both in the adjuvant and metastatic setting.
Introduction
Le statut HER2-positif
L’oncogène HER2/neu (ERBB2) est amplifié dans 20 % des cancers du sein et constitue historiquement un facteur pronostique de rechute et de survie globale défavorable. La surexpression de la protéine HER2 est associée à un haut degré de malignité avec un index de prolifération élevé, un moindre degré de différenciation, et un risque initial plus élevé de dissémination métastatique ganglionnaire (1). Le statut dit “HER2-positif” (HER2+) émane d’une analyse immuno-histochimique avec un score à +++ pour l’expression de la protéine et/ou, en cas de score ++, de la mise en évidence d’une amplification du gène par technique d’hybridation in situ (avec notamment un comptage des signaux HER2 par rapport au centromère du chromosome 17) (2). Par ailleurs, 10 % des cancers du sein présentent à la fois une surexpression d’HER2 et une expression des récepteurs aux œstrogènes et/ou à la progestérone (RE/RP) ; cette surexpression d’HER2 leur confère une résistance relative à l’hormonothérapie (3, 4).
Les anticorps monoclonaux
La prise en charge du cancer du sein HER2+ a radicalement changé ces 20 dernières années, avec le développement de l’anticorps monoclonal anti-HER2, le trastuzumab, désormais pierre angulaire du traitement des cancers HER2-positifs, en situation néoadjuvante, adjuvante et métastatique (5-7). Par la suite, le pertuzumab, anticorps monoclonal qui reconnaît un autre épitope sur HER2 impliqué dans l’hétéro-dimérisation des molécules de la famille HER a été développé et reste le traitement standard en première ligne des cancers du sein métastatiques HER2+ en association aux taxanes et au trastuzumab (8).
Les anticorps conjugués
Il a ensuite été développé le trastuzumab-DM1 (T-DM1) en situation de deuxième ligne, un anticorps conjugué de première génération, permettant de combiner l’activité du trastuzumab tout en délivrant un agent inhibiteur du fuseau mitotique (dérivé de la maytansine) directement aux cellules néoplasiques exprimant HER2. Ce traitement a supplanté à l’époque l’association lapatinib et capécitabine (9), avec une action d’inhibition réversible des domaines kinases de HER2 et HER1 (10).
Cependant, malgré ces avancées thérapeutiques majeures, presque tous les patients présentent in fine des phénomènes d’échappement aux traitements anti-HER2, et donc des progressions carcinologiques (résistantes acquises ou de novo). En outre, environ 50 % des patients développent des métastases cérébrales au cours de l’évolution du cancer (11). Dans ce contexte, ces dernières années ont vu émerger de nouveaux anticorps conjugués, associés à une concentration plus importante en chimiothérapie et un effet by-stander, avec notamment le trastuzumab-déruxtécan (T-DXd) qui vient à nouveau révolutionner la prise en charge du cancer du sein HER2+, actuellement disponible en situation de deuxième ligne (12).
Dans ce sillage, d’autres molécules, anticorps monoclonaux ou inhibiteurs de tyrosine kinase, sont actuellement à l’étude, en attente de remboursement ou déjà disponibles en accès précoce.
Cette revue vise à exposer les nouvelles stratégies thérapeutiques en situation localisée et métastatique pour la prise en charge des cancers du sein HER2+.
En situation adjuvante
Quelle durée de traitement par trastuzumab ?
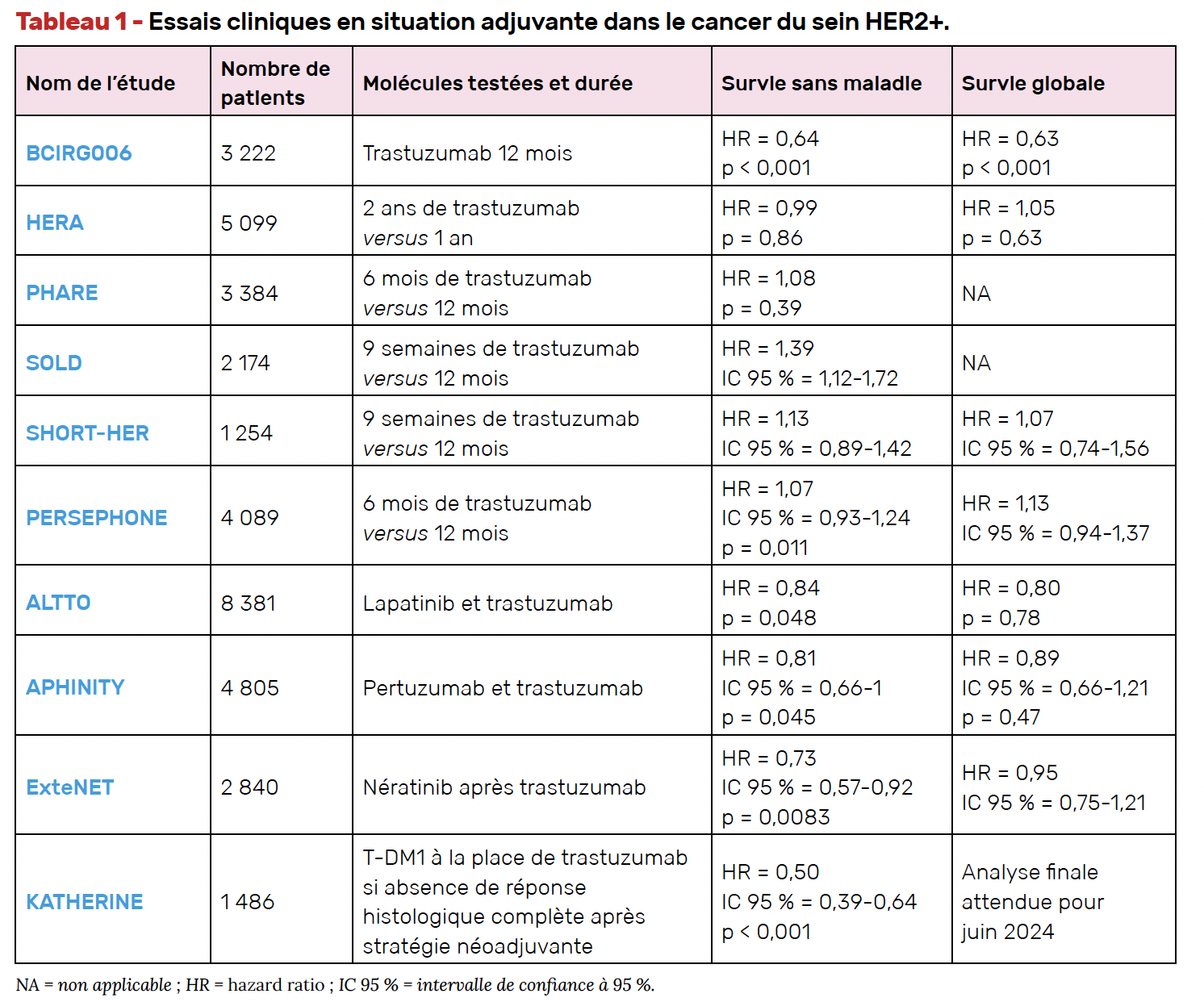
Les bénéfices significatifs en termes de survie sans progression et de survie globale des essais randomisés associant trastuzumab et chimiothérapie ont fait du trastuzumab un nouveau standard thérapeutique dès 2005 (6, 13). Si la durée de traitement par trastuzumab dans ces essais était de 12 mois, de nombreuses études se sont intéressées à des durées plus longues ou plus courtes de traitement.
Plus de 12 mois ?
• L’étude HERA comportait un bras de traitement par trastuzumab pour une durée de 2 ans, mais les résultats n’ont pas montré de bénéfice additionnel à cette prolongation (14). Cette étude a par ailleurs montré un risque de récidive majoré en cas de négativité des récepteurs hormonaux (15).
Moins de 12 mois ?
A contrario, dans une volonté de désescalade et de préservation cardiaque, il a été étudié la possibilité de réduire cette durée de traitement.
• L’essai de non-infériorité PHARE, qui a inclus plus de 3 000 patients, n’a pas permis de montrer que 6 mois de traitement par trastuzumab étaient équivalents à 12 mois de traitement (16).
• L’essai clinique SOLD n’a pas permis de démontrer la non-infériorité de 9 semaines en comparaison à 12 mois de traitement, dans une population de plus de 2 000 patientes (17).
• L’essai clinique SHORT-HER, qui évaluait 9 semaines de traitement par trastuzumab, n’avait pas réussi initialement à démontrer la non-infériorité d’un traitement court, mais après ré-analyse des données, il a été objectivé pour les patientes à risque faible et intermédiaire que la survie sans maladie était identique dans le groupe 9 semaines et le groupe 12 mois de traitement. Cependant, il ne s’agit que d’une analyse en sous-groupes qui ne permet pas de modifier la stratégie standard (18).
• Enfin, l’essai clinique PERSEPHONE, qui cherchait également à évaluer l’efficacité d’un schéma court de trastuzumab, a randomisé plus de 4 000 patientes et a objectivé une non-infériorité du bras 6 mois par rapport au bras 12 mois en termes de survie sans maladie et de survie globale. Cette non-infériorité n’a cependant pas été vérifiée pour les tumeurs sans expression des récepteurs hormonaux (RH-), les traitements par taxanes exclusifs, et dans le cas de traitements concomitants avec la chimiothérapie. En outre, il est à noter que la borne choisie pour l’intervalle de confiance tolérait jusqu’à 3 % d’efficacité en moins (19).
Quelle possibilité de désescalade chez les bas risques ?
• L’étude de phase II monobras menée par l’équipe de Tolaney et al. a testé un schéma de chimiothérapie sans anthracyclines pour des tumeurs de moins de 3 cm sans envahissement ganglionnaire. Les résultats à 7 ans ont été publiés en 2019, avec une survie sans rechute à 93 % (IC 95 % = 90,4-96,2) et une survie globale de 95 % (IC 95 % = 92,4-97,7). Pour la population RE+, la survie sans rechute à 7 ans est de 94,6 % (20).
Cette étude a fait admettre en pratique courante qu’une tumeur de moins de 3 cm sans envahissement ganglionnaire peut être traitée en situation adjuvante par la combinaison paclitaxel hebdomadaire et trastuzumab, sans anthracycline.
• Les résultats de survie à 10 ans viennent d’être publiés en mars 2023 et renforcent les données à 7 ans, avec un taux de survie sans maladie invasive à 91,3 % (IC 95 % = 88,3-94,4) et un taux de survie globale à 94,3 % (IC 95 % = 91,8-96,8) (21).
Quid de l’escalade thérapeutique chez les hauts risques ?
Dans une visée stratégique de double blocage concomitant ou séquentiel, il a été étudié la possibilité d’adjoindre au trastuzumab, d’autres molécules.
Trastuzumab + lapatinib
• L’étude de phase III ALTO, publiée en 2015, a évalué l’administration concomitante ou séquentielle du lapatinib en plus du trastuzumab (avec plus de 8 000 patientes incluses). Il n’a pas été noté de différence significative en termes de survie entre les groupes, que le traitement soit séquentiel ou associatif, sans avantage pour un sous-groupe particulier. De plus, le taux d’effets secondaires était plus élevé dans les bras qui comportaient le lapatinib (diarrhées, perturbations hépatobiliaires, toxicités cutanées et neutropénies) (22).
Trastuzumab + pertuzumab
• L’étude de phase III APHINITY a posé la question de l’adjonction du pertuzumab au trastuzumab avec des résultats qui objectivent une réduction absolue du risque de rechute dans la population générale de 2,8, à 4,5 % dans la population avec envahissement ganglionnaire, ainsi que dans la population RH+ (23).
Ce gain, considéré comme modeste et non cliniquement pertinent, n’a pas abouti à un remboursement de la molécule en France, dans cette indication.
Trastuzumab + nératinib
• Plus récemment, l’étude ExteNET, qui a inclus 2 840 patientes, randomisées entre nératinib (inhibiteur pan-HER oral) et placebo, après avoir reçu un traitement adjuvant par trastuzumab, a montré une survie sans maladie à 3 ans de 88,6 % dans le groupe placebo et de 90,5 % dans le groupe expérimental (HR = 0,73). La différence était plus importante chez les patientes RH+ (89,3 versus 93,6 % ; HR = 0,57), ainsi que chez celles qui avaient terminé le trastuzumab il y a moins de 1 an. La principale toxicité du nératinib est digestive avec des diarrhées de grade 3 constatées dans près de 40 % des cas dans le groupe expérimental (24).
Il a été émis en France, en juin 2020, un avis défavorable au remboursement du nératinib dans le traitement adjuvant prolongé des patientes.
À retenir
In fine, au regard de l’ensemble de ces études dont les résultats sont synthétisés dans le Tableau 1, en situation de cancer localisé, le standard thérapeutique reste 12 mois de trastuzumab adjuvant. Il peut se discuter l’adjonction du nératinib pour les patientes RH+ avec envahissement ganglionnaire (mais les possibilités de remboursement de ce médicament sont toujours en discussion).
En situation néoadjuvante
Quand privilégier un schéma néoadjuvant ?
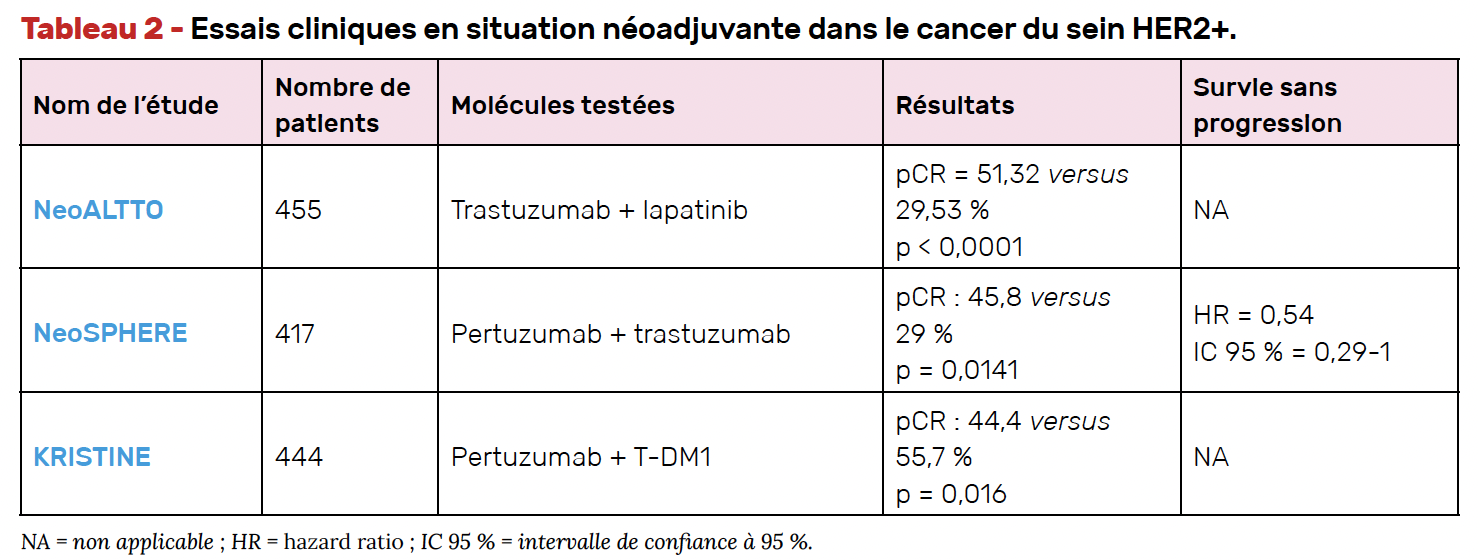
Si les données de l’étude de Tolaney et al. incitent à privilégier une chirurgie première pour les tumeurs de stade I, il faut s’orienter préférentiellement vers une stratégie néoadjuvante à partir des stades II au regard des résultats de l’étude KATHERINE (présentés dans le Tab. 1). En effet, avec un seuil de taille tumorale initiale de 2 cm et en l’absence de réponse complète histologique (pCR) après la chimiothérapie néoadjuvante, un changement de traitement anti-HER2 améliore la survie sans récidive (20).
• Cette étude, qui a randomisé 1 500 patientes, a évalué l’efficacité du T-DM1 post-opératoire par rapport à la poursuite du trastuzumab seul, pour 14 cycles, chez les patientes pour lesquelles il existait un résidu tumoral mammaire ou axillaire à l’issue de la chimiothérapie néoadjuvante. L’objectif principal était de démontrer la supériorité du T-DM1 en termes de survie sans récidive (qu’elle soit locale, locorégionale ou à distance). Il a été objectivé une survie sans récidive à 88,3 % dans le bras T-DM1 contre 77 % dans le bras trastuzumab (HR = 0,50 ; IC 95 % = 0,39-0,64 ; p < 0,001). Ce bénéfice a été observé quels que soient le statut RH ou la taille du résidu tumoral. Il est à noter la survenue plus importante d’effets secondaires dans le bras T-DM1 (25,7 % de toxicités grade
≥ 3 contre 15,4 %).
L’intérêt de préférer une chimiothérapie néoadjuvante pour toutes les situations hors stade I est ainsi démontré. Le T-DM1 est disponible depuis août 2019 dans ces indications. L’importance de la pCR qui est corrélée à la survie, en particulier pour les tumeurs HER2+, comme cela a été montré par la méta-analyse de Cortazar et al., incite à poursuivre les efforts de recherche en situation néoadjuvante afin d’augmenter le taux de pCR (25). En effet, l’absence de cancer invasif résiduel sur la pièce opératoire est associée à un faible risque de rechute, tandis qu’en l’absence de pCR, le risque de rechute est majoré.
Dans ce contexte, d’autres essais cliniques dans cette situation “post-néoadjuvante” sont en cours, à l’instar de l’étude DESTINY-Breast05, étude de phase III randomisée, qui vise à comparer l’efficacité du T-DXd et celle du T-DM1 chez des patientes à haut risque de récidive avec maladie invasive résiduelle après traitement néoadjuvant (26).
Quid d’un double blocage ?
Trastuzumab + pertuzumab
• L’étude de phase II NEOSPHERE a quant à elle évalué l’adjonction du pertuzumab aux schémas de traitement néoadjuvant standard comprenant le trastuzumab pour des tumeurs de plus de 2 cm qui n’avaient pas reçu de traitement antérieur. Ainsi, 417 patientes ont été randomisées entre quatre bras de traitement (trastuzumab + docétaxel, pertuzumab + trastuzumab + docétaxel, pertuzumab + trastuzumab, pertuzumab + docétaxel). Le taux de pCR au niveau du sein était de 45,8 % dans le groupe pertuzumab + trastuzumab + docétaxel contre 29,0 % dans le groupe de référence (trastuzumab + docétaxel), soit une différence absolue de près de 17 points (p = 0,0141) (27). Les données de survie sans progression et de survie sans maladie à 5 ans montrent un bénéfice en faveur de la triple association comparativement au schéma taxane + trastuzumab avec un HR de 0,69.
Si l’agence américaine du médicament (FDA) ainsi que l’agence européenne (EMEA) ont enregistré le pertuzumab dans cette situation néoadjuvante (en association au trastuzumab et à la chimiothérapie par docétaxel), le bénéfice de survie a été jugé insuffisant en France pour justifier un remboursement de la molécule dans cette indication.
Trastuzumab + lapatinib
L’autre double blocage d’intérêt est l’association anticorps monoclonal + inhibiteur de tyrosine kinase anti-HER2.
• L’étude Néo-ALTTO (une partie de l’étude ALTTO présentée ci-dessus) avait évalué l’association trastuzumab + lapatinib par rapport au trastuzumab seul ou au lapatinib seul, en combinaison à la chimiothérapie par paclitaxel hebdomadaire. Si les résultats en termes de pCR, objectif principal de l’étude, sont statistiquement significatifs avec une augmentation du taux de pCR dans le bras expérimental (51 contre 29 % pour le trastuzumab + paclitaxel), la tolérance a été plus mauvaise dans les bras recevant le lapatinib (diarrhées, hépatotoxicités et éruptions cutanées) menant à des arrêts de traitement plus fréquents (28). En outre, avec moins de 460 patientes et un suivi médian d’environ 4 ans, la puissance statistique n’a pas permis d’objectiver un éventuel effet sur la survie.
Désescalade thérapeutique : quelles données ?
• L’étude KRISTINE a évalué la place du T-DM1 en situation néoadjuvante, avec notamment un schéma thérapeutique sans chimiothérapie standard, qui associait pertuzumab et T-DM1, en comparaison à une association carboplatine + docétaxel + double blocage trastuzumab et pertuzumab. L’objectif principal était la pCR. Les résultats sont négatifs avec une infériorité de l’association pertuzumab + T-DM1 (pCR de 44,4 contre 55,7 % avec le schéma “standard” ; p = 0,016). Il a notamment été noté une augmentation des progressions locorégionales sous T-DM1 + pertuzumab avant la chirurgie mammaire (29).
• Le programme ADAPT porté par le groupe allemand WSG a également évalué cette possibilité de désescalade avec une étude de phase II qui a randomisé les patientes entre paclitaxel-trastuzumab-pertuzumab et double blocage trastuzumab-pertuzumab sans chimiothérapie pendant 12 semaines ; il était possible de recourir à une chimiothérapie néoadjuvante complémentaire en cas de non pCR, et seules les patientes en pCR pouvaient surseoir à une chimiothérapie adjuvante. Le taux de pCR dans le bras sans chimiothérapie était de 34,4 contre 90,5 % dans le bras avec chimiothérapie ; aucune différence en termes de survie sans récidive invasive n’est observée entre les deux bras, mais les effectifs sont trop faibles pour conclure à une équivalence.
D’autres essais cliniques tels que l’étude DECRESCENDO ou l’essai COMPASS adressant la question de la désescalade sont en cours et explorent des schémas sans chimiothérapie, chez des patientes sélectionnées, et qu’il reste à définir précisément (30, 31).
À retenir
La chimiothérapie cytotoxique reste donc de mise en situation néoadjuvante dans l’attente de l’ensemble des essais où la question de la désescalade thérapeutique est étudiée. In fine, les indications de chimiothérapie néoadjuvante ont été modifiées ces dernières années, avec l’utilisation plus large de cette stratégie afin de sélectionner les tumeurs qui ne répondent pas au trastuzumab. Au-delà d’une taille de 2 cm, si la réponse histologique n’est pas complète, il est licite d’utiliser le T-DM1 en situation post-opératoire dans l’attente des résultats des essais cliniques en cours avec les anticorps conjugués de dernière génération. Néanmoins, en ce qui concerne le schéma de traitement néoadjuvant, malgré les nombreuses études publiées (Tab. 2), seule l’association chimiothérapie cytotoxique + trastuzumab reste recommandée jusque-là, également dans l’attente de l’ensemble des essais en cours évaluant la possibilité de désescalade. Les nouvelles molécules en cours de développement devraient certainement faire changer dans les années qui viennent ce standard de traitement.
Phase métastatique : quels nouveaux standards de traitement ?
En situation de première ligne : statu quo ?
Pertuzumab + trastuzumab + taxane
L’avènement du pertuzumab en combinaison au trastuzumab et au docétaxel, permettant un blocage de la voie HER2 avec un blocage de l’homo- et de l’hétéro-dimérisation d’HER2, a permis l’établissement d’un nouveau standard thérapeutique en première ligne métastatique.
• Ce sont les résultats de l’étude CLEOPATRA qui ont montré une amélioration de la survie sans progression et de la survie globale (8). L’actualisation de ces données fait état d’une différence de 16 mois en médiane de survie globale en faveur de l’association pertuzumab + trastuzumab (56,5 versus 40,8 ; HR = 0,68). Un tiers des patientes sous pertuzumab + trastuzumab sont vivantes à 8 ans et 25 % à 10 ans, sans surcroît de toxicité cardiaque à long terme (32).
Choix des taxanes
• Concernant le choix des taxanes, l’étude de phase IIIb PERUSE a exploré la tolérance et la pratique des investigateurs du docétaxel, du paclitaxel ou du nab-paclitaxel et a objectivé des données de survie sans progression comparables à 24 mois avec le paclitaxel hebdomadaire et une toxicité moindre, notamment hématologique, validant le paclitaxel hebdomadaire en première ligne à la place du docétaxel (33).
Durée optimale du double blocage
La question de la durée optimale du double blocage reste à l’heure actuelle encore en suspens pour les patientes qui présentent une réponse complète prolongée. À ce jour, il n’y a pas d’autre possibilité de traitement en première ligne, puisque l’étude MARIANNE a montré l’absence de bénéfice de l’adjonction du pertuzumab au T-DM1 (34), et que les résultats de l’essai DESTINY-Breast09, en cours d’inclusion, qui vise à évaluer le T-DXd en situation de première ligne en association au pertuzumab (35), sont en attente.
En situation de deuxième ligne et au-delà : quid novi ?
Le T-DM1
Avant l’avènement du T-DXd, le standard thérapeutique de deuxième ligne émanait des résultats de l’étude EMILIA qui avait randomisé plus de 1 000 patientes entre un bras T-DM1 seul et un bras contrôle associant la capécitabine et le lapatinib. Un gain en survie globale avait été démontré en faveur du bras T-DM1 (29,9 versus 25,9 mois ; HR = 0,75 ; p = 0,0003). Les patientes traitées par T-DM1 avaient présenté moins d’effets indésirables de grade ≥ 3 par rapport à celles traitées par capécitabine + lapatinib (47,6 contre 59,6 %), ainsi que moins d’effets indésirables ayant entraîné l’arrêt du traitement (18,6 % pour le T-DM1 contre 42,0 % pour la capécitabine et 20,1% pour le lapatinib) (9).
Jusque-là, au-delà de la deuxième ligne de traitement, les possibilités de traitement étaient multiples : la poursuite du trastuzumab associé à une chimiothérapie, l’association lapatinib plus capécitabine, et, pour certains, un double blocage sans chimiothérapie ou au contraire un agent cytotoxique seul.
En cas de métastases cérébrales
Concernant la présence de métastases cérébrales, l’association de la capécitabine et du lapatinib, via l’étude LANDSCAPE, permettait d’obtenir une réponse volumétrique chez deux tiers des patientes et s’affirmait comme traitement préférentiel jusque-là du traitement systémique des métastases cérébrales HER2+ (36).
Les modalités d’action de l’anticorps conjugué T-DM1 ont ouvert la voie au développement d’autres molécules du même type permettant d’ouvrir une fenêtre thérapeutique plus large en délivrant de manière plus efficiente la chimiothérapie aux cellules exprimant fortement HER2, à l’instar du T-DXd.
Le T-DXd
Le trastuzumab déruxtécan (DS-8201 ou T-DXd) est un anticorps qui combine le trastuzumab à un dérivé de l’exatécan, un inhibiteur de topoisomérase I.
• L’étude de phase II monobras DESTINY-Breast01 a inclus 253 patientes qui avaient été traitées par T-DM1 et qui pouvaient présenter des métastases cérébrales stabilisées. Les patientes avaient reçu en moyenne six lignes de traitement, dont le trastuzumab, le pertuzumab ou d’autres thérapies anti-HER2. Elles présentaient dans plus de 90 % des cas des métastases viscérales. Le taux de réponse objective était de 60,9 %, dont 6 % de réponses complètes. La durée médiane de réponse était de 14,8 mois et la médiane de survie sans progression était de 16,4 mois. À noter, dans cet essai princeps, la mise en évidence du risque de toxicité pulmonaire, avec la survenue de pneumopathies interstitielles dans 13,6 % des cas, dont quatre ayant entraîné le décès (12).
Ces données prometteuses ont permis de lancer les essais de phase III (DESTINY-Breast02 et DESTINY-Breast03) (37, 38).
• Les résultats de l’essai DESTINY- Breast03, présentés à l’ESMO en 2021, qui évaluait le T-DXd en deuxième ligne versus T-DM1, ont permis incontestablement d’établir un nouveau standard de deuxième ligne au regard des gains en survie, avec une survie sans progression médiane non atteinte versus 6,8 mois (HR = 0,28) en faveur du bras de traitement par T-DXd. Il existe une réduction du risque de progression de plus de 70 %. Les données ne sont pas encore matures en termes de survie globale, mais il a été objectivé une différence en survie globale à 1 an en faveur du bras T-DXd (94,1 versus 85,9 % ; HR = 0,56 ; IC 95 % = 0,36-0,86) (39).
La molécule est désormais accessible via l’accès précoce en France en situation de deuxième ligne. Il faut noter dans cet essai le risque de développer une pneumopathie interstitielle diffuse accru dans le groupe T-DXd (10,5 %) versus 1,9 % dans le groupe T-DM1, amenant à des recommandations de surveillance par scanner thoracique non injecté faible dose toutes les 8 semaines, sous T-DXd.
• Les résultats de l’essai DESTINY- Breast02 viennent d’être publiés, en avril 2023, et confortent les résultats de l’essai DESTINY-Breast01, démontrant un niveau élevé d’efficacité du T-DXd chez les patientes préalablement traitées par T-DM1, avec une médiane de survie sans progression à 17,8 mois pour les patientes dans le bras de traitement avec T-DXd contre 6,9 mois (HR = 0,36 ; IC 95 % = 0,28-0,45 ; p < 0,0001) (40).
De manière intéressante, il s’agit du premier essai randomisé à démontrer qu’un anticorps conjugué peut contrecarrer la résistance à un précédent anticorps drogue-conjugué, en l’occurrence, le TDM-1.
Le trastuzumab duocarmazine
• Un autre nouvel anticorps conjugué, le trastuzumab duocarmazine, a été évalué dans l’essai randomisé TULIP chez 437 patientes à partir de la troisième ligne en comparaison à un traitement au choix de l’investigateur. S’il existait un bénéfice en termes de survie sans progression avec une médiane à 7 versus 4,9 mois, il n’a pas été retrouvé de bénéfice en survie globale et le profil de tolérance était moins favorable que celui du T-DXd avec notamment des kérato-conjonctivites dans 38 % des cas et 7,6 % de pneumopathies interstitielles (41).
Le margétuximab
Enfin, d’autres anticorps anti-HER2 ont été développés, comme le margétuximab. Cet anticorps doté d’un fragment Fc modifié permettrait d’augmenter la réponse immune, via une affinité plus forte pour les récepteurs CD16A et CD32B, en comparaison au trastuzumab.
• L’essai randomisé de phase III SOPHIA a comparé chez plus de 500 patientes prétraitées par au moins deux lignes de traitement anti-HER2 (pertuzumab inclus), l’association chimiothérapie + trastuzumab à l’association chimiothérapie + margétuximab. Les résultats ont montré une médiane de survie sans progression de 5,8 mois dans le bras expérimental contre 4,9 mois dans le bras contrôle. S’il semblait, lors de l’analyse initiale, que les résultats étaient meilleurs lorsque l’analyse était restreinte aux patientes porteuses du génotype CD16A-158F, avec une survie médiane de 23,7 contre 19,4 mois (HR = 0,79 ; p = 0,087) (42), il n’a pas été démontré de bénéfice en survie globale lors des résultats finaux d’analyse (44).
Atteinte du système nerveux central et inhibiteurs de tyrosine kinase
Les inhibiteurs de tyrosine kinase sont des molécules lipophiles qui traversent la membrane cytoplasmique pour inhiber la phosphorylation des kinases membranaires ou cytoplasmiques, permettant ainsi une inactivation des voies de signalisation d’aval (PI3K-AKT notamment). Étant donné leur poids moléculaire inférieur à celui des anticorps monoclonaux, le franchissement de la barrière hémato-encéphalique pourrait être, au moins en théorie, plus efficient en cas de métastases cérébrales. Depuis le développement du lapatinib, plusieurs inhibiteurs de tyrosine kinase ont été développés afin d’optimiser leur efficacité, soit par un ciblage plus large des récepteurs de la famille HER, soit par une plus grande spécificité sur le récepteur HER2.
Le nératinib
• Le nératinib a ainsi été évalué dans l’étude de phase III NALA qui a comparé le nératinib au lapatinib, tous deux associés à la capécitabine chez des patientes ayant déjà reçu deux lignes ou plus d’anti-HER2 en situation métastatique. Les patientes qui présentaient des métastases cérébrales stables ou asymptomatiques pouvaient être incluses. Si les courbes de survie sans progression sont superposables pendant les 6 premiers mois du traitement, la médiane de survie sans progression est de 8,8 mois dans le bras nératinib et de 6,6 mois avec le lapatinib avec un HR statistiquement significatif en faveur du nératinib (0,76 (IC 95 % = 0,63-0,93 ; p = 0,0059). Le bénéfice est donc modeste en termes de survie sans progression, et l’étude est négative en termes de survie globale. Concernant les métastases cérébrales, leur incidence a été notée comme étant inférieure avec le nératinib : 22,8 contre 29,2 % (p = 0,043). En termes de tolérance, la diarrhée restait l’événement indésirable le plus fréquent, et ce, avec les deux molécules. Le taux d’interruption du traitement était sensiblement le même dans les deux bras (2,6 et 2,3 % pour le nératinib et le lapatinib respectivement). Cependant, le nératinib était associé à une survenue plus importante de diarrhées de grade 3/4 (44).
Le tucatinib
A contrario, le tucatinib, inhibiteur très sélectif pour HER2 et moindre pour HER1, a été autorisé par l’agence du médicament américaine (FDA) grâce aux résultats de l’étude de phase III HER2CLIMB et a bénéficié en France d’une autorisation temporaire d’utilisation dès 2020.
• Cette étude a évalué chez 612 patientes préalablement traitées par trastuzumab, pertuzumab et T-DM1, l’apport du tucatinib à l’association capécitabine + trastuzumab (en comparaison au placebo). Les patientes avec métastases cérébrales en progression et/ou non prétraitées pouvaient être incluses (48,3 % dans le bras tucatinib et 46 % dans le bras contrôle). L’adjonction du tucatinib à l’association capécitabine + trastuzumab est associée à une augmentation significative de la survie sans progression (7,8 contre 5,6 mois ; HR = 0,54 ; IC 95 % = 0,42-0,71 ; p < 0,001), mais également de la survie globale (21,9 contre 17,4 mois ; HR = 0,66 ; IC 95 % = 0,5-0,88 ; p < 0,005). Ces bénéfices ont également été objectivés dans le groupe des patientes porteuses de métastases cérébrales, que celles-ci soient jugées actives ou qu’elles aient été antérieurement prétraitées. Dans la population des patientes avec des métastases cérébrales actives, le taux de réponse objective est de 47 % (IC 95 % = 33,7-61,2 ; p = 0,03), avec une survie sans progression à 12 mois de 35 % (contre 0 % dans le groupe des patientes sous placebo, HR = 0,36). Chez les 30 patientes qui présentaient une progression cérébrale isolée et qui ont poursuivi, après un traitement local, le tucatinib dans le cadre de l’essai, le risque de seconde progression ou de décès a été réduit de 67 % (HR = 0,29 ; IC 95 % = 0,11-0,77) (45). Sur le plan de la tolérance, il faut noter essentiellement des effets secondaires de grade 1 à 2 incluant l’asthénie, des troubles digestifs, des syndromes palmo-plantaires et une élévation des transaminases.
Ainsi, le tucatinib vient compléter l’arsenal thérapeutique anti-HER2 et est devenu un nouveau standard en troisième ligne, que les patientes présentent ou non des métastases cérébrales.
À noter qu’il est possible d’inclure les patientes dans l’essai HER2CLIMB-05 permettant un accès éventuel au tucatinib en situation de première ligne, en combinaison au pertuzumab et au trastuzumab, lorsque les patientes ne progressent pas à l’issue des 6 mois de chimiothérapie (46).
D’autres inhibiteurs de tyrosine kinase tels que le pyrotinib ou le poziotinib sont en cours de développement (47, 48).
À retenir
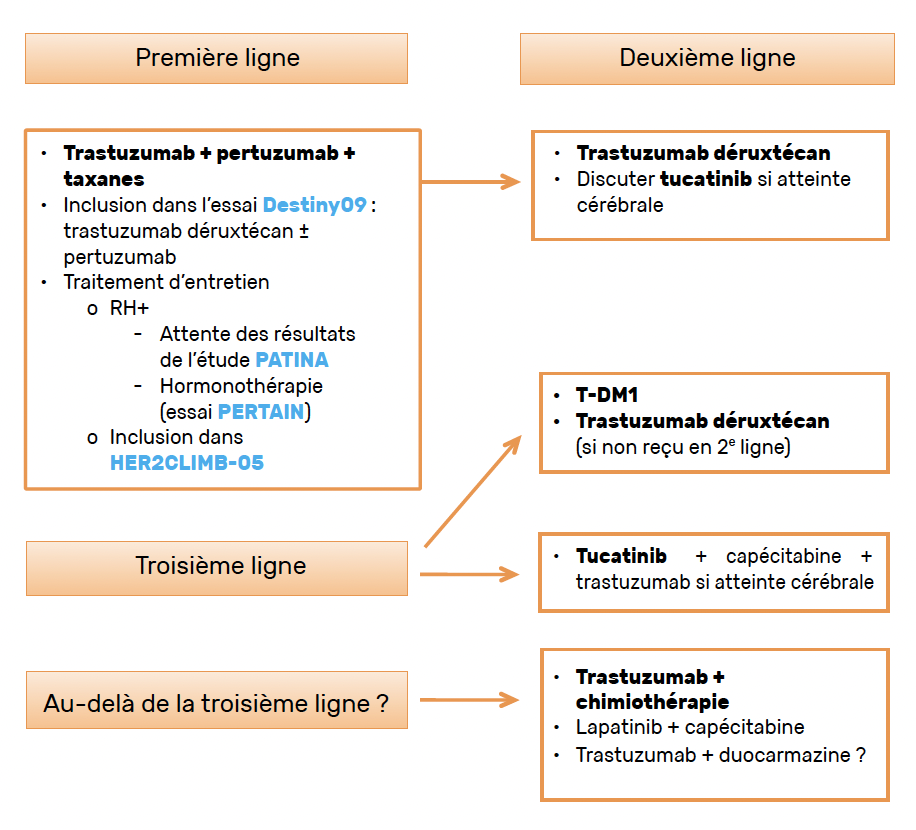
Une stratégie de prise en charge est proposée dans la figure 1 et va être largement discutée dans les mois et les années à venir à la lumière des études en attente. La question du traitement des métastases cérébrales demeure un enjeu important, et jusque-là, les recommandations internationales plaident pour ne pas changer le traitement systémique en cas d’évolution cérébrale isolée sans progression systémique concomitante, et contrôlable par traitement localisé.
Figure 1 – Cancer du sein HER2+ et stratégies thérapeutiques.
Stratégies thérapeutiques combinatoires : quel avenir ?
Il existe une hétérogénéité au sein des cancers HER2+, expliquant des différences en termes de pronostic et de sensibilité aux thérapeutiques (11).
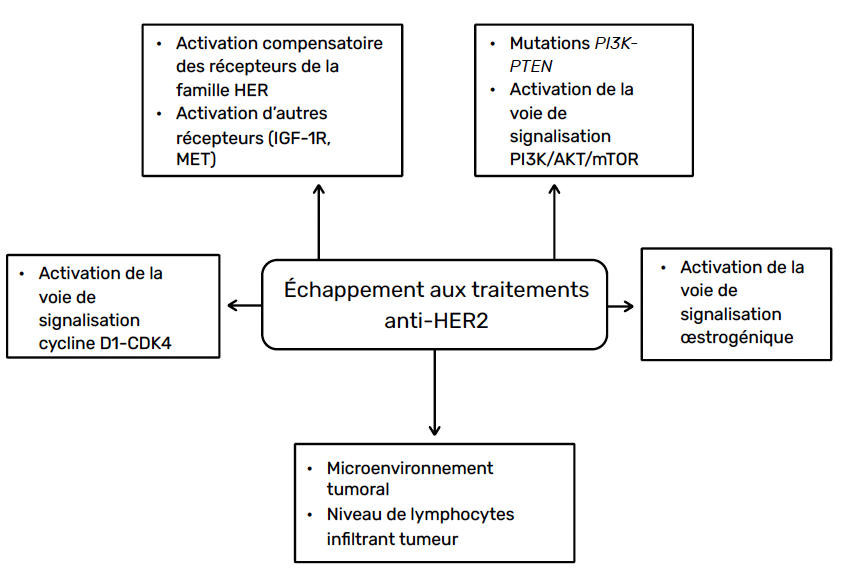
Les mécanismes d’échappement aux traitements anti-HER2
Plusieurs mécanismes potentiels de résistance aux traitements anti-HER2 ont été décrits, notamment en ce qui concerne la réactivation de la signalisation HER2. Les principaux mécanismes d’échappement aux traitements anti-HER2 sont présentés dans la figure 2. Au-delà des mécanismes qui impliquent des déficits de la réaction immunitaire (ADCC), les voies de signalisation intracellulaire peuvent également être impliquées. Un blocage incomplet du récepteur HER2 par l’activation compensatoire des autres récepteurs de la famille HER, une activation d’autres récepteurs (IGF-1R ou MET), une activation oncogénique de la voie de signalisation PI3K/AKT/mTOR (par la présence d’altération activatrice de PI3K ou la perte d’expression de PTEN) sont des exemples de mécanismes de résistance aux anti-HER2. Ainsi, les mutations activatrices du gène PI3KCA sont significativement associées à une majoration du risque de rechute invasive. Il a également été montré, in vivo et in vitro, l’implication de la voie cycline D1-CDK4 dans la médiation d’une résistance aux traitements anti-HER2.
Figure 2 – Principaux mécanismes de résistance dans le cancer du sein HER2+.
Un ciblage des cellules HER2 résistantes par des inhibiteurs de CDK4-6 les sensibilise à nouveau à un traitement anti-HER2. La synergie traitement anti-HER2 + inhibiteurs de CDK4/6 été démontrée dans des études précliniques (49). Par ailleurs, dans les tumeurs RH+, un dialogue bidirectionnel existe entre les récepteurs œstrogéniques et HER2. Ces tumeurs présentent une moindre réceptivité à l’hormonothérapie (en comparaison aux tumeurs RE+ sans surexpression de HER2) (50).
Les stratégies thérapeutiques en cours d’évaluation
Subséquemment, plusieurs études cliniques ont émergé afin de potentialiser l’efficacité des traitements anti-HER2 et/ou de limiter l’apparition des mécanismes de résistance.
Association à une hormonothérapie
• L’essai de phase II randomisé PERTAIN a notamment montré qu’un double blocage de HER2 associé à une hormonothérapie par inhibiteur de l’aromatase permet d’obtenir un bénéfice en survie sans progression chez des patientes porteuses d’un cancer du sein RH+ et HER2 surexprimé (51).
De nombreux essais évaluent le rôle des inhibiteurs de CDK4/6 dans les cancers du sein avancés HER2+. Deux essais randomisés sont à noter :
• l’étude MonarcHER qui a démontré un bénéfice en survie sans progression de l’abémaciclib associé à l’hormonothérapie et au trastuzumab (52), mais les résultats ne sont pas significatifs en termes de survie globale,
• et l’étude PATINA qui évalue l’adjonction du palbociclib à un double blocage et en association à une hormonothérapie par anti-aromatase dont les résultats sont en attente (53).
Inhibition de la voie PI3K/AKT/mTOR
Concernant la dérégulation de la voie PI3K/AKT/mTOR, qui joue un rôle clé dans la résistance au trastuzumab, les essais cliniques BOLERO-1 et BOLERO-3, qui ont testé l’inhibition spécifique de cette voie de signalisation, concomitamment avec le trastuzumab, n’ont pas été concluants, avec notamment une augmentation significative de la toxicité (54, 55).
Association à un inhibiteur des points de contrôle immunitaires
Concernant le caractère immunogène des tumeurs surexprimant HER2, une charge mutationnelle élevée, une infiltration lymphocytaire importante et un haut niveau d’expression de PD-L1 ont été observés. Plusieurs essais ont donc exploré l’association traitement anti-HER2 et inhibiteur des points de contrôle immunitaires.
• L’essai de phase I JAVELIN a testé l’avélumab, mais n’a pas objectivé de réponse significative (56).
• L’étude de phase Ib/II PANACEA a évalué l’association pembrolizumab + trastuzumab, chez des patientes résistantes au trastuzumab. Dans la cohorte de patientes avec tumeur PD-L1-positive, le taux de réponse objective était de 15 %, avec 24 % des patientes bénéficiant d’un contrôle de la maladie. Chez les patientes répondeuses, la durée médiane de réponse était de 11 mois (longues répondeuses) (57).
• L’essai de phase II KATE2 qui combinait T-DM1 et atézolizumab n’a, pour sa part, pas montré de résultat significatif (58).
D’autres essais sont en cours, par exemple l’étude de phase III NRG-BR004 qui évalue en première ligne thérapeutique l’adjonction de l’atézolizumab à l’association trastuzumab + pertuzumab + paclitaxel (59).
Les nouvelles molécules anti-HER2 décrites ci-dessus sont également évaluées en association avec l’immunothérapie (par exemple l’association du trastuzumab déruxtécan et nivolumab) (60).
Les approches vaccinales
Enfin, les approches vaccinales sont également à l’étude dans cette pathologie ; un vaccin anti-HER2 (NeuVax™) est actuellement testé dans deux essais de phase II, en association avec le trastuzumab (61, 62).
Les approches combinatoires avec des traitements anti-HER2 associés à des thérapies ciblées et/ou à de l’immunothérapie n’ont pas encore fait la preuve de leur efficacité clinique à large échelle. Néanmoins, il est probable qu’une meilleure compréhension de la biologie tumorale de ces tumeurs hétérogènes, ainsi que de l’environnement immun, permettra de mieux adapter les futures combinaisons de traitement.
À retenir
L’arsenal thérapeutique s’est considérablement enrichi ces 20 dernières années pour les cancers du sein HER2+, conduisant à une amélioration de la survie globale des patientes. Une meilleure compréhension des phénomènes de résistance a permis l’élaboration de nouvelles molécules et de nouvelles stratégies de traitement, ce qui va permettre la poursuite de l’amélioration pronostique de ces tumeurs, aussi bien en situation (néo)adjuvante qu’en situation métastatique. Malgré ces progrès considérables, il existe encore de nombreux cas d’échappement aux traitements anti-HER2, avec en particulier l’apparition de métastases du système nerveux central. Les perspectives thérapeutiques futures sont nombreuses, couvrant plusieurs champs de la cancérologie actuelle, avec des anticorps conjugués, des thérapies ciblées sur des altérations moléculaires spécifiques et de l’immunothérapie. Les séquences thérapeutiques possibles dans le futur sont innombrables.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Slamon DJ, Clark GM, Wong SG et al. Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987 ; 235 : 182-91.
2. Ahn S, Woo JW, Lee K, Park SY. HER2 status in breast cancer: changes in guidelines and complicating factors for interpretation. J Pathol Transl Med 2020 ; 54 : 34-44.
3. De Laurentiis M, Arpino G, Massarelli E et al. A meta-analysis on the interaction between HER-2 expression and response to endocrine treatment in advanced breast cancer. Clin Cancer Res 2005 ; 11 : 4741-8.
4. Ring A, Dowsett M. Human epidermal growth factor receptor-2 and hormonal therapies: Clinical implications. Clin Breast Cancer 2003 ; 4 : S34-41.
5. Buzdar AU, Ibrahim NK, Francis D et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: Results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol 2005 ; 23 : 3676-85.
6. Piccart-Gebhart MJ, Procter M, Leyland-Jones B et al. Trastuzumab after adjuvant chemotherapy in HER2-Positive breast cancer. N Eng J Med 2005 ; 353 : 1659-72.
7. Slamon DJ, Leyland-Jones B, Shak S et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Eng J Med 2001 ; 344, 783-92.
8. Baselga J, Cortés J, Kim SB et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer. N Eng J Med 2012 ; 366 : 109-19.
9. Verma S, Miles D, Gianni L et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Eng J Med 2012 ; 367 : 1783-91.
10. Geyer CE, Forster J, Lindquist D et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Eng J Med 2006 ; 355 : 2733-43.
11. Pernas S, Tolaney SM. HER2-positive breast cancer: new therapeutic frontiers and overcoming resistance. Ther Adv Med Oncol 2019 ; 11 : 1758835919833519.
12. Modi S, Saura C, Yamashita T et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020 ; 382 : 610-21.
13. Romond EH, Perez EA, Bryant J et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005 ; 353 : 1673-84.
14. Goldhirsch A, Gelber RD, Piccart-Gebhart MJ et al. 2 years versus 1 year of adjuvant trastuzumab for HER2-positive breast cancer (HERA): An open-label, randomised controlled trial. Lancet 2013 ; 382 : 1021-8.
15. Cameron D, Piccart-Gebhart MJ et al. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet 2017 ; 389 : 1195-205.
16. Pivot X, Romieu G, Debled M et al. 6 months versus 12 months of adjuvant trastuzumab for patients with HER2-positive early breast cancer (PHARE): A randomised phase 3 trial. Lancet Oncol 2013 ; 14 : 741-8.
17. Joensuu H, Fraser J, Wildies H et al. Effect of adjuvant trastuzumab for a duration of 9 weeks vs 1 year with concomitant chemotherapy for early human epidermal growth factor receptor 2-positive breast cancer: The SOLD randomized clinical trial. JAMA Oncol 2018 ; 4 1199-206.
18. Conte P, Frassoldati A, Bisagni G et al. Nine weeks versus 1 year adjuvant trastuzumab in combination with chemotherapy: Final results of the phase III randomized Short-HER study. Ann Oncol 2018 ; 29 : 2328-33.
19. Earl HM, Hiller L, Vallier AL et al. 6 versus 12 months of adjuvant trastuzumab for HER2-positive early breast cancer (PERSEPHONE): 4-year disease-free survival results of a randomised phase 3 non-inferiority trial. Lancet 2019 ; 393 : 2599-612.
20. Tolaney SM, Guo H, Pernas S et al. Seven-year follow-up analysis of adjuvant paclitaxel and trastuzumab trial for node-negative, human epidermal growth factor receptor 2–positive breast cancer. J Clin Oncol 2019 ; 37 : 1868-75.
21. Tolaney SM, Tarantino P, Graham N et al. Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer: final 10-year analysis of the open-label, single-arm, phase 2 APT trial. Lancet Oncol 2023 ; 24 : 273-85.
22. Piccart-Gebhart M, Holmes E, Baselga J et al. Adjuvant lapatinib and trastuzumab for early human epidermal growth factor receptor 2-positive breast cancer: Results From the randomized phase III adjuvant lapatinib and/or trastuzumab treatment optimization trial. J Clin Oncol 2016 ; 34 : 1034-42.
23. von Minckwitz G, Procter M, de Azambuja E et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med 2017 ; 377 : 122-31.
24. Martin M, Holmes FA, Ejlertsen B et al. Neratinib after trastuzumab-based adjuvant therapy in HER2-positive breast cancer (ExteNET): 5-year analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2017 ; 18 : 1688-700.
25. Cortazar P, Zhang L, Untch M et al. Pathological complete response and long-term clinical benefit in breast cancer: The CTNeoBC pooled analysis. Lancet 2014 ; 384 : 164-72.
26. ClinicalTrials.gov. A study of trastuzumab deruxtecan (T-DXd) versus trastuzumab emtansine (T-DM1) in high-risk HER2-positive participants with residual invasive breast cancer following neoadjuvant therapy (DESTINY-Breast05). Plus de détails sur : clinicaltrials.gov/ct2/show/NCT04622319.
27. Gianni L, Pienkowski T, Im YH et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): A randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012 ; 13 : 25-32.
28. Gianni L, Pienkowski T, Im YH et al. 5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial. Lancet Oncol 2016 ; 17 : 791-800.
29. Hurvitz SA, Martin M, Jung KH et al. Neoadjuvant trastuzumab emtansine and pertuzumab in human epidermal growth factor receptor 2–positive breast cancer: Three-year outcomes from the phase III KristinE study. J Clin Oncol 2019 ; 37 : 2206-16.
30. ClinicalTrials.gov. CompassHER2-pCR: decreasing chemotherapy for breast cancer patients after pre-surgery chemo and targeted therapy. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT04266249.
31. ClinicalTrials.gov. De-escalation adjuvant chemo in HER2+/ER-/node-neg early BC patients who achieved pCR after neoadjuvant chemo & dual HER2 blockade. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT04675827.
32. Swain SM, Baselga J D, Kim SB et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015 ; 372 : 724-34.
33. Bachelot T, Ciruelos E, Schneeweiss A et al. Preliminary safety and efficacy of first-line pertuzumab combined with trastuzumab and taxane therapy for HER2-positive locally recurrent or metastatic breast cancer (PERUSE). Ann Oncol 2019 ; 30 : 766-73.
34. Perez EA, Barrios C, Eiermann W et al. Trastuzumab emtansine with or without pertuzumab versus trastuzumab plus taxane for human epidermal growth factor receptor 2-positive, advanced breast cancer: Primary results from the phase III MARIANNE study. J Clin Oncol 2017 ; 35 : 141-8.
35. ClinicalTrials.gov. Trastuzumab deruxtecan (T-DXd) with or without pertuzumab versus taxane, trastuzumab and pertuzumab in HER2-positive metastatic breast cancer (DESTINY-Breast09). Plus de détails sur : clinicaltrials.gov/ct2/show/NCT04784715.
36. Bachelot T, Romieu G, Campone M et al. Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer (LANDSCAPE): A single-group phase 2 study. Lancet Oncol 2013 ; 14 : 64-71.
37. ClinicalTrials.gov. DS-8201a versus T-DM1 for human epidermal growth factor receptor 2 (HER2)-positive, unresectable and/or metastatic breast cancer previously treated with trastuzumab and taxane [DESTINY-Breast03]. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT03529110.
38. ClinicalTrials.gov. DS-8201a in Pre-treated HER2 Breast Cancer That Cannot be Surgically Removed or Has Spread [DESTINY-Breast02]. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT03523585.
39. Cortés J, Kim SB, Chung WP et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Eng J Med 2022 ; 386 : 1143-54.
40. André F, Park YH, Kim SB et al. Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-positive metastatic breast cancer (DESTINY-Breast02): a randomised, open-label, multicentre, phase 3 trial. Lancet 2023 ; [Epud ahead of print].
41. Manich CS, O’Shaughnessy J, Aftimos PG et al. Primary outcome of the phase III SYD985.002/TULIP trial comparing vic-trastuzumab duocarmazine to physician’s choice treatment in patients with pre-treated HER2-positive locally advanced or metastatic breast cancer. Ann Oncol 2021 ; 32 : S1288-346.
42. Rugo HS, Im SA, Wright GLS et al. SOPHIA primary analysis: A phase 3 (P3) study of margetuximab (M) + chemotherapy (C) versus trastuzumab (T) + C in patients (pts) with HER2+ metastatic (met) breast cancer (MBC) after prior anti-HER2 therapies (Tx). J Clin Oncol 2019 ; 37 : 1000.
43. Rugo HS, Im SA, Cardoso F et al. Margetuximab versus trastuzumab in patients with previously treated HER2-positive advanced breast cancer (SOPHIA): final overall survival results from a randomized phase 3 trial. J Clin Oncol 2023 ; 41 : 198-205.
44. Saura C, Oliveira M, Feng YH et al. Neratinib plus capecitabine versus lapatinib plus capecitabine in HER2-positive metastatic breast cancer previously treated with ≥ 2 HER2-directed regimens: phase III NALA trial. J Clin Oncol 2020 ; 38 : 3138-49.
45. Murthy RK, Loi S, Okines A et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N Eng J Med 2020 ; 382 : 597-609.
46. ClinicalTrials.gov. A study of tucatinib or placebo with trastuzumab and pertuzumab for metastatic HER2+ breast cancer. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT05132582.
47. Park YH, Lee KH, Sohn JH et al. A phase II trial of the pan-HER inhibitor poziotinib, in patients with HER2-positive metastatic breast cancer who had received at least two prior HER2-directed regimens: results of the NOV120101-203 trial. Int J Cancer 2018 ; 143 : 3240-7.
48. ClinicalTrials.gov. A study of pyrotinib in combination with trastuzumab and docetaxel in patients with HER2 metastatic breast cancer. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT03863223.
49. Witkiewicz AK, Cox D, Knudsen ES. CDK4/6 inhibition provides a potent adjunct to Her2-targeted therapies in preclinical breast cancer models. Genes Cancer 2014 ; 5 : 261-72.
50. Kaufman B, Mackey JR, Clemens MR et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2-positive, hormone receptor-positive metastatic breast cancer: Results from the randomized phase III TAnDEM study. J Clin Oncol 2009 ; 27 : 5529-37.
51. Rimawi M, Ferrero JM, de la Haba-Rodriguez J et al. First-line trastuzumab plus an aromatase inhibitor, with or without pertuzumab, in human epidermal growth factor receptor 2-positive and hormone receptor-positive metastatic or locally advanced breast cancer (PERTAIN): A randomized, open-label phase II trial. J Clin Oncol 2018 ; 36 : 2826-35.
52. Tolaney SM, Wardley AM, Zambelli S et al. Abemaciclib plus trastuzumab with or without fulvestrant versus trastuzumab plus standard-of-care chemotherapy in women with hormone receptor-positive, HER2-positive advanced breast cancer (monarcHER): a randomised, open-label, phase 2 trial. Lancet Oncol 2020 ; 21 : 763-75.
53. Loibl S, Metzger O, Mandrekar SJ et al. PATINA: A randomized, open label, phase III trial to evaluate the efficacy and safety of palbociclib + Anti-HER2 therapy + endocrine therapy (ET) vs. anti-HER2 therapy + ET after induction treatment for hormone receptor positive (HR+)/HER2-positive metastatic breast cancer (MBC). Ann Oncol 2018 ; 29 : viii121.
54. Hurvitz SA, André F, Jiang Z et al. Combination of everolimus with trastuzumab plus paclitaxel as first-line treatment for patients with HER2-positive advanced breast cancer (BOLERO-1): A phase 3, randomised, double-blind, multicentre trial. Lancet Oncol 2015 ; 16 : 816-29.
55. André F, O’Regan R, Ozguroglu M et al. Everolimus for women with trastuzumab-resistant, HER2-positive, advanced breast cancer (BOLERO-3): A randomised, double-blind, placebo-controlled phase 3 trial. Lancet Oncol 2014 ; 15 : 580-91.
56. Dirix LY, Takacs I, Jerusalem G et al. Avelumab, an anti-PD-L1 antibody, in patients with locally advanced or metastatic breast cancer: A phase 1b JAVELIN solid tumor study. Breast Cancer Res Treat 2018 ; 167 : 671-86.
57. Loi S, Giobbie-Hurder A, Gombos A et al. Pembrolizumab plus trastuzumab in trastuzumab-resistant, advanced, HER2-positive breast cancer (PANACEA): a single-arm, multicentre, phase 1b-2 trial. Lancet Oncol 2019 ; 20 : 371-82.
58. Emens LA, Esteva FJ, Beresford M et al. Trastuzumab emtansine plus atezolizumab versus trastuzumab emtansine plus placebo in previously treated, HER2-positive advanced breast cancer (KATE2): a phase 2, multicentre, randomised, double-blind trial. Lancet Oncol 2020 ; 21 : 1283-95.
59. ClinicalTrials.gov. Testing the drug atezolizumab or placebo with usual therapy in first-line HER2-positive metastatic breast cancer. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT03199885.
60. ClinicalTrials.gov. Trastuzumab deruxtecan with nivolumab in advanced breast and urothelial cancer. Plus de détails sur clinicaltrials.gov/ct2/show/NCT03523572.
61. Mittendorf EA, Clifton GT, Holmes JP et al. Final report of the phase I/II clinical trial of the E75 (nelipepimut-S) vaccine with booster inoculations to prevent disease recurrence in high-risk breast cancer patients. Ann Oncol 2014 ; 25 : 1735-42.
62. ClinicalTrials.gov. Combination immunotherapy with herceptin and the HER2 vaccine NeuVax. Plus de détails sur : clinicaltrials.gov/ct2/show/NCT01570036.