Le cancer de prostate (CaP) reste le cancer masculin le plus fréquent en France. Il se situe au 2e rang des cancers incidents chez l’homme dans le monde après le cancer du poumon. L’âge médian au diagnostic est de 70 ans et 90 % des patients sont diagnostiqués au stade localisé.
Le traitement des patients a fortement évolué ces dernières années tant pour les maladies localisées que métastatiques. En situation localisée, la prise en charge repose toujours sur la classification de d’Amico, avec néanmoins des discussions autour de la place des imageries dites “de nouvelle génération” et également l’intensification du traitement des patients à très haut risque ou cN1M0. En situation métastatique hormonosensible, l’intensification est devenue le standard avec l’utilisation des hormonothérapies de deuxième génération (HT2G) : acétate d’abiratérone (AA) + prednisone, apalutamide, enzalutamide, mais également l’arrivée du triplet “docétaxel + HT2G (abiratérone, darolutamide) + suppression androgénique (SAd) par antagoniste ou agoniste de la GnRH”. De nouveaux agents, tels que le lutétium-PSMA et les inhibiteurs de PARP, font désormais partie de l’arsenal thérapeutique pour les patients avec un CaP résistant à la castration.
Cancer de la prostate localisé à haut risque
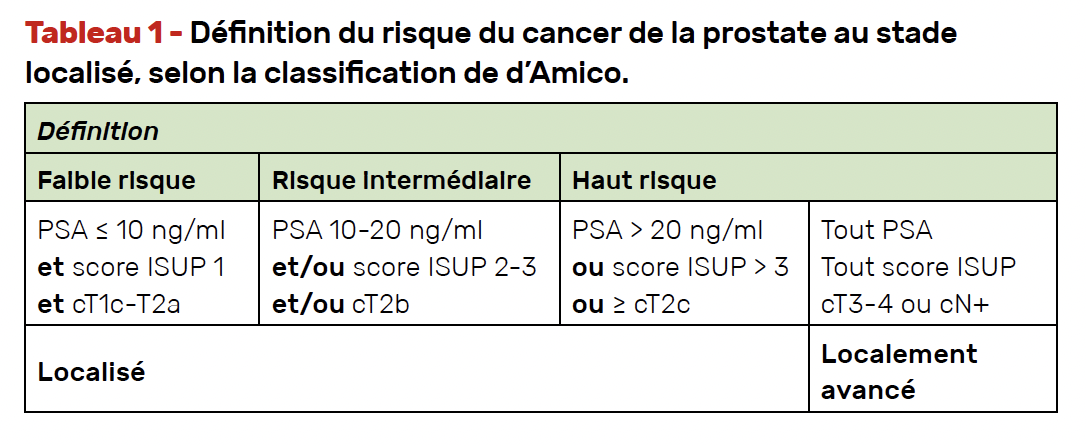
Au stade localisé, les stratégies thérapeutiques dépendent du stade de la maladie et du risque de récidive, sur la base de la classification de d’Amico (Tab. 1). Le groupe de tumeurs à haut risque est un groupe hétérogène, représentant 20 à 25 % des nouveaux diagnostics de CaP. Du fait d’une survie spécifique après traitement standard (chirurgie ou radiothérapie) moins bonne chez ces patients, et devant l’arrivée des hormonothérapies de 2e génération (HT2G) en situation métastatique, la question d’intensifier le traitement pour cette population s’est posée.
Nouvelle stratégie pour les patients à très haut risque ou N+
Récemment, la prise en charge thérapeutique des patients présentant un envahissement ganglionnaire pelvien (cN1M0) a été modifiée.
Intensification du traitement systémique
L’essai STAMPEDE a évalué l’intensification du traitement systémique pour ces patients “à très haut risque” définis par au moins deux critères de haut risque parmi :
• un stade cT3/T4,
• un ISUP ≥ 4,
• un taux de PSA > 40 ng/ml ;
et/ou les patients localement avancés avec une atteinte ganglionnaire cN1 sur l’imagerie conventionnelle.
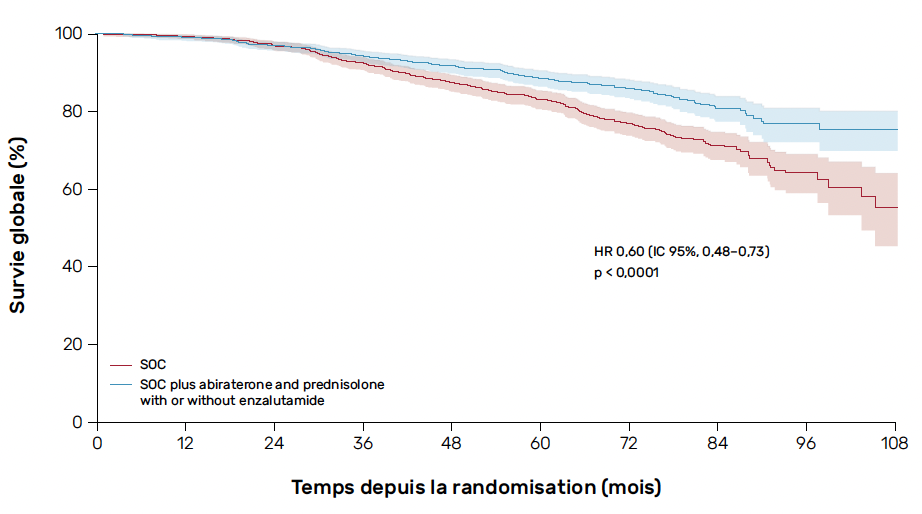
Avec 1 974 patients randomisés, dont 39 % de patients N1, les résultats sont en faveur d’un net bénéfice de l’addition de l’AA pendant 2 ans à la combinaison radiothérapie-hormonothérapie longue en termes de survie sans maladie à 5 ans (85 versus 75 % ; HR = 0,53 ; 0,44-0,64) avec également une amélioration significative de la survie globale (SG) (HR = 0,60 ; 0,48-0,73) (Fig. 1) (1).
Figure 1 – Données de survie globale avec et sans abiratérone (plus ou moins enzalutamide) dans l’étude STAMPEDE.
Bien que n’ayant pas d’AMM dans cette indication, les résultats de cet essai font de l’abiratérone un nouveau standard en association à la radio-hormonothérapie longue pour cette population. Les résultats des deux essais de phase III, ATLAS (NCT02531516), évaluant l’apalutamide, et ENZARAD (NCT02446444), évaluant l’enzalutamide, sont attendus pour confirmer la place d’une HT2G en combinaison à une radio-hormonothérapie chez des patients à haut risque.
Quelle place pour l’imagerie métabolique ?
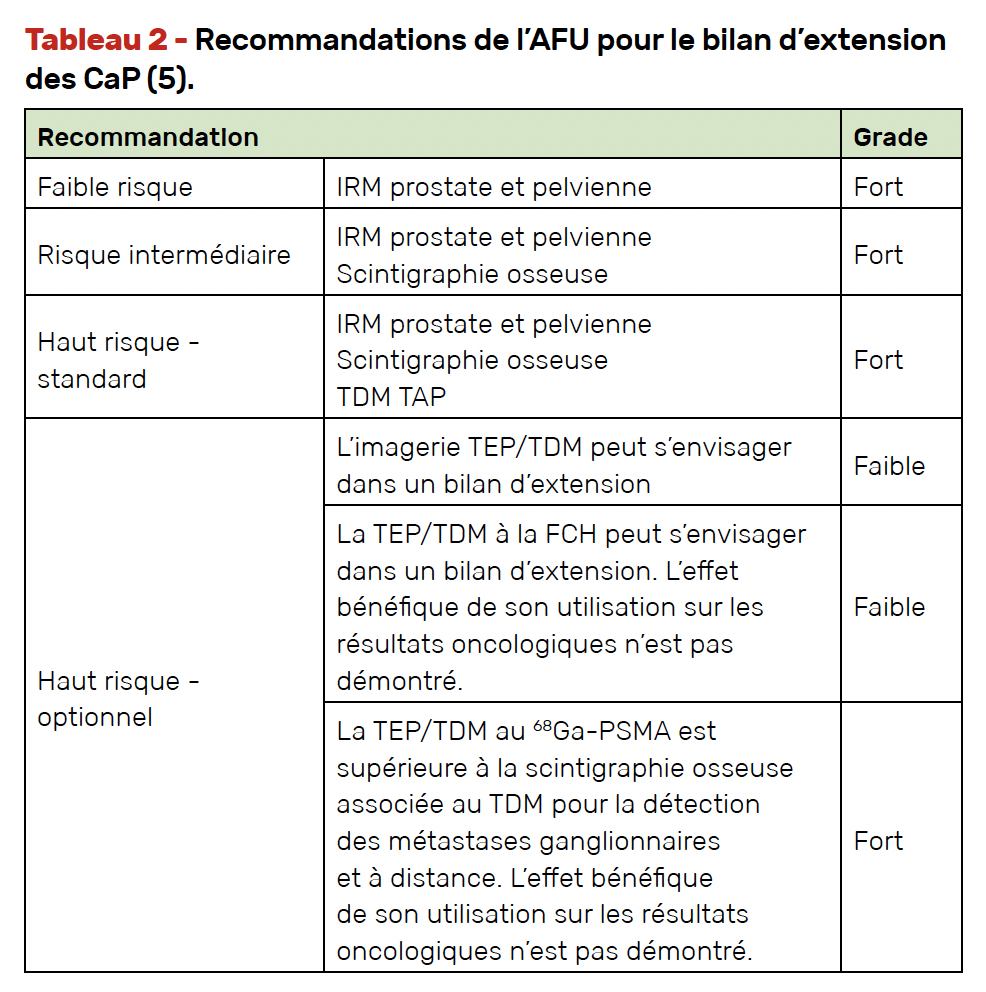
L’un des défis de la prise en charge du CaP de haut risque est d’obtenir une stadification initiale fiable. Le bilan d’extension standard repose sur la réalisation d’une scintigraphie osseuse et d’un scanner TAP avec toutefois certaines limites de performance diagnostique (2). L’arrivée des imageries métaboliques dites non conventionnelles avec les imageries TEP est au cœur de toutes nos discussions de RCP.
La TEP/TDM au 68Ga-PSMA
L’étude prospective multicentrique randomisée proPSMA portant sur 302 patients présentant un CaP à haut risque a montré sans ambiguïté la supériorité des performances de la TEP/TDM au 68Ga-PSMA comparées à celles du couple scanner TAP et scintigraphie osseuse (3). Les résultats se sont concentrés sur la précision de l’imagerie de première intention pour l’identification des adénopathies pelviennes ou des métastases à distance. La précision de la TEP/TDM au 68Ga-PSMA était 27 % supérieure à celle de l’imagerie conventionnelle (92 % ; IC 95 % = 88-95 contre 65 % ; IC 95 % = 60-69 ; p < 0,0001). L’imagerie conventionnelle avait une sensibilité et une spécificité plus faibles que la TEP/TDM au 68Ga-PSMA (respectivement, 38 versus 85 % et 91 versus 98 %).
La TEP/TDM à la 18F-flurorocholine (FCH)
Aucune donnée comparative évaluant la TEP/TDM à la 18F-flurorocholine (FCH) et la TEP/TDM aux ligands du PSMA n’est disponible. Aujourd’hui, la place de la TEP/TDM à la FCH reste limitée, ce d’autant qu’il y a un risque de faux négatif, avec également des performances moins bonnes en cas d’ISUP faible.
Au vu des preuves présentées par l’essai randomisé et multicentrique proPSMA, la TEP/TDM au 68Ga-PSMA peut s’envisager chez les patients atteints d’un CaP à haut risque. Cependant, en l’absence d’études prospectives démontrant un bénéfice en termes de survie, il convient de faire preuve de prudence lors de la prise de décisions thérapeutiques. Faut-il tenir compte ou non des résultats de cette TEP pour adapter la prise en charge des patients ? À ce jour, le pronostic et la prise en charge des patients “re-stadifiés” comme métastatiques par la TEP/TDM au 68Ga-PSMA sont inconnus. En particulier, il n’est pas clair si les patients présentant des métastases détectables uniquement avec la TEP/TDM doivent être gérés uniquement par des traitements systémiques, ou bien par des traitements focalisés plus agressifs et ciblés sur les métastases (4).
Le tableau 2 synthétise les recommandations de l’AFU (Association française d’urologie) concernant le bilan d’extension du CaP.
Cancer de la prostate résistant à la castration non métastatique (M0CRPC)
Il s’agit de patients traités par SAd pour une rechute biologique après traitement local ou à l’évolution des patients à haut risque traités par radio-hormonothérapie, non métastatique. L’évolution se fait vers une résistance à la castration, avec élévation du PSA, sans que des métastases ne soient identifiables sur le bilan d’extension classique par scanner TAP et scintigraphie osseuse.
Les patients avec un temps de doublement court du PSA (PSA DT < 10 mois) sont particulièrement à risque d’évoluer vers des métastases (6).
Hormonothérapies de 2e génération + suppression androgénique
Trois essais randomisés ont été conduits de manière similaire afin de tester l’efficacité d’une HT2G en plus de la SAd dans cette population :
• SPARTAN, incluant 1 207 patients, a montré un bénéfice pour l’association SAd + apalutamide versus SAd seul avec un gain en survie sans métastase (SSM) et en SG (gain de 24 et 14 mois respectivement ; HR = 0,78 ; IC 95 % = 0,64-0,96 ; p = 0,0161 pour la SG) (7).
• De la même manière, l’étude ARAMIS, ayant inclus 1 509 patients, a montré un bénéfice de l’association SAd + darolutamide. La SG à 36 mois était de 83 versus 77 % en faveur du bras darolutamide (HR ; 0,69 ; IC 95 % = 0,53-0,88 ; p = 0,003). Le gain de SSM était de 18,4 mois (8).
• PROSPER a inclus 1 401 patients et a montré un bénéfice de l’ajout de l’enzalutamide au traitement par SAd seul. Le gain de SSM était de 22 mois, et celui de SG de
11 mois dans le bras enzalutamide (HR = 0,73 ; IC 95 % = 0,61-0,89 ; p = 0,001) (9, 10).
À ce jour, l’AFU recommande l’ajout d’apalutamide, d’enzalutamide ou de darolutamide à la suppression androgénique seule chez les patients présentant un CaP en récidive, résistant à la castration, sans métastase apparente sur le bilan par scintigraphie osseuse et scanner TAP (grade fort) (5).
Stade métastatique hormonosensible
Intensification de la suppression androgénique
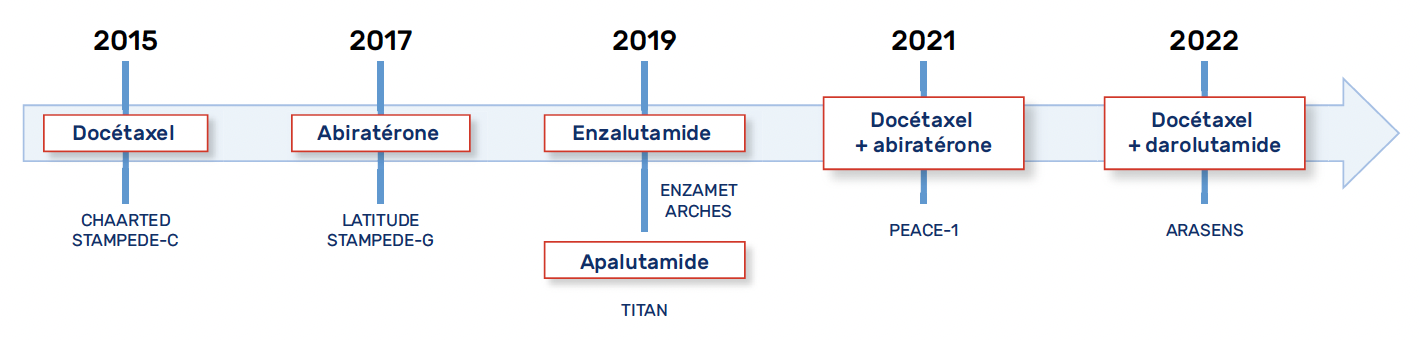
La prise en charge des cancers de prostate hormonosensibles métastatiques (CPHSm) a considérablement évolué ces 10 dernières années avec l’intensification de la SAd (Fig. 2).
Figure 2 – Chronologie des études de phase III en situation métastatique hormonosensible.
En 2015, les études CHAARTED et STAMPEDE bras C ont démontré un bénéfice en termes de SG avec l’ajout de docétaxel six cycles tous les 21 jours à la dose de 75 mg/m² à la SAd pour les maladies d’emblée métastatiques, notamment pour celles à haut volume tumoral défini par la présence de métastase(s) viscérale(s) ou la présence d’au moins quatre lésions osseuses, dont une en dehors du squelette axial (vertèbres et bassin) (11–13).
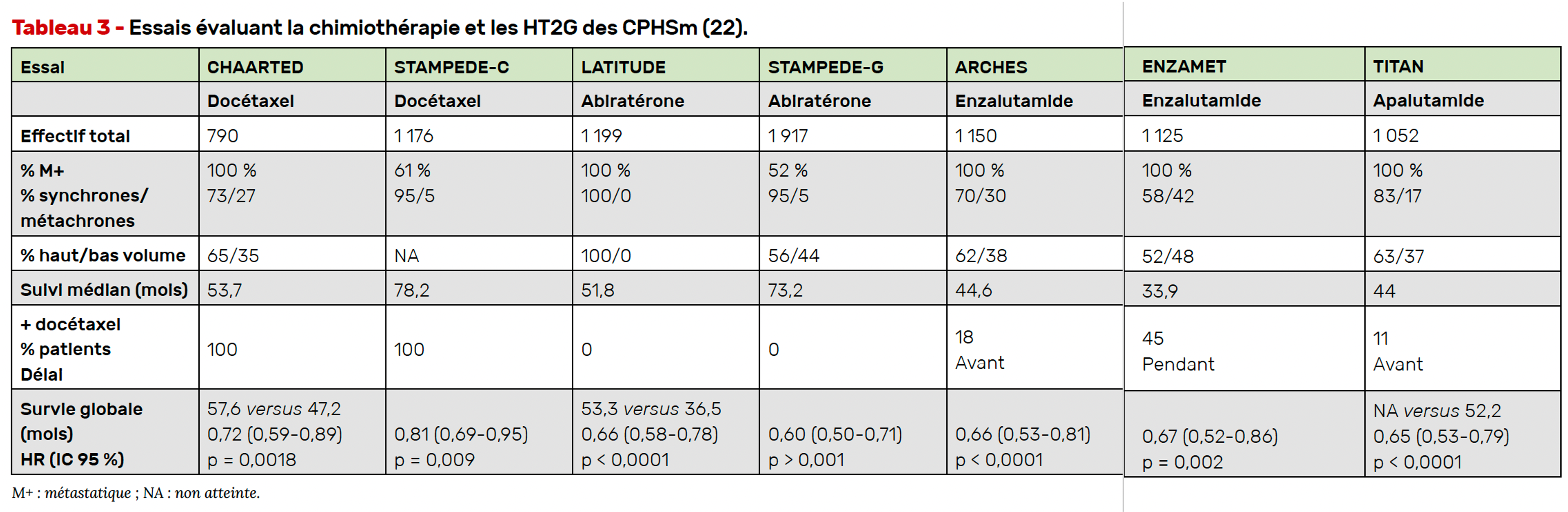
Depuis, cinq études de phase III randomisées ont établi la supériorité en termes de SG de l’ajout d’une des HT2G à la SAd en phase hormonosensible (LATITUDE (14), STAMPEDE bras G (15, 16), ENZAMET (17), ARCHES (18,19) et TITAN (20,21)). Les résultats de ces études sont rappelés dans le tableau 3.
L’intérêt de l’intensification du traitement des patients atteints d’un CPHSm n’est plus à démontrer et, sur la base de ces essais, l’association SAd + HT2G est devenue le standard thérapeutique. La place de la chimiothérapie est au cœur des discussions et la question de l’intérêt d’un triplet par SAd + docétaxel + HT2G s’est donc naturellement posée.
Place du triplet ?
Avec abiratérone
L’étude PEACE-1, menée par le GETUG (Groupe d’étude des tumeurs uro-génitales) avait un double objectif :
• évaluer le bénéfice en termes de SG de la radiothérapie prostatique chez des patients d’emblée métastatiques hormononaïfs et
• évaluer l’intensification du traitement systémique en ajoutant l’abiratérone au standard de traitement, initialement défini par la SAd seule ou en association au docétaxel au choix de l’investigateur. Le traitement standard a été amendé en cours d’étude pour devenir SAd + docétaxel pour tous les patients inclus en raison des données de l’étude CHAARTED, ce qui a permis de comparer l’association SAd ± docétaxel versus SAd ± docétaxel + abiratérone. Près de 60 % des patients ont donc reçu une SAd + docétaxel.
Après un suivi médian de 4,4 ans pour la SG et 3,5 ans pour la survie sans progression radiologique (SSPr), le bénéfice de l’adjonction de l’abiratérone + prednisone au traitement standard (SAd ± docétaxel) est estimé à 2,5 ans pour la SSPr (HR = 0,54 ; 0,41-0,71 ; p < 0,0001) et à 12 mois pour la SG (médiane de 5,72 versus 4,72 ans ; HR = 0,82 ; IC 95,1 % = 0,69-0,98 ; p = 0,034). Ce bénéfice en SG est également observé dans la population traitée par chimiothérapie (HR = 0,75 ; IC 95,1 % = 0,59-0,95 ; p = 0,017). Si les données en SG dans le groupe de faible volume tumoral ne sont pas matures, le bénéfice de l’ajout de l’abiratérone à la SAd + docétaxel est d’autant plus marqué chez les patients avec un haut volume tumoral (selon la définition de CHAARTED) (HR = 0,72 ; IC 95 % = 0,55-0,95 ; p = 0,019) (23).
Avec enzalutamide
Ces résultats sont différents de l’analyse en sous-groupes des patients traités par docétaxel (45 %) de l’étude ENZAMET pour qui l’ajout de l’enzalutamide n’a pas augmenté la survie (HR = 0,90 ; IC 95 % 0,62-1,31) (17).
Avec darolutamide
L’étude ARASENS a, quant à elle, des résultats en faveur du bénéfice en termes de survie avec l’adjonction du darolutamide au docétaxel + SAd (24). Dans cette étude, les patients inclus (n = 1 306) étaient randomisés entre SAd + docétaxel + darolutamide versus SAd + docétaxel + placebo. Plus de 80 % des patients présentaient une maladie d’emblée métastatique.
L’étude a atteint son objectif principal (SG) avec une réduction du risque de mortalité de 32 % (médiane de survie non atteinte versus 48,9 mois ; HR = 0,68 ; IC 95 % = 0,57-0,80 ; p < 0,001) chez les patients recevant le triplet.
Dans les études en sous-groupes, le bénéfice n’est pas retrouvé pour les patients avec métastases métachrones. L’ajout du darolutamide à l’association SAd + docétaxel prolonge la SG indépendamment du volume (haut/bas, selon la définition de CHAARTED : HR = 0,69 ; IC 95 % = 0,57-0,82 et HR = 0,68 ; IC 95 % = 0,41-1,13, respectivement) ; et indépendamment du risque (haut/bas, HR = 0,71 ; IC 95 % = 0,58-0,86 et HR = 0,62 ; IC 95 % = 0,42-0,90 respectivement, défini selon les critères de LATITUDE : ≥ deux facteurs parmi score de Gleason ≥ 8 ; ≥ 3 métastases osseuses ; présence de métastase viscérale) (25).
Triplet versus doublet d’hormonothérapies
En revanche, à ce jour, il n’y a aucune étude de phase III évaluant le bénéfice en termes de survie du triplet à un doublet d’hormonothérapies (SAd + HT2G) ne permettant pas de confirmer la supériorité du triplet à un doublet d’hormonothérapies. Il est important dès lors que l’on souhaite réaliser une chimiothérapie par docétaxel d’y associer en plus de la SAd une HT2G. Les résultats récents d’une méta-analyse sont en faveur du bénéfice du triplet chez les malades ayant une maladie de haut volume hormonosensible (26).
À ce jour, l’AFU recommande l’intensification SAd + HT2G pour tous les patients en capacité de recevoir cette association, en réservant le triplet pour les patients d’emblée métastatiques au diagnostic avec une maladie de haut volume tumoral (22).
Stade métastatique en situation d’hormonorésistance
Inhibiteurs de PARP et cancer de la prostate métastatique résistant à la castration (mCRPC)
À l’ère de la médecine de précision, les inhibiteurs de PARP (PARPi) ont fait leur place dans la prise en charge des cancers de prostate. Environ 20-25 % des patients atteints d’un cancer de la prostate métastatique présentent des mutations somatiques ou germinales de gènes impliqués dans la réparation de l’ADN (HRR), les plus fréquentes étant BRCA1/2 et ATM.
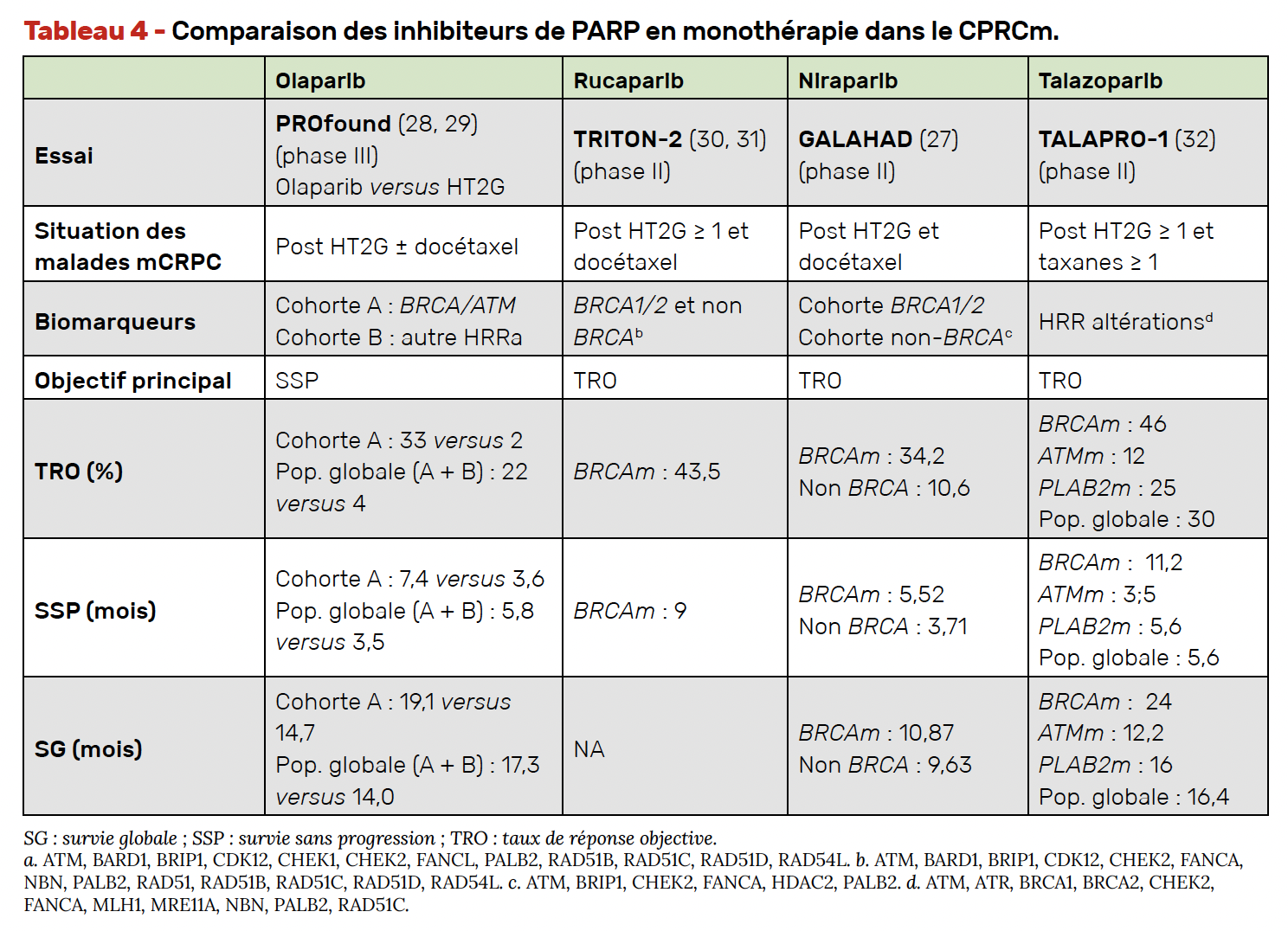
Plusieurs essais cliniques ont évalué leur place dans les cancers de prostate métastatiques soit en monothérapie, soit en association à une hormonothérapie de nouvelle génération (HT2G). Le niraparib, l’olaparib, le rucaparib et le talazoparib sont les quatre PARPi qui ont été évalués dans le cancer de prostate. Le tableau 4 montre leurs résultats dans leur essai représentatif (GALAHAD (27), PROfound (28, 29), TRITON 2 (30, 31) et TALAPRO-1 (32), respectivement). L’étude PROfound est la première étude de phase III dont les résultats ont été publiés.
L’olaparib
L’étude PROfound, publiée en 2020, a permis l’obtention d’une AMM et d’un remboursement pour l’olaparib chez les patients avec un CPRCm progressif après HT2G et présentant une altération moléculaire des gènes BRCA1 ou BRCA2.
Cette phase III randomisée (olaparib versus HT2G) a inclus 387 pa-tients au sein de deux cohortes :
• la cohorte A avec des patients atteints d’un CPRCm présentant une altération de BRCA1, BRCA2 ou ATM,
• et la cohorte B incluant ceux avec une altération d’autres gènes de la recombinaison homologue.
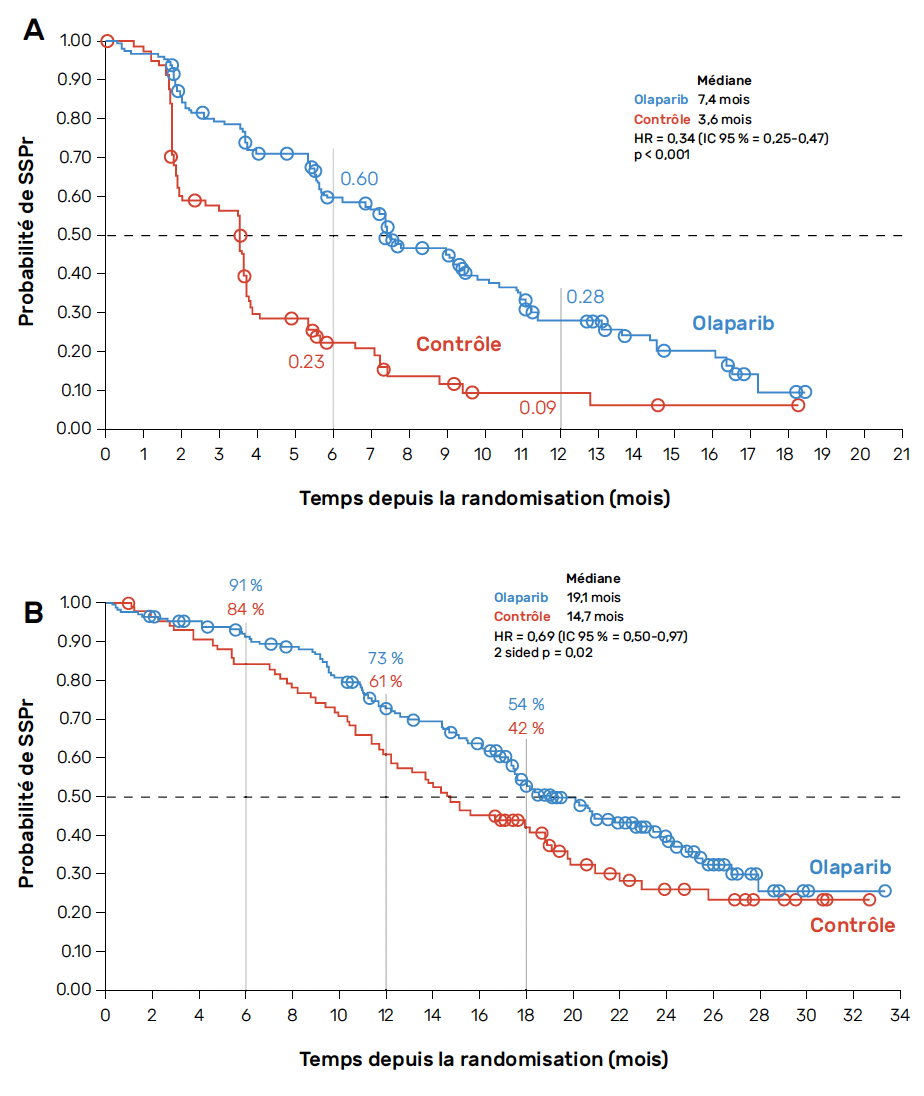
L’objectif principal de l’étude a été atteint avec amélioration de la SSPr dans la cohorte A passant de 3,55 à 7,39 mois (HR = 0,34 ; IC 95 % = 0,25-0,47 ; p < 0,0001). Le bénéfice était moins net et non significatif dans la cohorte B. La SG était également augmentée dans la cohorte A avec un bénéfice de 4,4 mois (19,1 versus 14,7 mois (HR = 0,69 ; IC 95 % = 0,50-0,97; p = 0,02) (Fig. 3) (28, 29).
Figure 3 – Survie sans progression radiologique (A) et survie globale (B) chez les patients de la cohorte A dans l’étude PROfound.
Le rucaparib
L’étude TRITON-3 a évalué le rucaparib en monothérapie chez des patients porteurs d’une mutation HRR en 2de ligne mCRPC après échec d’une HT2G avec pour comparateur soit une seconde HT2G, soit le docétaxel, choix du traitement à la discrétion de l’investigateur. Dans cette étude, les patients étaient moins lourdement prétraités que dans l’étude PROfound.
L’étude est positive sur son critère de jugement principal qui est la SSPr dans la population BRCA1/2 (11,2 versus 6,4 mois ; HR = 0,50 ; IC 95 % = 0,36-0,69) et dans la population HRR muté (HR = 0,61 ; IC 95 % = 0,47-0,80). Aucun bénéfice n’a été observé chez les patients présentant une mutation d’ATM. Il n’y a pas de différence en termes de SG, mais il faut préciser qu’un cross-over était possible pour les patients traités dans le bras standard et 75 % de ces patients ont reçu du rucaparib après la progression (33).
Les études MAGNITUDE, PROpel et TALAPRO-2 ciblaient une population moins avancée dans la maladie, en situation de première ligne CPRCm après suppression androgénique.
Niraparib + AA
L’étude MAGNITUDE est une étude de phase III randomisée évaluant en 1re ligne de résistance à la castration (après suppression androgénique, chez des patients naïfs de HT2G) l’association AA + niraparib versus AA + placebo. Après screening moléculaire, les patients ont été traités dans deux cohortes en fonction du statut mutationnel des gènes HRR : la cohorte HRR muté (HRRm) (n = 400) et la cohorte HRR non muté (HRRnm) (n = 600). Les altérations moléculaires considérées comme HRRm étaient : ATM, BRCA1, BRCA2, BRIP1, CDK12, CHEK2, FANCA, HDAC2, PALB2.
• Dans la cohorte HRRm, on retrouve un bénéfice du combo niraparib + AA avec amélioration de la SSPr (HR = 0,73 ; IC 95 % = 0,56-0,96 ; p = 0,022), d’autant plus marquée dans le sous-groupe BRCA1/2 muté (HR = 0,53 ; IC 95 % = 0,36-0,79 ; p = 0,01). Bien qu’il y ait une tendance en faveur de l’association, le bénéfice en SG n’est pas statistiquement significatif (cohorte HRRm, HR = 0,77 ; IC 95 % = 0,53-1,12).
• Concernant la population HRRnm, il ne semble y avoir aucun bénéfice à l’ajout du niraparib, puisqu’une analyse de futilité intermédiaire a été réalisée et est négative, expliquant l’interruption précoce de cette cohorte (34).
Olaparib + AA
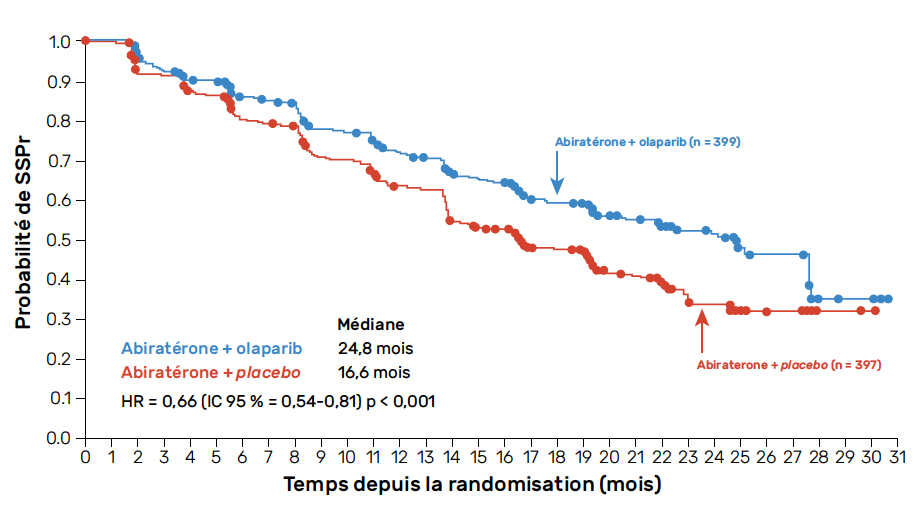
L’essai PROpel a évalué l’association AA + olaparib versus AA + placebo quel que soit le statut mutationnel des patients. 796 patients ont été randomisés.
L’objectif principal de l’étude a été atteint avec amélioration de la SSPr (24,8 versus 16,6 mois ; HR = 0,66 ; IC 95 % = 0,54-0,81 ; p < 0,0001) (Fig. 4) (35). L’analyse en sous-groupes rapportée à l’ESMO 2022 semble confirmer le bénéfice en SSPr de la combinaison, quel que soit le sous-groupe (HRRm, BRCAm et HRRnm), mais de façon nette pour les patients mutés BRCA1/2 (36). L’analyse finale de la SG est à la limite de la significativité avec une tendance à l’amélioration avec la combinaison (42,1 versus 34,7 mois ; HR = 0,81 ; IC 95 % = 0,67-1,00 ; p = 0,54) (37).
Figure 4 – Survie sans progression radiologique dans l’étude PROpel.
Talazoparib + enzalutamide
Les résultats plus récents de l’étude de phase III TALAPRO-2, évaluant l’association talazoparib + enzalutamide versus placebo + enzalutamide en 1re ligne de résistance à la castration viennent renforcer la place des PARPi en combinaison à une HT2G. Dans cette étude, les patients étaient inclus indépendamment du statut HRR.
Elle montre un avantage clair en termes de SSPr en faveur de l’association avec une réduction du risque de progression ou de décès de 37 % (médiane non atteinte versus 21,9 mois HR = 0,63 ; IC 95 % = 0,51-0,78). Le bénéfice est d’autant plus net dans le sous-groupe HRR muté (27,9 versus 16,4 mois ; HR = 0,46 ; IC 95 % = 0,30-0,70 ; p < 0,001), mais persiste chez les HRR non mutés (HR = 0,66 ; IC 95 % = 0,49-0,91 ; p = 0,009). Ces analyses en sous-groupes, bien qu’exploratoires et non stratifiées confirment l’effet potentiel synergique des PARPi avec les inhibiteurs de la voie du récepteur des androgènes. Les données de SG sont encore immatures (38).
Le positionnement des PARPi soulève plusieurs questions à la fois en termes de séquence thérapeutique et de sous-population de patients, notamment chez les patients déjà exposés à une HT2G (faible proportion de patients, voire nulle dans ces études). Cependant, sur la base de ces résultats, la combinaison olaparib + abiratérone est actuellement accessible en accès précoce pour les patients présentant un mCRPC en 1re ligne de résistance à la castration (indépendamment du statut BRCA) et l’association niraparib + abiratérone est disponible en accès précoce seulement pour les patients BRCA1/2 mutés.
L’efficacité de ces associations en phase de résistance à la castration a conduit à la réalisation d’études en phase hormonosensible (TALAPRO-3, AMPLITUDE), uniquement dans les populations mutées HRR.
Les associations
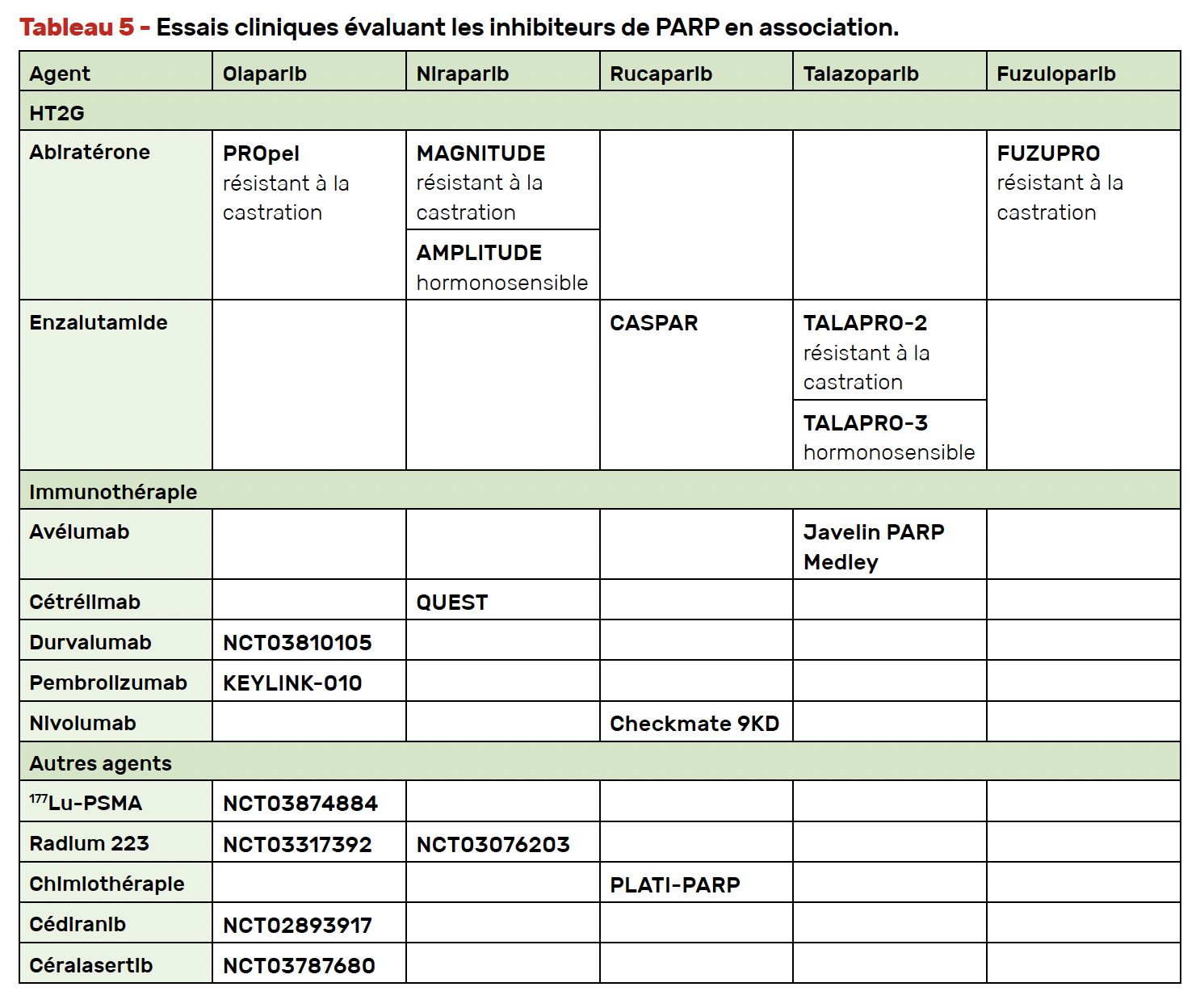
Enfin, plusieurs études (synthétisées dans le tableau 5) évaluent des associations de PARPi avec d’autres molécules telles que l’immunothérapie, le Lu-PSMA, la chimiothérapie ou bien encore le radium-223. Bien qu’il existe un rationnel biologique à l’association des PARPi à l’immunothérapie pour améliorer leur efficacité (39, 40), l’essai de phase III KEYLINK-010, rapporté à l’ESMO 2022, a été arrêté pour futilité.
Radiothérapie interne vectorisée : approche thérapeutique du Lu-PSMA en situation de résistance à la castration
La radiothérapie interne vectorisée (RIV) est une nouvelle approche thérapeutique qui a fait ses preuves dans la prise en charge des CPRCm. Elle utilise un radio-isotope ciblant le PSMA, une protéine transmembranaire exprimée à la surface des cellules prostatiques. Le PSMA est à la fois une cible utilisée pour la détection radiologique avec, par exemple, la TEP-scanner au 68Ga-PSMA, mais aussi thérapeutique avec le 177Lu-PSMA-617 (Lu-PSMA).
Chez les patients prétraités
L’étude VISION a été la première étude internationale de phase III à évaluer l’efficacité du Lu-PSMA chez des patients atteints d’un CPRCm déjà prétraités par une HT2G et au moins une ligne de chimiothérapie par docétaxel (41). Les patients éligibles devaient avoir une TEP 68Ga-PSMA- positive à l’inclusion. 831 patients ont été randomisés en 2:1 entre le bras expérimental par Lu-PSMA (six cycles, une injection de 7,4 GBq toutes les 6 semaines) versus des soins de support et/ou en association avec une HT2G (excluant la chimiothérapie). Dans cet essai, 38 % des patients avaient reçu deux lignes de chimiothérapie.
L’étude a atteint son objectif principal avec une amélioration de la SSPr de l’ordre de 5,3 mois en faveur du Lu-PSMA (8,7 versus 3,4 mois ; HR = 0,40 ; 0,29-0,57). La SG a également été améliorée passant de 11,3 à 15,3 mois (HR = 0,63 ; 0,52-0,74). Les objectifs secondaires ont également été atteints. Parmi les 248 patients avec une maladie mesurable selon RECIST 1.1, 51 % ont obtenu une réponse objective (réponse complète + réponse partielle) dans le bras Lu-PSMA contre 3 % dans le bras contrôle. Le profil de tolérance était acceptable, associant principalement la fatigue, la sécheresse buccale et oculaire et une hématotoxicité (grade 3-4 : anémie 13 %, thrombopénie 8 %, neutropénie 2,5 %).
Sur ces données publiées en septembre 2021, le 177Lu-PSMA-617 a été approuvé et est disponible en France dans le cadre d’un accès précoce chez les patients ayant un CPRCm prétraités au moins par une HT2G et une ligne de chimiothérapie par docétaxel.
Chez les patients naïfs de chimiothérapie
Le Lu-PSMA a également été évalué chez les patients naïfs de chimiothérapie, après une ligne de HT2G en situation mCRPC. Les résultats de l’étude PSMAfore (NCT04689828) ont été présentés à l’ESMO 2023 (42). Cette étude a inclus 468 patients atteints d’un mCRPC n’ayant jamais reçu de taxanes, progressant après HT2G et présentant au moins une lésion PSMA positive. Les patients étaient randomisés entre le traitement par Lu-PSMA ou une modification de l’HT2G. Un cross-over était autorisé à la progression.
L’étude a atteint son critère principal, démontrant une amélioration de la SSPr avec le Lu-PSMA (12 versus 5,6 mois ; HR = 0,411 ; IC 95 % = 0,29-0,56 ; p < 0,0001. Cependant, l’absence de bénéfice en termes de SG limite l’effet clinique de ces résultats et ne permet pas à ce jour de proposer le Lu-PSMA aux patients naïfs de taxanes.
Chez les patients non éligibles à la chimiothérapie
Les résultats préliminaires de l’étude SPLASH (NCT04647526) chez des patients non éligibles à la chimiothérapie après HT2G sont également en faveur d’une amélioration de la SSPr avec le Lu-PSMA versus une autre HT2G. Les données de SG sont immatures (43).
Lu-PSMA versus cabazitaxel
Le positionnement du Lu-PSMA par rapport au cabazitaxel reste débattu. L’essai de phase II TheraP a cherché à répondre à cette question en comparant l’efficacité du Lu-PSMA par rapport au cabazitaxel chez 200 patients atteints d’un mCRPC prétraités par docétaxel et une HT2G (44). La sélection comprenait une TEP 68Ga-PSMA-positive et une TEP 18FDG négative. Le critère d’évaluation principal était le taux de réponse du PSA (> 50 %).
Les résultats sont en faveur du Lu-PSMA avec une amélioration en termes de réponse du taux de PSA et de la SSPr. Cependant, il n’y a pas de différence significative en termes de SG entre les deux bras de traitement, mais il ne s’agit que d’une phase II. En revanche, le profil de tolérance était favorable au Lu-PSMA.
Le Lu-PSMA est donc une nouvelle thérapeutique dans la prise en charge du cancer de prostate après HT2G et docétaxel chez les patients mCRPC, disponible en accès précoce.
La mise en place du traitement nécessite une coordination du parcours de soins avec le service de médecine nucléaire pour la réalisation d’une TEP 68Ga-PSMA pré-thérapeutique et la mise en place des traitements. Un super bone scan ou une infiltration médullaire néoplasique constitue une contre-indication relative au traitement en raison du risque d’hématotoxicité accrue.
Devant ces résultats prometteurs, l’étude PSMAddition (NCT04720157) est en cours pour évaluer l’ajout du Lu-PSMA à l’association SAd + HT2G en situation hormonosensible. Les résultats permettront de définir avec plus de certitudes la séquence thérapeutique optimale.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Attard G, Murphy L, Clarke NW et al. Abiraterone acetate and prednisolone with or without enzalutamide for high-risk non-metastatic prostate cancer: a meta-analysis of primary results from two randomised controlled phase 3 trials of the STAMPEDE platform protocol. Lancet 2022 ; 399 : 447‑60.
2. Briganti A, Abdollah F, Nini A et al. Performance characteristics of computed tomography in detecting lymph node metastases in contemporary patients with prostate cancer treated with extended pelvic lymph node dissection. Eur Urol 2012 ; 61 : 1132‑8.
3. Hofman MS, Lawrentschuk N, Francis RJ et al. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet 2020 ; 395 : 1208‑16.
4. Hicks RJ, Murphy DG, Williams SG. Seduction by sensitivity: reality, illusion, or delusion? the challenge of assessing outcomes after PSMA imaging selection of patients for treatment. J Nucl Med 2017 ; 58 : 1969‑71.
5. Ploussard G, Fiard G, Barret E et al. French AFU Cancer Committee Guidelines – Update 2022-2024: prostate cancer – Diagnosis and management of localised disease. Progres Urol J 2022 ; 32 : 1275‑372.
6. Smith MR, Saad F, Oudard S et al. Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer: exploratory analyses by baseline prostate-specific antigen doubling time. J Clin Oncol 2013 ; 31 : 3800‑6.
7. Smith MR, Saad F, Chowdhury S et al. Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med 2018 ; 378 : 1408‑18.
8. Fizazi K, Shore N, Tammela TL et al. Darolutamide in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2019 ; 380 : 1235‑46.
9. Hussain M, Fizazi K, Saad F et al. Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2018 ; 378 : 2465‑74.
10. Sternberg CN, Fizazi K, Saad F et al. Enzalutamide and survival in nonmetastatic, castration-resistant prostate cancer. N Engl J Med 2020 ; 382 : 2197‑206.
11. Kyriakopoulos CE, Chen YH, Carducci MA et al. Chemohormonal therapy in metastatic hormone-sensitive prostate cancer: long-term survival analysis of the randomized phase III E3805 CHAARTED trial. J Clin Oncol 2018 ; 36 : 1080‑7.
12. James ND, Sydes MR, Clarke NW et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016 ; 387 : 1163‑77.
13. Clarke NW, Ali A, Ingleby FC et al. Addition of docetaxel to hormonal therapy in low- and high-burden metastatic hormone sensitive prostate cancer: long-term survival results from the STAMPEDE trial. Ann Oncol 2019 ; 30 : 1992‑2003.
14. Fizazi K, Tran N, Fein L et al. Abiraterone acetate plus prednisone in patients with newly diagnosed high-risk metastatic castration-sensitive prostate cancer (LATITUDE): final overall survival analysis of a randomised, double-blind, phase 3 trial. Lancet Oncol 2019 ; 20 : 686‑700.
15. James ND, de Bono JS, Spears MR et al. Abiraterone for prostate cancer not previously treated with hormone therapy. N Engl J Med 2017 ; 377 : 338‑51.
16. James ND, Clarke NW, Cook A et al. Abiraterone acetate plus prednisolone for metastatic patients starting hormone therapy: 5-year follow-up results from the STAMPEDE randomised trial (NCT00268476). Int J Cancer 2022 ; 151 : 422‑34.
17. Davis ID, Martin AJ, Stockler MR et al. Enzalutamide with standard first-line therapy in metastatic prostate cancer. N Engl J Med 2019 ; 381 : 121‑31.
18. Armstrong AJ, Szmulewitz RZ, Petrylak DP et al. ARCHES: a randomized, phase III study of androgen deprivation therapy with enzalutamide or placebo in men with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2019 ; 37 : 2974‑86.
19. Armstrong AJ, Azad AA, Iguchi T et al. Improved survival with enzalutamide in patients with metastatic hormone-sensitive prostate cancer. J Clin Oncol 2022 ; 40 : 1616‑22.
20. Chi KN, Agarwal N, Bjartell A et al. Apalutamide for metastatic, castration-sensitive prostate cancer. N Engl J Med 2019 ; 381 : 13‑24.
21. Chi KN, Chowdhury S, Bjartell A et al. Apalutamide in patients with metastatic castration-sensitive prostate cancer: final survival analysis of the randomized, double-blind, phase III TITAN study. J Clin Oncol 2021 ; 39 : 2294‑303.
22. Ploussard G, Roubaud G, Barret E et al. French AFU Cancer Committee Guidelines – Update 2022-2024: prostate cancer – Management of metastatic disease and castration resistance. Progres Urol J 2022 ; 32 : 1373‑419.
23. Fizazi K, Foulon S, Carles J et al. Abiraterone plus prednisone added to androgen deprivation therapy and docetaxel in de novo metastatic castration-sensitive prostate cancer (PEACE-1): a multicentre, open-label, randomised, phase 3 study with a 2 × 2 factorial design. Lancet 2022 ; 399 : 1695‑707.
24. Smith MR, Hussain M, Saad F et al. Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med 2022 ; 386 : 1132‑42.
25. Hussain M, Tombal B, Saad F et al. Darolutamide plus androgen-deprivation therapy and docetaxel in metastatic hormone-sensitive prostate cancer by disease volume and risk subgroups in the phase III ARASENS trial. J Clin Oncol 2023 ; 41 : 3595-607.
26. Mandel P, Hoeh B, Wenzel M et al. Triplet or doublet therapy in metastatic hormone-sensitive prostate cancer patients: a systematic review and network meta-analysis. Eur Urol Focus 2023 ; 9 : 96‑105.
27. Smith MR, Scher HI, Sandhu S et al. Niraparib in patients with metastatic castration-resistant prostate cancer and DNA repair gene defects (GALAHAD): a multicentre, open-label, phase 2 trial. Lancet Oncol 2022 ; 23 : 362‑73.
28. de Bono J, Mateo J, Fizazi K et al. Olaparib for metastatic castration-resistant prostate cancer. N Engl J Med 2020 ; 382 : 2091‑102.
29. Hussain M, Mateo J, Fizazi K et al. Survival with olaparib in metastatic castration-resistant prostate cancer. N Engl J Med 2020 ; 383 : 2345‑57.
30. Abida W, Patnaik A, Campbell D et al. Rucaparib in men with metastatic castration-resistant prostate cancer harboring a BRCA1 or BRCA2 gene alteration. J Clin Oncol 2020 ; 38 : 3763‑72.
31. Abida W, Campbell D, Patnaik A et al. Non-BRCA DNA damage repair gene alterations and response to the PARP inhibitor rucaparib in metastatic castration-resistant prostate cancer: analysis from the phase II TRITON2 study. Clin Cancer Res 2020 ; 26 : 2487‑96.
32. de Bono JS, Mehra N, Scagliotti GV et al. Talazoparib monotherapy in metastatic castration-resistant prostate cancer with DNA repair alterations (TALAPRO-1): an open-label, phase 2 trial. Lancet Oncol 2021 ; 22 : 1250‑64.
33. Fizazi K, Piulats JM, Reaume MN et al. Rucaparib or physician’s choice in metastatic prostate cancer. N Engl J Med 2023 ; 388 : 719-32.
34. Chi KN, Rathkopf D, Smith MR et al. Niraparib and abiraterone acetate for metastatic castration-resistant prostate cancer. J Clin Oncol 2023 ; 41 : 3339‑51.
35. Clarke NW, Armstrong AJ, Thiery-Vuillemin A et al. Abiraterone and olaparib for metastatic castration-resistant prostate cancer. NEJM Evid 2022 ; 1 : EVIDoa2200043.
36. Saad F, Armstrong AJ, Thiery-Vuillemin A et al. PROpel: Phase III trial of olaparib (ola) and abiraterone (abi) versus placebo (pbo) and abi as first-line (1L) therapy for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 2022 ; 40 : 11.
37. Saad F, Clarke NW, Oya M et al. Olaparib plus abiraterone versus placebo plus abiraterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2023 ; 24 : 1094‑108.
38. Agarwal N, Azad AA, Carles J et al. Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 2023 ; 402 : 291‑303.
39. Shen J, Zhao W, Ju Z et al. PARPi triggers the STING-dependent immune response and enhances the therapeutic efficacy of immune checkpoint blockade independent of BRCAness. Cancer Res 2019 ; 79 : 311‑9.
40. Jiao S, Xia W, Yamaguchi H et al. PARP inhibitor upregulates PD-L1 expression and enhances cancer-associated immunosuppression. Clin Cancer Res 2017 ; 23 : 3711‑20.
41. Sartor O, de Bono J, Chi KN et al. Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021 ; 385 : 1091‑103.
42. Sartor AO, Castellano D, Herrmann K et al. Phase III trial of [177Lu]Lu-PSMA-617 in taxane-naive patients with metastatic castration-resistant prostate cancer (PSMAfore). Ann Oncol 2023 ; 34 : S324-5.
43. Lantheus and POINT Biopharma announce positive topline results from pivotal SPLASH trial in metastatic castration-resistant prostate cancer. 18 décembre 2023. Disponible sur : lantheusholdings.gcs-web.com/news-releases/news-release-details/lantheus-and-point-biopharma-announce-positive-topline-results.
44. Hofman MS, Emmett L, Sandhu S et al. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet 2021 ; 397 : 797‑804.