Résumé
Les métastases leptoméningées correspondent à une invasion de la leptoméninge et, par extension, du liquide céphalo-rachidien par des cellules cancéreuses. Elle est plus communément appelée méningite carcinomateuse même si cette appellation reste imprécise. Souvent considérée comme un événement fatal dans l’histoire de la maladie, elle est aujourd’hui mieux prise en charge lorsqu’elle est découverte à temps. Les différentes stratégies de traitement sont en général peu efficaces et nécessitent une bonne connaissance de la pathologie afin de proposer des traitements sur mesure, concomitants ou séquentiels, et espérer améliorer la survie sans altérer la qualité de vie. Des recommandations européennes EANO/ESMO publiées en 2017 et mises à jour en septembre 2023 permettent de mettre un cadre diagnostique et thérapeutique à la prise en charge de ces métastases rares. Cet article propose de poser les bases de la prise en charge diagnostique et thérapeutique et d’insister sur la nécessité de discussion de ces métastases en RCP spécialisée de neuro-oncologie.
Abstract
Leptomeningeal metastases
Leptomeningeal metastases are caused by the invasion of cancer cells into the leptomeninge and, by extension, the cerebrospinal fluid. They are more commonly known as carcinomatous meningitis, even though this term remains equivocal. Often considered a fatal event in the course of the disease’s progression, the leptomeningeal metastases are now more effectively handled when diagnosed at an early stage. The different therapeutic strategies are generally not very effective, and require a good understanding of the disease in order to propose personalized, concomitant or sequential treatments and hope to improve survival without altering quality of life. The European EANO/ESMO guidelines published in 2017 and updated in september 2023 provide a diagnostic and therapeutic framework for the management of these rare metastases. This article outlines the basis of diagnostic and therapeutic approaches and also emphasizes the need to discuss these metastases in specialized neuro-oncology meeting.
Introduction
La méningite
Dans les esprits, la méningite est une maladie foudroyante, de mauvais pronostic, responsable d’une morbi-mortalité importante. C’était le cas pour tout type de méningites jusqu’à l’apparition des anti-infectieux sur la deuxième partie du XXe siècle. Aujourd’hui, la prise en charge des méningites infectieuses reste une urgence diagnostique et thérapeutique, mais depuis que la prise en charge est bien codifiée, la mortalité est < 10 %. Cependant, la méningite d’origine tumorale reste aujourd’hui synonyme de fin de vie. Les soins de confort exclusifs d’emblée sont souvent préférés à la prise en charge codifiée et personnalisée. Certains patients avec une prise en charge spécialisée peuvent compter sur une espérance de vie > 6-12 mois en fonction des situations.
La leptoméningite et la pachyméningite
L’appellation de méningite carcinomateuse est ancienne et imprécise et fait référence à une atteinte tumorale des méninges. En général, elle est utilisée pour faire référence à une leptoméningite, mais ne fait pas la distinction entre une leptoméningite et une pachyméningite.
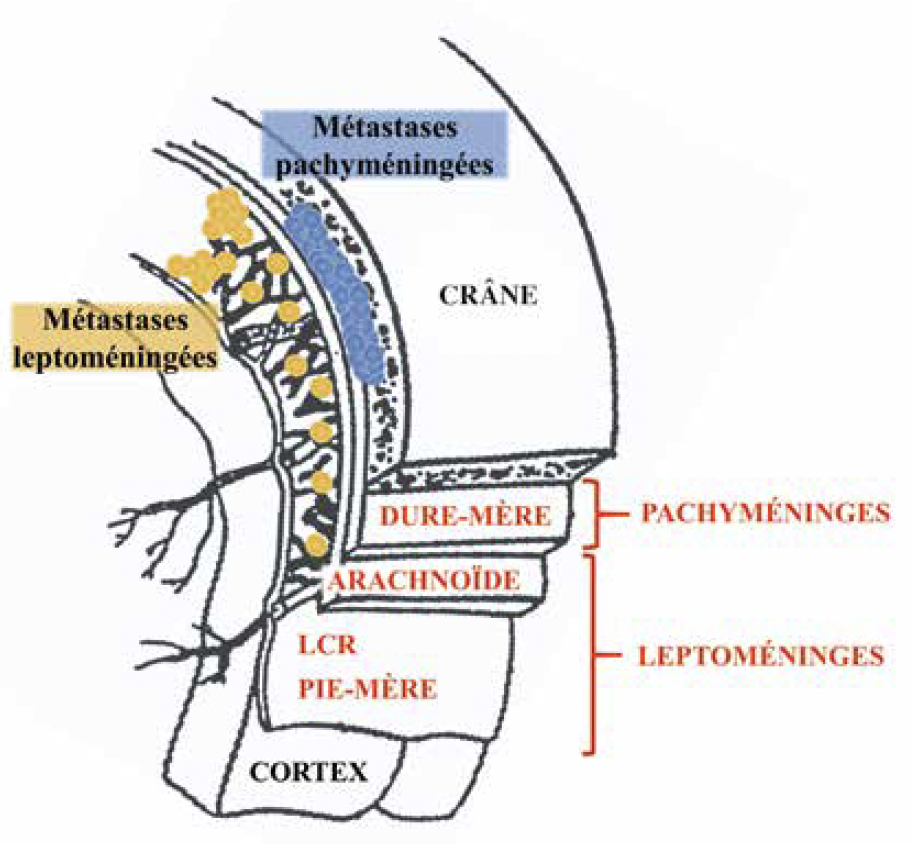
Les leptoméninges, du grec lepto– pour “mince”, sont composées de la pie-mère et de l’arachnoïde où baigne le liquide céphalo-rachidien (LCR). Elles sont à bien différencier de la pachyméninge, du grec pachy- pour “épais”, qui est composée de la dure-mère. Cette dernière correspond à un tissu fibrineux dur et solide ayant pour double fonction la protection mécanique du système nerveux central (SNC) et le soutien aux structures vasculo-nerveuses. Lorsqu’un processus infectieux, inflammatoire ou tumoral, affecte ces structures, on parle de leptoméningite et pachyméningite (Fig. 1 et 2).
Figure 1 – Représentation imagée des méninges et de leurs métastases.
LCR : liquide céphalo-rachidien
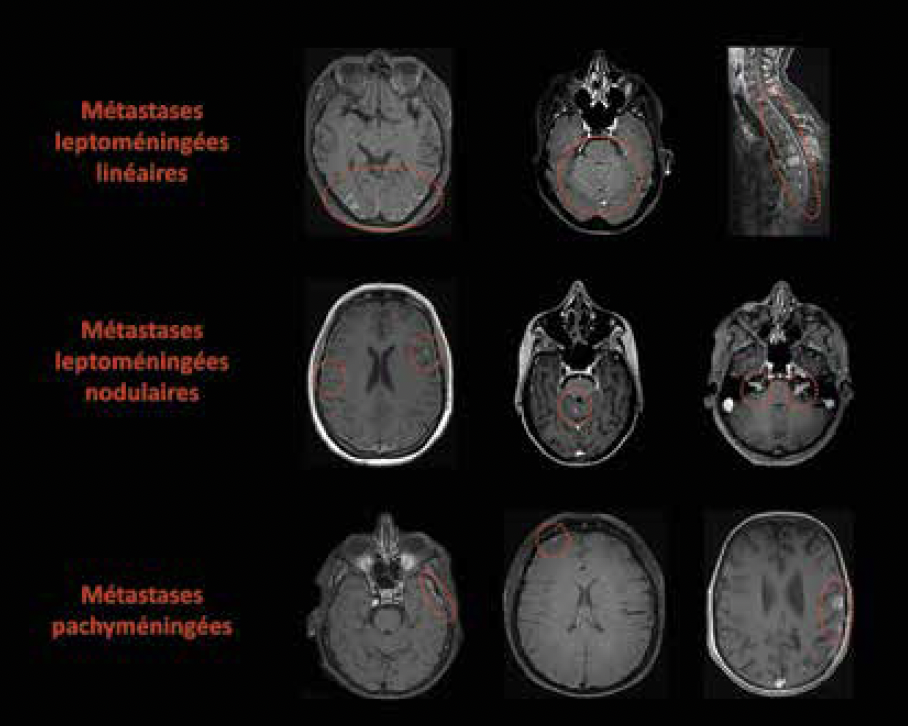
Figure 2 – Images d’IRM cérébrale en coupe axiale ou médullaire en coupe sagittale en séquence T1 avec injection de gadolinium représentant des atteintes leptoméningées linéaires ou nodulaires ou pachyméningées à l’intérieur du cercle rouge en pointillés.
À retenir
En effet, les termes de leptoméningite carcinomateuse, leptoméningite néoplasique ou métastases leptoméningées (ML) permettent de préciser l’envahissement des leptoméninges et du LCR par des cellules cancéreuses. Les leptoméninges enveloppent le cerveau et la moelle épinière, et contiennent le LCR. En cas d’atteinte, il est important de comprendre que la dissémination est au sein de l’ensemble du SNC via la circulation des cellules cancéreuses dans le LCR au même titre qu’une carcinose péritonéale dans la cavité péritonéale.
Au contraire, les métastases pachyméningées restent localisées même si elles peuvent se diffuser le long de la dure-mère et représenter un important volume. Elles sont souvent secondaires à une invasion par contiguïté d’une métastase osseuse. Elles peuvent également donner lieu à des métastases leptoméningées par contiguïté. Lorsqu’elles sont localisées et non associées à une atteinte de la leptoméninge, un traitement par radiothérapie localisée peut être indiqué. Au niveau du rachis, elles sont également appelées épidurites.
Cette invasion des leptoméninges intervient par différentes voies :
• via la circulation artérielle par les plexus choroïdes ;
• via la circulation veineuse par le plexus de Batson ;
• par contiguïté à partir d’une atteinte cérébrale ou osseuse.
Après l’envahissement d’un espace sous-arachnoïdien, les cellules cancéreuses peuvent se déplacer via le LCR et envahir tout le névraxe. L’infiltration le plus souvent retrouvée est celle de la base du crâne et rachidienne.
Les complications
Les complications classiques des ML sont une hypertension du LCR, une obstruction du flux du LCR, une invasion du cortex, de la moelle et des paires crâniennes, du cône terminal et des racines de la queue de cheval. En découle une symptomatologie neurologique assez diverse avec notamment le syndrome méningé (céphalées, nausées, vomissements, troubles de la vigilance, raideur de nuque, photophobie), épilepsie, déficits sensitivo-moteurs, douleurs neuropathiques, atteintes des paires crâniennes.
Épidémiologie
Les ML surviennent chez 5-10 % des cancers. Les études autopsiques révèlent qu’en cas de symptômes neurologiques le taux de ML augmente à 20 %. Les trois cancers les plus pourvoyeurs de ML sont le cancer du poumon, le mélanome et le cancer du sein. Les ML se développent le plus souvent alors que les patients ont déjà un cancer multi-métastatique (> 70 %), mais peuvent également être la première manifestation du cancer (5-10 %), en l’absence d’autres signes de maladie systémique. Enfin, les ML sont associées à la présence simultanée de métastases cérébrales chez 30 à 50 % des patients.
Les facteurs de risque
Dans les facteurs de risque connus des ML, on retrouve : les chirurgies de métastases de la fosse cérébrale postérieure ou l’exérèse d’une métastase cérébrale avec ouverture du système ventriculaire. De plus, le sous-type de certains cancers est également un facteur de risque comme dans le cancer du sein où le sous-type lobulaire et le statut triple négatif (absence d’expression des récepteurs aux œstrogènes, absence d’expression des récepteurs de la progestérone, absence de surexpression de HER2) sont un facteur de risque de développer une ML.
Diagnostic
Le diagnostic des ML repose sur la symptomatologie neurologique, l’imagerie par IRM et l’analyse du LCR. Pour améliorer la prise en charge et la structuration des essais cliniques, des sous-types de leptoméningite ont été établis par un consensus d’experts européen de l’EANO/ESMO. Ce groupe de travail a permis de définir les recommandations diagnostiques et thérapeutiques ainsi que les outils nécessaires à l’évaluation de la réponse avec les critères
RANO-LM (1, 2).
À retenir
La démarche diagnostique repose sur l’examen neurologique, l’analyse du LCR et l’évaluation complète du SNC par une IRM crânio-spinale.
L’analyse du LCR
La ponction lombaire permet de conforter le diagnostic lorsqu’il existe une augmentation de la pression intra-crânienne à l’ouverture, du nombre de lymphocytes, de la concentration de protéines et une diminution de la concentration de glucose. Le diagnostic de certitude est permis par la détection de cellules carcinomateuses dans le LCR. Le pré-analytique (étape avant le traitement des échantillons au laboratoire de cytologie) joue un rôle central lorsque l’envahissement n’est pas massif. En effet, en cas de suspicion, il est nécessaire de prélever idéalement 10 ml et au moins 5 ml de LCR, d’acheminer les prélèvements dans les 30 minutes pour limiter la lyse des cellules afin de retrouver des cellules carcinomateuses dans 50-70 % des cas avec une coloration MGG après cytospin et préférentiellement après une première centrifugation du LCR afin d’utiliser du LCR concentré en cellules. En cas de forte suspicion de ML, un deuxième, voire troisième, prélèvement doit être réalisé, ce qui permet d’augmenter la sensibilité à 80-90 %. On estime qu’uniquement 5-10 % des patients peuvent présenter des ML sans cellules carcinomateuses à la ponction lombaire. De nouveaux outils permettent d’améliorer la sensibilité de détection surtout lorsque la rigueur pré-analytique n’est pas respectée (volume de LCR, délai d’acheminement). Par exemple, la recherche d’ADN circulant tumoral (ADNcT) ou la détection des cellules tumorales circulantes (CTC) par cytométrie de flux. Pour la détection d’ADNcT, les méthodes les plus sensibles sont la droplet digital PCR, mais utilisable qu’en cas de mutation hotspot connue comme dans le cancer du poumon avec les mutations de l’EGFR.
À retenir
Le volume moyen de LCR chez un adulte est de 150 ml. Il est renouvelé complètement trois fois par jour avec une production moyenne de 500 ml de LCR par 24 h. Il est possible de prélever 20-30 ml de LCR lors d’une ponction lombaire sans surrisque de syndrome post-ponction lombaire ou autres complications.
L’IRM crânio-spinale
L’IRM crânio-spinale permet quant à elle de détecter les ML, surtout utile à un stade asymptomatique ou pauci-symptomatique, ou de mieux caractériser le type d’atteinte leptoméningée et son étendue. En effet, la leptoméningite est classée en deux entités radiologiques :
• la forme linéaire qui correspond à un tapissage relativement uniforme de la leptoméninge
• et la forme nodulaire qui correspond à la formation de nodules (Fig. 2).
L’association des deux formes correspondant à une forme dite mixte.
Au même titre que l’analyse cytologique, selon les séries, il persiste un taux élevé de faux négatifs (jusqu’à 60 %) et le perfectionnement des techniques d’IRM ainsi que l’expertise d’un neuro-radiologue permettent d’augmenter la sensibilité de détection. L’examen recommandé est une IRM avec rehaussement au gadolinium et coupes fines sur le cerveau de 1 mm, et de 3 mm sur la moelle épinière. Il peut être utile d’attendre au moins 10 minutes entre le moment de l’injection du gadolinium et l’acquisition des images afin d’améliorer le rehaussement de la leptoméninge qui est tardif. Enfin, des séquences dédiées pour la détection des ML comme la séquence 3D T1 Fast Spin Echo (FSE) Black-Blood post-gadolinium et T2 FLAIR post-gadolinium permettent de pouvoir détecter au plus tôt les premiers signes de ML (Fig. 2 et 3).
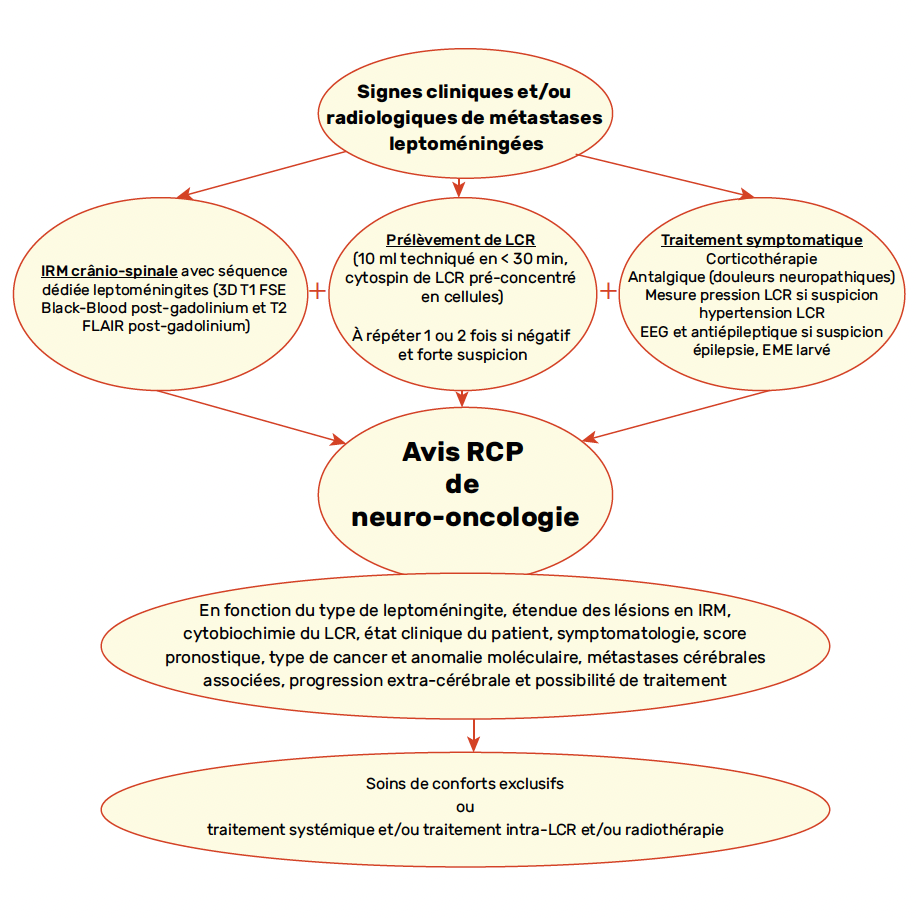
Figure 3 – Présentation simplifiée de la prise en charge diagnostique et thérapeutique des métastases leptoméningées.
LCR : liquide céphalo-rachidien ; EME : état de mal épileptique
Classification
La dernière recommandation européenne classe les ML en fonction de la présence de symptômes, de cellules carcinomateuses et du sous-type radiologique.
• La ML est de type I si présence de cellules carcinomateuses dans le LCR
• ou de type II en cas d’absence de cellules carcinomateuses ou de résultats douteux dans le LCR et de présence de symptômes neurologiques et/ou d’images évocatrices en IRM.
Ensuite, elle est définie selon le sous-type en IRM comme :
• de type A si linéaire,
• de type B si nodulaire
• de type C si linéaire et nodulaire
• et enfin de type D si l’IRM retrouve une hydrocéphalie ou est normale.
En découle un algorithme de traitement en fonction du type I ou II, du type A, B, C ou D et de la présence de métastases cérébrales actives et de maladie systémique évolutive.
À retenir
Étant donné la complexité de la prise en charge des ML, il est recommandé de s’appuyer sur une équipe de neuro-oncologie afin d’aider au bilan diagnostique et de personnaliser les prises en charge (Fig. 3).
Traitements
Stratégie thérapeutique
La prise en charge thérapeutique dépend en partie du bilan initial et surtout du pronostic du patient. En cas d’une évaluation d’une espérance de vie < 1 mois, il est recommandé de proposer des soins de confort exclusifs d’emblée.
L’espérance de vie peut être indirectement évaluée via l’indice de Karnofsky < 70 % qui reste le meilleur marqueur pronostique dans les ML. En outre, des scores dédiés comme dans le cancer du sein avec le score de Curie modifié (RH négatif = +1, ECOG 3-4 = +1, > 3 lignes de chimiothérapies = +1. Score à 2 ou 3 = médiane de survie à 3,5 mois) (3). Dans le cancer du poumon, d’autres facteurs pronostiques ont été évalués comme la profondeur de l’atteinte du LCR définie par la quantité de CTC du LCR ou d’ADN tumoral. Un LCR massivement envahi est corrélé à une médiane de survie < 3 mois.
Enfin, ces marqueurs pronostiques sont à contrebalancer avec d’autres facteurs qui pousseront à proposer une prise en charge thérapeutique : des traitements systémiques potentiellement efficaces, une atteinte précoce dans l’évolution de la maladie ou encore une atteinte isolée.
À retenir
Les trois piliers du traitement sont :
• le traitement systémique,
• le traitement intra-LCR (thérapies injectées directement dans le LCR via une ponction lombaire, ou dispositif d’injection intra-thécale ou ventriculaire)
• et la radiothérapie (Fig. 3).
Il est important également de proposer une prise en charge symptomatique des symptômes neurologiques et notamment du syndrome méningé et l’hypertension du LCR et épilepsie via l’utilisation de corticostéroïdes, acétazolamide (Diamox®) au cas par cas et le recours à un électro-encéphalogramme (EEG) pour éliminer un état de mal épileptique (EME) larvé en cas de trouble de la vigilance.
Les thérapies systémiques
Le choix du traitement systémique repose sur son efficacité potentielle dans les ML, en l’absence de données scientifiques, dans les métastases cérébrales, à défaut sur la pathologie métastatique et en dernier lieu sur sa potentielle supériorité en termes de pénétration de la barrière hémato-méningée.
Les thérapies en injection intra-LCR
Les traitements en injection intra-LCR reposent sur des traitements ayant démontré l’absence de neurotoxicité et une efficacité potentielle. Le méthotrexate en injection intra-LCR permet d’espérer une amélioration de la symptomatologie neurologique dans 50 % des cas. En cas d’utilisation d’injection intra-LCR, il est aujourd’hui indiqué dans les recommandations EANO-ESMO la mise en place d’un cathéter intra-ventriculaire connecté à un réservoir (type réservoir d’ommaya). L’avantage de l’utilisation de ce dispositif est le confort du patient avec une procédure d’injection simplifiée, et la potentielle meilleure efficacité des traitements injectés en intra-ventriculaire secondaire à la meilleure diffusion dans le LCR. En contrepartie, du fait d’un dispositif implanté, il y a risque de complications de 10 %, notamment infectieuses.
La radiothérapie
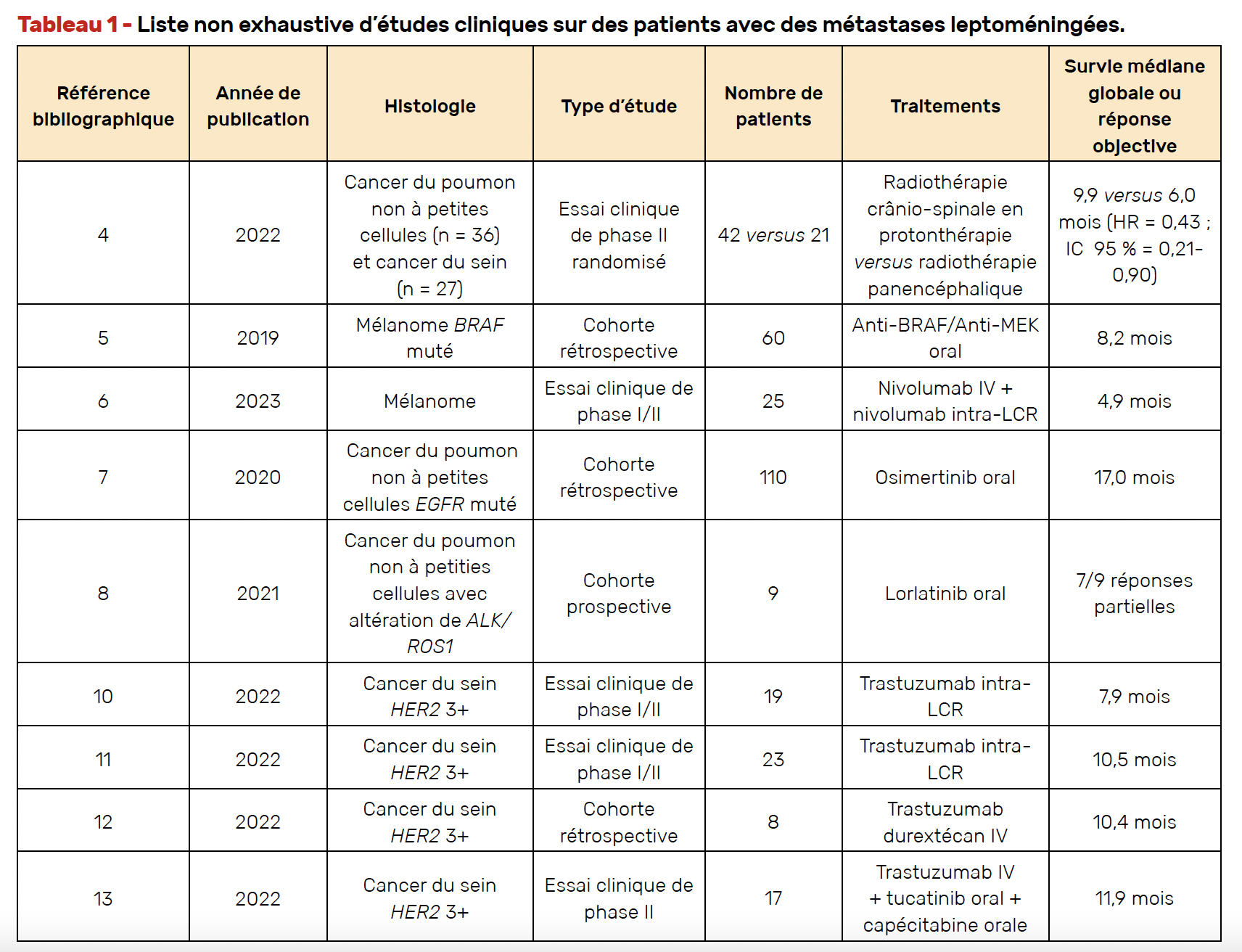
La radiothérapie est un traitement symptomatique des ML, elle permet d’améliorer temporairement une atteinte encéphalique surtout lorsqu’elle est nodulaire et/ou associée à des métastases cérébrales. Elle est également utilisée en cas de métastases localisées bloquant le flux du LCR ou symptomatique. Un essai de phase II randomisé explorant l’efficacité d’une irradiation crânio-spinale en protonthérapie a pu démontrer des résultats prometteurs avec une survie médiane globale à 9,9 mois avec une toxicité acceptable (4) (Tab. 1). Cependant, l’accès à la protonthérapie pour une irradiation crânio-spinale dans le contexte de ML n’est pas encore accessible en France.
Dans le mélanome
L’immunothérapie par voie systémique est peu efficace avec des survies médianes de quelques mois. Pour les mélanomes mutés BRAF, les anti-BRAF et anti-MEK restent les traitements plus efficaces avec une survie globale médiane de 8,2 mois (5) (Tab. 1). Les voies de recherche s’orientent vers l’utilisation de l’immunothérapie par voie intra-LCR comme le démontre cette phase I/II d’injection intra-CSF de nivolumab concomitante à l’injection IV en escalade de dose (6) (Tab. 1). Il n’a pas été retrouvé de toxicité limitante à la dose de 50 mg de nivolumab intrathécal toutes les 2 semaines et la survie globale médiane était à
4,9 mois avec un taux de survie globale de 26 % à 12 mois.
Dans le cancer du poumon
Les chimiothérapies conventionnelles ou l’immunothérapie ont des taux de réponse décevants et des médianes de survie < 3 mois. Cependant, en cas de mutation EGFR, les nouvelles générations d’inhibiteur de tyrosine kinase pouvant passer la barrière hémato-méningée, comme l’osimertinib, permettent d’obtenir des réponses durables comme le démontre cette étude rétrospective intégrant 110 patients avec une survie globale médiane à 17 mois (7) (Tab. 1). Il en est de même pour les inhibiteurs de ALK et ROS1 avec, par exemple, le lorlatinib avec lequel un taux de réponse prometteur est retrouvé dans une étude allemande de vie réelle avec sept patients sur neuf présentant une réponse partielle (8) (Tab. 1).
Dans le cancer du sein
Le traitement des ML a évolué ces dernières années et en particulier pour les cancers du sein HER2 3+ dont la survie globale médiane historique était à 5,2 mois (9). Deux essais cliniques de phase II sont en faveur d’une efficacité potentielle de l’utilisation de trastuzumab en injection intra-CSF avec des survies globales médianes à 7,9 et 10,5 mois (10,11) (Tab. 1). Plus récemment, une série de cas publiés en 2023 reportent une efficacité potentielle du trastuzumab déruxtécan avec une survie globale médiane à 10,4 mois (12) (Tab. 1). D’autre part, un essai de phase II a évalué l’efficacité des trastuzumab, tucatinib, capécitabine dans les ML et retrouve une survie globale médiane à 11,9 mois avec un important passage du tucatinib dans le LCR (ratio LCR/plasma à 0,83) (13) (Tab. 1).
Enfin, les perspectives sont prometteuses avec notamment l’ouverture prochaine d’un essai clinique de phase II multicentrique français, ETIC-LM (NCT05800275), dans les ML de cancer du sein HER2 3+ avec l’utilisation de trastuzumab en injection intra-LCR en combinaison avec du tucatinib et de la capécitabine sous forme orale.
Conclusion
En l’absence de traitement, l’espérance de vie des patients présentant des ML est < 3 mois. Chez des patients sélectionnés, et notamment présentant des anomalies moléculaires, il semble important de proposer une prise en charge thérapeutique personnalisée associant séquentiellement ou en association de la chimiothérapie systémique, de la chimiothérapie intra-LCR et de la radiothérapie en s’appuyant sur l’expertise d’une RCP spécialisée en neuro-oncologie qui devrait être à jour sur les dernières données publiées (les neuf études cliniques citées dans l’article datent des 5 dernières années).
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Le Rhun E, Weller M, Bent M et al. Leptomeningeal metastasis from solid tumours: EANO–ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. ESMO Open 2023 ; Epud ahead of print.
2. Le Rhun E, Devos P, Winklhofer S et al. Prospective validation of a new imaging scorecard to assess leptomeningeal metastasis: a joint EORTC BTG and RANO effort. Neuro Oncol 2022 ; 24 : 1726-35.
3. Carausu M, Carton M, Darlix A et al. Breast cancer patients treated with intrathecal therapy for leptomeningeal metastases in a large real-life database. ESMO Open 2021 ; 6 : 100150.
4. Yang JT, Wijetunga NA, Pentsova E et al. Randomized phase II trial of proton craniospinal irradiation versus photon involved-field radiotherapy for patients with solid tumor leptomeningeal metastasis. J Clin Oncol 2022 ; 40 : 3858-67.
5. Ferguson SD, Bindal S, Bassett RL et al. Predictors of survival in metastatic melanoma patients with leptomeningeal disease (LMD). J Neurooncol 2019 ; 142 : 499-509.
6. Glitza Oliva IC, Ferguson SD, Bassett R et al. Concurrent intrathecal and intravenous nivolumab in leptomeningeal disease: phase 1 trial interim results. Nat Med 2023 ; 29 :
898-905.
7. Lee J, Choi YL, Han J et al. Osimertinib improves overall survival in patients with EGFR-mutated NSCLC with leptomeningeal metastases regardless of T790M mutational status. J Thorac Oncol 2020 ; 15 : 1758-66.
8. Frost N, Christopoulos P, Kauffmann-Guerrero D et al. Lorlatinib in pretreated ALK- or ROS1-positive lung cancer and impact of TP53 co-mutations: results from the German early access program. Ther Adv Med Oncol 2021 ; 13 : 1758835920980558.
9. Morikawa A, Jordan L, Rozner R et al. Characteristics and outcomes of patients with breast cancer with leptomeningeal metastasis. Clin Breast Cancer 2017 ; 17 : 23-8.
10. Oberkampf F, Gutierrez M, Trabelsi Grati O et al. Phase II study of intrathecal administration of trastuzumab in patients with HER2-positive breast cancer with leptomeningeal metastasis. Neuro Oncol 2023 ; 25 : 365-74.
11. Kumthekar PU, Avram MJ, Lassman AB et al. A phase I/II study of intrathecal trastuzumab in HER-2 positive cancer with leptomeningeal metastases: safety, efficacy, and cerebrospinal fluid pharmacokinetics. Neuro Oncol 2023 ; 25 : 557-65.
12. Alder L, Trapani D, Bradbury C et al. Durable responses in patients with HER2+ breast cancer and leptomeningeal metastases treated with trastuzumab deruxtecan. NPJ Breast Cancer 2023 ; 9 : 1-5.
13. Murthy RK, O’Brien B, Berry DA et al. Abstract PD4-02: Safety and efficacy of a tucatinib-trastuzumab-capecitabine regimen for treatment of leptomeningeal metastasis (LM) in HER2-positive breast cancer: Results from TBCRC049, a phase 2 non-randomized study. Cancer Research 2022 ; 82 : PD4-02.