C’est parti pour un nouveau congrès de l’ASCO-GU, placé sous le signe de l’innovation, de la recherche et de l’espoir dans la lutte contre les cancers urologiques. Cette année encore, les experts internationaux se sont réunis pour présenter les dernières avancées thérapeutiques et les résultats d’études cliniques majeures, qui pourraient bien redéfinir les standards de soins !
• Dans le cancer de la prostate : des résultats de phases III très attendus (TALAPRO-2), des stratégies de médecine personnalisée et un regard approfondi sur les nouvelles approches thérapeutiques, comme les inhibiteurs de PARP, la radiothérapie ciblée ou vectorisée et les nouveaux biomarqueurs.
• Dans le carcinome urothélial : des progrès dans tous les aspects de la maladie, avec de nouvelles stratégies péri-opératoires (NIAGARA), jusqu’aux traitements de 1re ligne métastatique (EV-302) et au-delà avec des molécules particulièrement innovantes.
• Dans le carcinome rénal, l’immunothérapie a particulièrement révolutionné la prise en charge de nos malades, avec un suivi à long terme d’études pivots (CheckMate-9ER) qui confirment leur rôle majeur. La recherche du biomarqueur idéal se poursuit afin d’éclairer la prise de décision thérapeutique du carcinome rénal. Enfin, de nouvelles molécules prometteuses pointent déjà à l’horizon (inhibiteurs de HIF-2α) et viendront probablement enrichir notre arsenal thérapeutique !
Cancer de la prostate localisé
Cancer de la prostate à haut risque : prostatectomie radicale versus radiothérapie
Roy S et al. Radical prostatectomy (RP) versus radiotherapy (RT) in high-risk prostate cancer (HR-PCa): Emulated randomized comparison with individual patient data (IPD) from two phase III randomized trials (RCTs). J Clin Oncol 2025 ; 43 : abstr. 309.
Les cancers de la prostate localisés à haut risque (HR-CP) représentent 20 à 25 % des nouveaux diagnostics de tumeurs prostatiques. La prostatectomie radicale (PR) ou la radio-hormonothérapie prolongée (18 à 36 mois) sont les deux approches thérapeutiques proposées dans ce cadre. Les résultats oncologiques de la chirurgie dans ce contexte sont hétérogènes et difficiles à interpréter, en raison des différentes définitions utilisées et de l’association variable avec des traitements adjuvants ou de rattrapage, les taux de survie spécifique à 10 ans variant de 85 à 98 % selon les séries. Il n’existe pas d’essai randomisé comparant la PR à la radiothérapie (RT) ou la radio-hormonothérapie (RT-HT). Certaines cohortes comparatives rétrospectives et une méta-analyse suggèrent que la chirurgie est au moins équivalente à la RT-HT et pourrait offrir un avantage en survie spécifique par rapport à la RT seule. Cependant, d’autres études plus récentes montrent que la combinaison RT, curiethérapie et hormonothérapie (HT) est équivalente, voire supérieure, à la chirurgie. Il est important de souligner que ces études présentent de nombreux biais et ne permettent pas de conclure sur la supériorité d’une approche par rapport à l’autre.
Une récente étude comparant la PR et la RT dans le cadre de la prise en charge du HR-CP localisé a été réalisée en utilisant des données individuelles de deux essais cliniques randomisés de phase III. Les résultats ont été présentés lors du congrès de l’ASCO-GU 2025.
Méthode
Une recherche systématique a été effectuée dans la base de données bibliographique Medline pour identifier des essais randomisés qui concernaient la prise en charge thérapeutique du HR-CP localisé incluant un bras standard fondé sur la RT externe ou la PR. Afin de limiter les biais potentiels, seuls les essais comportant des traitements expérimentaux similaires et un recrutement concomitant dans le même pays ont été sélectionnés. Cette démarche a permis d’identifier deux études de phase III :
• l’étude NRG/RTOG 0521, qui évaluait l’apport d’un traitement adjuvant par docétaxel (six cycles) en association avec une déprivation androgénique de longue durée (2 ans) et une RT externe (72,0 à 75,6 Gy) (1) ;
• l’étude CALGB 90203, évaluant l’apport d’une chimiothérapie néoadjuvante par docétaxel (six cycles) associée à la suppression androgénique (ADT) suivie d’une PR (2).
En raison des différences intrinsèques dans les critères de récidive biochimique au décours d’une irradiation ou d’une chirurgie, l’incidence cumulative des métastases à distance pondérée par probabilité inverse de traitement (IPTW) a été choisie comme critère de jugement principal. Cette mesure a été réalisée en considérant les décès comme événements concurrents. De plus, la mortalité après l’apparition de métastases a été analysée afin de produire un indicateur harmonisé des décès probablement liés au CP. Enfin, pour évaluer d’éventuels biais de sélection résiduels, la mortalité sans métastase à distance a été examinée, représentant les décès non associés au cancer.
Les patients
L’étude a porté sur 1 290 malades avec 557 patients traités par RT et 733 traités par PR avec un suivi médian de 6,4 ans. Avant l’ajustement par IPTW, les patients traités par chirurgie étaient significativement plus jeunes et présentaient un PSA basal plus faible que ceux du groupe RT. Concernant les traitements complémentaires, 18 % des patients opérés ont reçu une HT adjuvante et 44 % ont bénéficié d’une RT de rattrapage.
Résultats
L’analyse principale a révélé que l’incidence cumulative des métastases à distance était significativement plus faible dans le groupe RT comparé au groupe PR avec un taux de métastases à distance à 8 ans de 16 % sous irradiation vs 23 % sous chirurgie (p = 0,01) et un risque relatif de 0,56 (IC 95 % : 0,38-0,81 ; p = 0,002). Le taux de mortalité après apparition de métastases à 8 ans était de 10 % chez les patients traités par PR contre 8 % dans le groupe RT (p = 0,72). Le taux de mortalité sans métastases à distance (décès non liés au cancer) était significativement plus élevé dans le groupe RT (HR = 2,14 [1,12-4,10] ; p = 0,048). Cette différence s’est manifestée de façon précoce au cours du suivi. Enfin, une comparaison a été réalisée entre le groupe de malades traités par RT externe et une déprivation androgénique de longue durée (sans docétaxel) (RT + LT-ADT) et celui de patients bénéficiant d’une chimiothérapie néoadjuvante par docétaxel associée à l’ADT suivie d’une PR (PR + ADT + docétaxel). On notait une incidence cumulative de métastases à distance à 8 ans de 18 % sous RT + LT-ADT contre 21 % sous PR + ADT + docétaxel (HR = 0,84 ; IC 95 % : 0,45-1,24 ; p = 0,48).
En pratique – Cette étude suggère un avantage potentiel en termes de contrôle métastatique en faveur de la radiothérapie par rapport à la prostatectomie dans le traitement du cancer de la prostate localisé à haut risque. Un suivi prolongé reste néanmoins nécessaire pour mieux évaluer la mortalité attribuable au cancer de la prostate. Malgré les ajustements statistiques par IPTW et la sélection rigoureuse des essais analysés, un biais résiduel semble persister. Cette hypothèse repose sur l’excès de décès précoces sans métastase à distance observé dans le groupe radiothérapie, témoignant d’une population traitée potentiellement plus fragile. L’utilisation de la radiothérapie post-opératoire associée à une hormonothérapie et/ou du docétaxel permet de réduire les différences d’incidence de métastases à distance entre les traitements par chirurgie et radiothérapie. Un essai randomisé (SPCG-15) est en cours pour comparer chirurgie et radio-hormonothérapie dans le cancer de la prostate à haut risque. On rappellera que la chimiothérapie n’est actuellement pas recommandée dans ce cadre et que l’ajout d’acétate d’abiratérone pendant 2 ans est désormais préconisé chez les patients atteints d’un cancer de la prostate non métastatique à haut risque, en association à une déprivation androgénique suite aux résultats récents de l’étude STAMPEDE.
Cancer de la prostate métastatique
TALAPRO-2 (actualisation) : résistance à la castration et association talazoparib + enzalutamide
Agarwal N et al. Final overall survival (OS) with talazoparib (TALA) + enzalutamide (ENZA) as first-line treatment in unselected patients with metastatic castration-resistant prostate cancer (mCRPC) in the phase 3 TALAPRO-2 trial. J Clin Oncol 2025 ; 43 : abstr. LBA18.
Fizazi K et al. Final overall survival (OS) with talazoparib (TALA) + enzalutamide (ENZA) as first-line (1L) treatment in patients (pts) with homologous recombination repair (HRR)-deficient metastatic castration-resistant prostate cancer (mCRPC) in the phase 3 TALAPRO-2 trial. J Clin Oncol 2025 ; 43 : abstr. LBA141.
À l’instar de l’étude PROPel avec l’olaparib, l’étude TALAPRO-2 a montré que l’utilisation d’un traitement par talazoparib et enzalutamide permettait une amélioration significative de la survie sans progression radiologique (SSPr) en comparaison avec enzalutamide, en situation de 1re ligne thérapeutique chez les patients atteints de cancer de la prostate métastatique résistant à la castration (CPRCm), indépendamment du statut HRR. Initialement, 805 malades ont été recrutés dans la cohorte all-comers (cohorte 1), indépendamment du statut HRR.
L’étude TALAPRO-2
Méthode
Après randomisation, les patients atteints d’un CPRCm recevaient un traitement par enzalutamide ± talazoparib. L’analyse de cette cohorte a démontré une amélioration statistiquement significative de la SSPr en faveur de l’association (HR = 0,63 ; IC 95 % : 0,51-0,78 ; p < 0,001) (3). Parmi eux, 169 patients avec un statut HRR déficient ont été recrutés auxquels 230 autres présentant une mutation connue d’un gène du système HRR ont été ajoutés pour constituer la cohorte 2 (n = 399). Dans cette cohorte HRRm, les mutations de BRCA2 étaient les plus courantes (31 % des patients sous enzalutamide et talazoparib vs 36,7 % des patients sous enzalutamide et placebo) suivies d’ATM (23,5 vs 19,6 %) et de CDK12 (18 vs 19,6 %).
Premiers résultats
Avec un suivi médian de 16,8 à 17,5 mois, on notait une nette amélioration de la médiane de SSPr en faveur de l’association (NA vs 13,8 mois dans le bras placebo et enzalutamide ; HR = 0,45 ; IC 95 % : 0,33-0,81 ; p < 0,0001). En analyse de sous-groupes, ce bénéfice restait constant, quel que soit le traitement reçu précédemment (abiratérone ou docétaxel). Les patients porteurs d’une mutation de BRCA1 ou BRCA2 et traités par enzalutamide + talazoparib présentaient une réduction importante de 80 % du risque de progression de la maladie (HR = 0,20 ; IC 95 % : 0,11-0,36 ; p < 0,0001). L’analyse gène par gène n’a pas retrouvé d’amélioration significative de la SSPr en dehors du groupe BRCA (PALB2, CDK12, ATM et autres). Les données de survie globale (SG) étaient encore immatures, mais il semblait se dégager une tendance à l’amélioration de la SG, notamment dans cette cohorte 2 (HR = 0,69 ; IC 95 % : 0,46-1,03 ; p = 0,068) (4).
Une actualisation particulièrement attendue de ces résultats a été présentée cette année au congrès de l’ASCO-GU, avec l’annonce récente d’un bénéfice significatif en SG en faveur de l’association, et ce, quel que soit le statut HRR.
Méthode
On rappelle que les patients de la cohorte 1 ont été répartis aléatoirement (randomisation 1:1) dans deux bras avec :
• soit un traitement par enzalutamide à 160 mg/jour associé au talazoparib 0,5 mg/jour (ou 0,35 mg/jour en cas d’insuffisance rénale modérée),
• soit un traitement par enzalutamide et placebo.
Les malades ont été stratifiés en fonction de l’utilisation antérieure d’abiratérone ou de docétaxel au stade cancer de la prostate hormonosensible métastatique (CPHSm) ou du statut d’altération des gènes HRR. Le critère de jugement principal était la SSPr, évaluée par un comité indépendant en aveugle. Les autres critères secondaires clés étaient la SG, avec une protection alpha pour garantir la robustesse statistique, le délai jusqu’à la mise en place d’une chimiothérapie, le taux de réponse objective (TRO), les données de tolérance et de qualité de vie.
Au total, 805 patients ont été inclus (402 patients dans le groupe talazoparib et enzalutamide et 403 dans le groupe enzalutamide et placebo).
Résultats de la cohorte 1
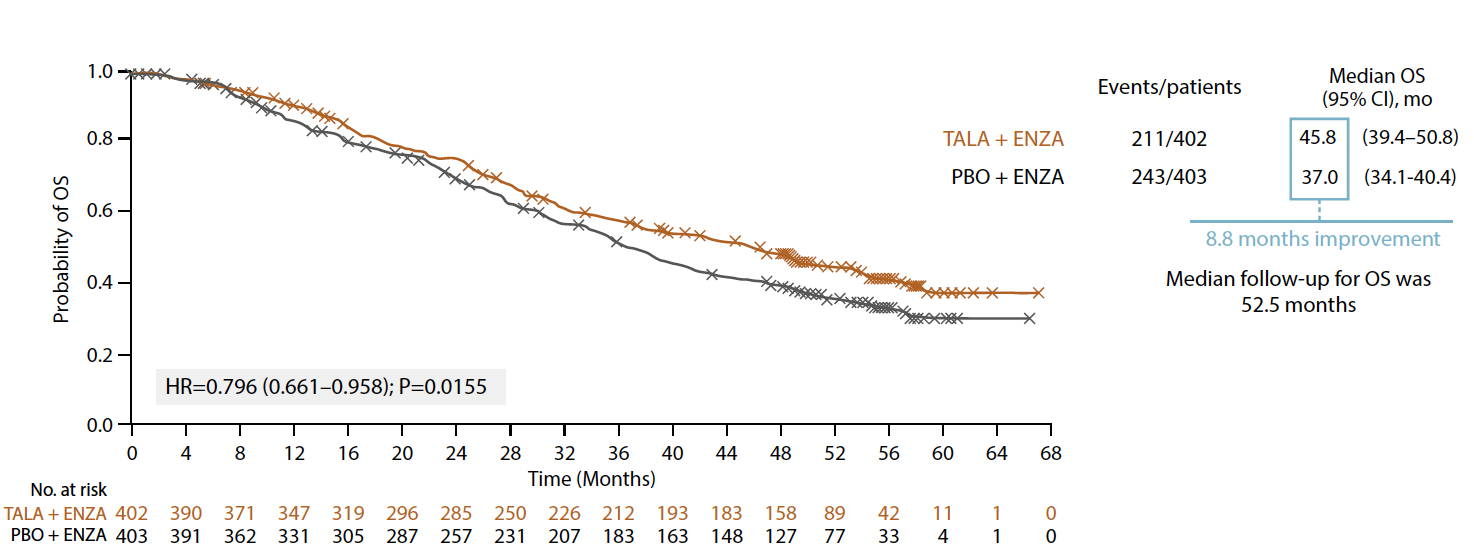
Les données de SSP ont été actualisées et confirment un bénéfice significatif et durable en termes de contrôle de la progression tumorale en faveur de l’association avec une médiane de SSPr de 33,1 mois (IC 95 % : 27,4-39 contre 19,5 mois (IC 95 % : 16,6-24,7) ; HR = 0,667 ; IC 95 % : 0,551-0,807 ; p < 0,0001). Au cut-off (3 septembre 2024), 211 patients (52 %) du groupe combiné étaient décédés contre 243 (60 %).
Avec un suivi médian de 52,5 mois pour le groupe ARPI et PARPi et de 53,0 mois pour le groupe hormonothérapie de nouvelle génération (HTNG) + placebo, on notait une diminution significative de 20,4 % de décès chez les patients bénéficiant d’un traitement par talazoparib et enzalutamide avec une médiane de SG de 45,8 mois (IC 95 % : 39,4-50,8) contre 37,0 mois (IC 95 % : 34,1-40,4) (HR = 0,796 ; IC 95 % : 0,661-0,958 ; p = 0,0155) (Fig. 1).
Figure 1 – TALAPRO-2 : données de survie globale (cohorte 1).
Analyses de sous-groupes
Les analyses de sous-groupes prédéfinis ont confirmé ces résultats chez les patients avec un statut HRR déficient (n = 169) (HR = 0,549 ; IC 95 % : 0,364-0,826 ; p = 0,0035) tout comme chez ceux ayant une maladie potentiellement plus agressive (Gleason ≥ 8, présence de métastases viscérales, maladie métastatique de novo). En revanche, l’amélioration observée chez les patients avec un statut HRR non déficient ou inconnu (n = 636) était non significative (HR = 0,878 ; IC 95 % : 0,713-1,080 ; p = 0,218). Des analyses supplémentaires ont été réalisées pour les patients disposant de résultats du statut HRR sur ADNct et sur tissu tumoral. Pour les malades sans altération de BRCA1/2 (n = 439), la SG était significativement améliorée dans le groupe talazoparib et enzalutamide (HR = 0,749 ; IC 95 % : 0,582-0,963 ; p = 0,024) et pour les patients sans altération HRR (n = 314), on notait une tendance à l’amélioration non significative (HR = 0,782 ; IC 95 % : 0,582-1,050 ; p = 0,101). Le délai jusqu’à la mise en place d’une chimiothérapie était significativement amélioré chez les patients recevant l’association (HR = 0,568 ; IC 95 % : 0,446-0,722 ; p < 0,001).
Tolérance
Le profil de tolérance est resté globalement conforme aux résultats initiaux avec un taux d’événements indésirables de grades ≥ 3 de 75,9 % dans le bras combiné (vs 44,6 %), avec notamment 49 % d’anémie et 19 % de neutropénie de grades ≥ 3. Ces toxicités ont été globalement bien maîtrisées, même si 86 patients (22 %) ont dû arrêter définitivement le talazoparib en raison d’effets indésirables sévères.
Résultats de la cohorte 2
Les résultats définitifs de la SG et une mise à jour descriptive de la SSPr de la cohorte 2 ont également été présentés. Parmi les 399 patients porteurs d’une altération connue d’un gène du système HRR, on constatait également une amélioration significative de la SG en faveur de l’association (45,1 vs 31,1 mois) (HR = 0,622 ; IC 95 % : 0,475-0,814 ; p = 0,0005), avec un bénéfice d’autant plus important chez les patients avec une altération de BRCA1/2 (HR = 0,497 ; IC 95 % : 0,318-0,776 ; p = 0,0017). Les nouvelles données de SSPr confirment la supériorité de la combinaison pour retarder la progression tumorale (30,7 vs 12,3 mois) (HR = 0,468 ; IC 95 % : 0,359-0,612 ; p < 0,0001).
Enfin, le profil de tolérance est resté cohérent avec les résultats précédents, sans aucun nouveau signal en termes d’innocuité lors du suivi prolongé.
En pratique – L’étude TALAPRO-2 démontre que l’association talazoparib et enzalutamide permet d’obtenir pour la première fois une amélioration statistiquement significative et cliniquement pertinente de la SG, comparée à l’enzalutamide seul en traitement de 1re ligne pour le CPRCm, et ce, quel que soit le statut HRR. Doit-on considérer cette combinaison comme le nouveau standard thérapeutique en 1re ligne métastatique chez les patients atteints de CPRCm ? Si les données de TALAPRO-2 semblent conforter l’hypothèse d’une synergie entre les inhibiteurs de PARP et les HTNG déjà mise en évidence dans l’étude PROpel et plus récemment dans l’étude BRCAway, il ne faut pas occulter que les patients tirant le meilleur bénéfice de l’association restent ceux porteurs d’une mutation BRCA1/2 ou d’un statut HRR+. Il est donc primordial de continuer à screener nos malades. L’une des limitations majeures de cette étude réside dans l’évolution rapide du paysage thérapeutique au stade CPHSm, où il est désormais recommandé d’utiliser une HTNG en complément d’une déprivation androgénique, voire d’une chimiothérapie par docétaxel. On constate qu’un nombre restreint de malades a reçu au préalable un traitement par acétate d’abiratérone conduisant inévitablement à un facteur de confusion potentiel. TALAPRO-2 avec une méthodologie rigoureuse reste incontestablement positive permettant l’octroi récent d’une AMM et d’un remboursement en faveur de cette association chez les patients atteints de CPRCm, pour lesquels une chimiothérapie n’est pas cliniquement indiquée. L’étude augure de belles promesses au stade CPHSm, où les résultats de TALAPRO-3 seront particulièrement scrutés.
ENZA-p (actualisation) : [177Lu] Lu-PSMA-617 + enzalutamide versus enzalutamide seul dans le cancer de la prostate métastatique résistant à la castration à haut risque
Emmett L et al. Overall survival and quality of life with [177Lu] Lu-PSMA-617 plus enzalutamide versus enzalutamide alone in poor-risk, metastatic, castration-resistant prostate cancer in ENZA-p (ANZUP 1901). J Clin Oncol 2025 ; 43 : abstr. 17.
L’enzalutamide (étude PREVAIL) et le 177Lu-PSMA-617 (étude VISION) améliorent tous les deux la SG des patients atteints d’un CPRCm (5, 6). Le 177Lu-PSMA-617 (Pluvicto®) a également vu son attrait renforcé par les récents résultats, notamment dans l’étude PSMAfore à un stade plus précoce de la maladie, chez des patients naïfs de taxane et atteints d’un CPRCm et semble être une alternative intéressante à la chimiothérapie avec un profil de tolérance favorable (7). Les récepteurs des androgènes et du PSMA ont une relation intracellulaire étroite, et les données précliniques suggèrent une synergie en cas de ciblage simultané.
L’étude ENZA-p
C’est dans ce contexte que l’étude ENZA-p (ANZUP 1901) a évalué l’association de l’enzalutamide et du [177Lu] Lu-PSMA-617 chez des patients atteints d’un CPRCm.
Lors du congrès ESMO 2023, le Dr Louise Emmett avait présenté les premiers résultats de cet essai de phase II randomisé avec une amélioration significative de la SSP du PSA (médiane de 13 vs 7,8 mois ; HR = 0,43 ; IC 95 % : 0,29-0,63 ; p < 0,001) sur une première analyse intermédiaire, réalisée après un suivi médian de 20 mois. La SSPr favorisait également l’association (HR = 0,67 ; IC 95 % : 0,44-1,01) et les taux de réponse PSA50 % et PSA90 % étaient également améliorés (93 et 78 %, respectivement) par rapport au groupe enzalutamide seul (68 et 37 %, respectivement) (8). Les données de cette étude ont été actualisées lors de l’ASCO-GU, avec notamment les résultats en termes de SG et de qualité de vie.
Méthode
On rappelle que l’étude ENZA-p était un essai contrôlé randomisé de phase II, en ouvert, mené dans 15 centres australiens. Les participants étaient des hommes âgés de 18 ans ou plus, atteints d’un CPRC, n’ayant pas été traités auparavant par docétaxel (sauf au stade CPHS) ou inhibiteurs de la voie des récepteurs aux androgènes pour ce type de cancer. Ils devaient présenter une maladie positive au PET PSMA, ainsi qu’au moins deux facteurs de risque associés à une progression précoce sous enzalutamide (LDH ≥ LSN normale, PAL ≥ LSN, albumine < 35 g/l, maladie d’emblée métastatique au diagnostic, moins de 3 ans depuis le diagnostic initial, plus de cinq métastases osseuses, présence de métastases viscérales, temps de doublement du PSA < 84 jours ou traitement antérieur par abiratérone).
Les patients ont été randomisés (1:1) pour recevoir soit de l’enzalutamide seul (160 mg/jour), soit de l’enzalutamide associé à des doses adaptatives de [177Lu] Lu-PSMA-617 (7,5 GBq à J15 et J57, avec deux doses supplémentaires si la maladie PSMA+ persistait au moins sur un TEP intermédiaire au jour 92. L’analyse était stratifiée en fonction du site de l’étude, du volume de la maladie (> 20 ou ≤ 20 métastases), de l’utilisation ou non du docétaxel au stade CPHS et d’un traitement antérieur par abiratérone.
Les patients
Entre août 2020 et juillet 2022, 162 malades ont été randomisés (79 dans le groupe enzalutamide seul et 83 dans le groupe association. L’âge médian était de 71 ans. Au moment de l’analyse intermédiaire, le traitement était toujours en cours chez 48 patients, dont 16 dans le groupe enzalutamide seul et 32 dans le groupe combiné. Dans ce dernier, 81 % des patients ont reçu les quatre doses de [177Lu] Lu-PSMA-617 prévues.
Résultats
Survie globale
Après un suivi médian de 34 mois, 96 décès ont été enregistrés (53 décès dans le groupe enzalutamide seul et 43 décès dans le groupe combiné). On notait une amélioration significative de la SG avec une médiane de 34 mois avec le traitement combiné contre 26 mois (HR = 0,55 ; IC 95 % : 0,36-0,84 ; p = 0,005). À noter que 38 % des patients traités par enzalutamide seul ont reçu ultérieurement un traitement par 177Lu-PSMA-617 après la fin de l’étude.
Qualité de vie
L’évaluation de la qualité de vie (HRQL) a été réalisée toutes les 6 semaines grâce au questionnaire EORTC et poursuivie jusqu’à la progression radiologique avec une estimation de la survie sans détérioration définie par le temps écoulé entre la randomisation et le décès, la progression clinique, l’arrêt du traitement ou la détérioration ≥ 10 points de la fonction physique ou de la qualité de vie globale (OHQL). Parmi les 162 patients inclus, 154 d’entre eux (95 %) ont participé aux évaluations régulières de qualité de vie avec un taux de survie sans détérioration à 12 mois chez 40 % des patients sous l’association contre seulement 13 % (p < 0,001) ; 38 % des patients du groupe combiné ont conservé leurs capacités physiques contre 17 % dans le bras monothérapie (p < 0,001). On notait également une diminution plus importante de la douleur chez les malades ainsi qu’une fatigue moins prononcée dans le groupe combiné. Comme attendu, le taux de xérostomie était plus important chez les patients recevant le 177Lu-PSMA-617 (74 vs 57 % ; p = 0,04).
En pratique – Cette combinaison pourrait donc être une alternative intéressante au docétaxel avec un profil de tolérance favorable, notamment chez les patients les plus fragiles et dont la situation carcinologique ne relève pas d’une chimiothérapie. Reste à préciser la place de cette stratégie à l’ère des associations HTNG et PARPi.
Résistance à la castration : expansion de dose du mévrométostat
Schweizer MT et al. Mevrometostat (PF-06821497), an enhancer of zeste homolog 2 (EZH2) inhibitor, in combination with enzalutamide in patients with metastatic castration-resistant prostate cancer (mCRPC): A randomized dose-expansion study. J Clin Oncol 2025 ; 43 : abstr. LBA138.
La résistance aux inhibiteurs de la voie du récepteur aux androgènes (ARPI) dans CPRC peut être due au maintien du signal du récepteur aux androgènes (RA) par divers mécanismes (mutations, amplification, surexpression ou réarrangement du récepteur aux androgènes, présence d’un splicing variant…). L’EZH2 est impliqué dans la pathogenèse du cancer de la prostate et la résistance aux ARPI via plusieurs voies, avec notamment l’extinction de gènes suppresseurs de tumeurs, l’activation des facteurs de transcription du RA ou la promotion d’une transdifférenciation neuroendocrine. L’association des ARPI avec des thérapies ciblant des voies alternatives, y compris des modificateurs épigénétiques, comme EZH2, pourrait être une approche thérapeutique prometteuse pour surmonter la résistance aux ARPI. Dans ce contexte, le mévrométostat, une petite molécule inhibitrice puissante et sélective d’EZH2, a été évalué en combinaison avec l’enzalutamide dans une étude d’expansion de dose avec une activité prometteuse et un profil de tolérance gérable chez des patients atteints de CPRCm en progression et préalablement traités par abiratérone. Les résultats de la phase d’expansion à dose fixe de cette étude en ouvert et randomisée ont été présentés.
Méthode
Les patients inclus étaient atteints d’un CPRC en progression selon les critères définis par le Prostate Cancer Working Group 3 (PCWG3). Ils devaient avoir reçu un traitement antérieur par abiratérone et une ligne de chimiothérapie antérieure au maximum. Les participants ont été randomisés (1:1) en deux groupes avec :
• soit mévrométostat (1 250 mg deux fois par jour, administré à jeun) en association avec enzalutamide (160 mg/j)
• soit enzalutamide seul.
L’objectif principal de cette étude était d’évaluer la SSPr et la tolérance du traitement. Les critères secondaires étaient le TRO selon les critères RECIST 1.1, le taux de réduction du PSA ≥ 50 % (PSA50) et les données pharmacocinétiques du mévrométostat.
81 patients ont été inclus dans cette phase d’expansion (41 patients dans le groupe association et 40 patients dans le groupe enzalutamide seul).
Résultats
Survie sans progression radiologique
Avec un suivi médian de 9,6 mois, on notait une amélioration significative de la SSPr, avec une médiane de 14,3 mois dans le groupe combiné contre 6,2 mois (HR = 0,51 ; IC 90 % : 0,28-0,95). Le TRO était de 26,7 % chez les patients bénéficiant de l’association (quatre avec une réponse partielle) contre 14,3 %. Le taux de réduction du PSA ≥ 50 % (PSA50) était également plus important dans le bras combiné (34,1 vs 15,4 %).
Tolérance
Les données de tolérance étaient rassurantes avec des effets indésirables globalement gérables dans les deux bras notamment chez les patients recevant l’association (78 % de diarrhées et 58,6 % de dysgueusie tout grade). Concernant les effets indésirables de grades ≥ 3, 53,7 % des malades du groupe combiné ont présenté des effets indésirables sévères avec principalement des diarrhées, une neutropénie et un sepsis. Aucun décès lié au traitement n’a été observé.
Données pharmaceutiques
Les concentrations plasmatiques du mévrométostat ont été comparées entre deux modes d’administration (soit 1 250 mg à jeun, soit 875 mg avec une prise alimentaire). Les analyses ont montré des niveaux plasmatiques similaires entre ces deux modalités. Cette observation suggère que la dose de 875 mg administrée avec un repas pourrait offrir un meilleur profil de tolérance que la dose de 1 250 mg administrée à jeun, sans altérer l’efficacité du traitement.
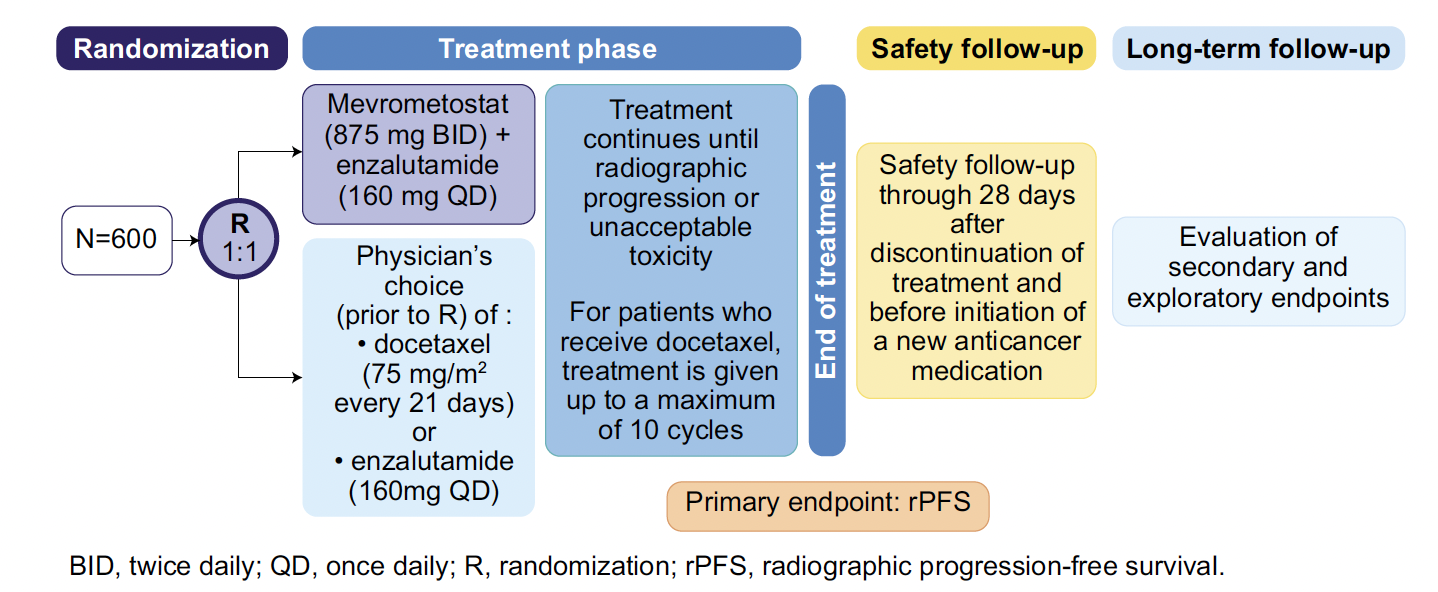
En pratique – Ces données soutiennent la faisabilité d’une phase III avec de plus larges effectifs en faveur de la combinaison, avec notamment l’étude MEVPRO-1 (mévrométostat et enzalutamide vs enzalutamide ou docétaxel) (Fig. 2).
Figure 2 – MEVPRO-1 : schéma de l’étude.
Carcinome urothélial localisé
NIAGARA : devenir des patients présentant un taux de réponse pathologique complète
Galsky MD, et al. Additional efficacy and safety outcomes and an exploratory analysis of the impact of pathological complete response (pCR) on long-term outcomes from NIAGARA. J Clin Oncol 2025 ; 43 : abstr. 659.
Récemment, une étude de phase III (NIAGARA) a montré pour la première fois qu’une immunothérapie pouvait significativement améliorer le devenir des patients dans le cadre d’une stratégie péri-opératoire
L’étude NIAGARA
Méthode
Dans cette étude randomisée (1:1), en ouvert et multicentrique, les patients inclus étaient atteints d’un CUIM (cT2-T4a N0/1 M0) et éligibles au cisplatine. Ils recevaient tous une chimiothérapie néoadjuvante par cisplatine et gemcitabine pour quatre cycles associée ou non au durvalumab (1 500 mg IV toutes les 3 semaines) suivie d’une intervention chirurgicale puis d’une immunothérapie adjuvante par durvalumab pour huit cycles s’ils étaient randomisés dans le bras expérimental.
Premiers résultats
On notait une amélioration significative de la survie sans événements (SSE) dans la population en intention de traiter (ITT) chez les patients bénéficiant d’une immunothérapie (HR = 0,68 ; IC 95 % : 0,56-0,82 ; p < 0,0001) avec une SSE à 2 ans de 67,8 % dans bras durvalumab (vs 59,8 %). Avec un suivi médian de 46,3 mois, l’analyse de SG était significativement améliorée chez les patients ayant reçu l’immunothérapie (HR = 0,75 ; IC 95 % : 0,59-0,93 ; p = 0,016) avec un taux de survie à 2 ans de 82,2 % dans le bras durvalumab contre 75,2 % (9). Au vu de ces résultats probants, ce traitement pourrait tout naturellement s’imposer comme un nouveau standard dans les prochains mois. Les données concernant le devenir des malades présentant un taux de pCR étaient manquantes, nous interrogeant sur l’effet réel de l’immunothérapie en situation adjuvante chez les patients particulièrement répondeurs au traitement au stade pré-opératoire.
On rappelle que les critères de jugement principaux étaient la SSE et le taux de pCR. La SG constituait un critère d’évaluation secondaire clé. La survie sans métastase (SSM) et la survie spécifique à la maladie étaient également des critères secondaires. Une analyse exploratoire post-hoc de la SSE et de la SG a été réalisée en comparant le devenir des patients ayant obtenu une pCR et ceux ne l’ayant pas obtenue (non-pCR). Les analyses ont été effectuées dans la population en ITT (données arrêtées en avril 2024). Au total, 1 063 patients ont été randomisés (533 dans le groupe durvalumab et 530 dans le groupe comparateur).
Résultats
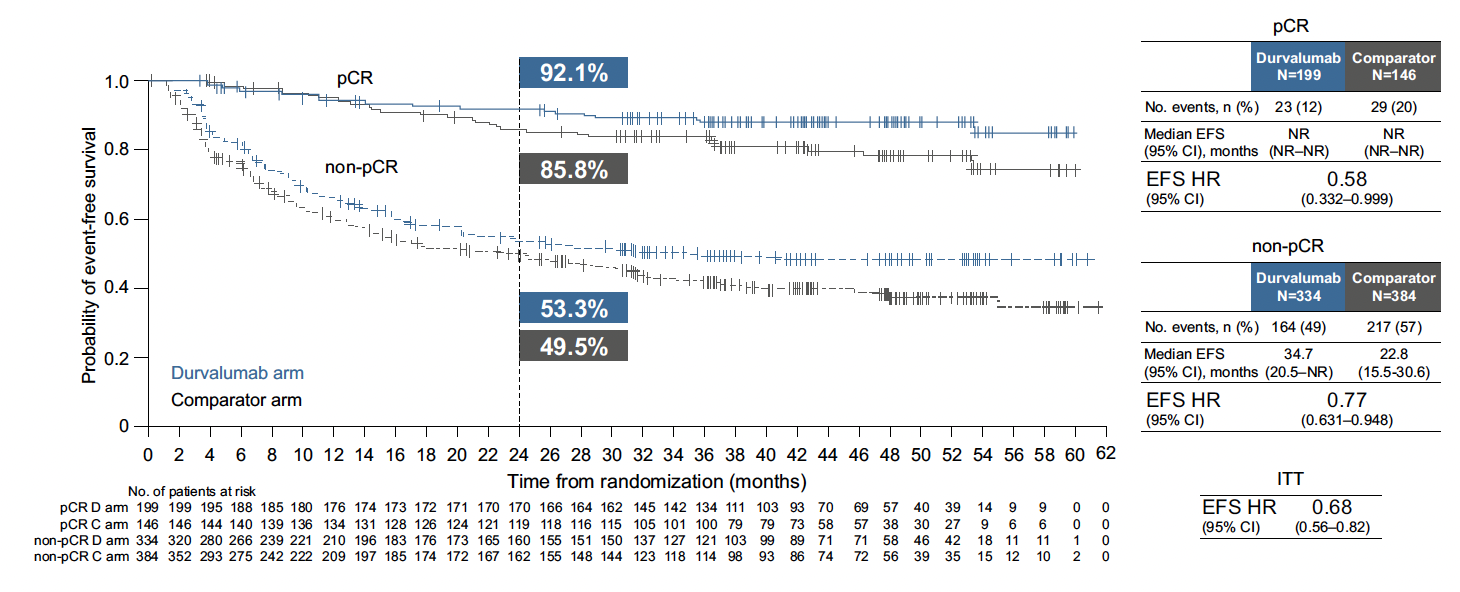
Les patients du bras immunothérapie ont présenté une réduction significative de 33 % du risque de développer des métastases à distance ou de décès (HR = 0,67 ; IC 95 % : 0,54-0,83 ; p nominal < 0,001) et une réduction significative de 31 % du risque de décès lié au cancer de la vessie (HR = 0,69 ; IC 95 % : 0,52-0,91 ; p nominal = 0,008) par rapport au groupe comparateur. Un plus grand nombre de malades du groupe durvalumab ont obtenu une pCR à la suite d’une chirurgie radicale (37 contre 28 %) (OR = 1,60 ; IC 95 % : 1,23-2,08 ; p = 0,0005). Comme on pouvait s’y attendre, les patients ayant obtenu une pCR bénéficiaient de meilleurs taux de SSE et de SG. Chez les malades sous immunothérapie, on notait un bénéfice supérieur, et ce, aussi bien chez les patients pCR (SSE : HR = 0,58 ; SG : HR = 0,72) que chez les non-pCR (SSE : HR = 0,77 ; SG : HR = 0,84) (Fig. 3).
Figure 3 – NIAGARA : données de survie sans événements en fonction de la réponse pathologique complète.
Tolérance
Des événements indésirables à médiation immunitaire (imAEs) ont été rapportés chez 111 des 530 patients (21 %) du groupe durvalumab (dont 3 % de grade 3/4) et chez 16 des 526 malades (3 %) du groupe comparateur (dont 0,2 % de grade 3/4). Les plus fréquents étaient essentiellement des dysthyroïdies avec des cas d’hypothyroïdie (10 vs 1 %) ou d’hyperthyroïdie (3 vs 0,8 %).
En pratique – L’administration péri-opératoire de durvalumab associée à une chimiothérapie néoadjuvante par cisplatine et gemcitabine chez les malades atteints d’un CUIM (cT2-T4a N0/1 M0) permet de réduire significativement le risque de métastases et de décès liés au cancer. Les analyses exploratoires post-hoc ont montré un bénéfice en termes de SSE et de SG aussi bien chez les patients avec une pCR que chez ceux ne l’ayant pas obtenu. L’amplitude du bénéfice en termes de taux de pCR, bien que significative, paraît limitée et finalement assez proche numériquement de celle observée dans l’étude VESPER chez les patients recevant une chimiothérapie (36 % de ypT0 sous cisplatine et gemcitabine et 47 % sous MVAC accéléré) (10). Le gain en SSE (8 %) et en SG à 2 ans (7 %) sous immunothérapie est également marginal en comparaison avec le bras comparateur qui n’est d’ailleurs pas notre standard thérapeutique en situation néoadjuvante. Le profil de tolérance sous durvalumab reste rassurant, sans nouveau signal en termes d’innocuité avec des imAEs principalement de faible gravité. Si ces résultats peuvent soutenir l’utilisation de cette immunothérapie en stratégie péri-opératoire comme nouveau traitement standard potentiel chez les patients atteints de CUIM, nous continuons néanmoins de nous interroger sur son effet réel en situation adjuvante. On attend également avec impatience les données d’autres associations avec enfortumab védotin et pembrolizumab chez les patients éligibles à une chimiothérapie néoadjuvante par cisplatine (EV304/ KEYNOTE-B15) ou non (EV303/KEYNOTE-905).
CheckMate 274 (actualisation) : nivolumab versus placebo en adjuvant
Milowsky M et al. Adjuvant nivolumab (NIVO) vs placebo (PBO) for high-risk muscle-invasive urothelial carcinoma (MIUC): Additional efficacy outcomes including overall survival (OS) in patients (pts) with muscle-invasive bladder cancer (MIBC) from CheckMate 274. J Clin Oncol 2025 ; 43 : abstr. 658.
L’étude CheckMate 274
Cette étude évaluait l’utilisation et la tolérance d’un traitement par nivolumab (240 mg toutes les
2 semaines pendant 1 an) en comparaison à un placebo, chez des patients atteints d’un carcinome urothélial récemment opéré, de stade ypT2-T4 ou yN+ après une chimiothérapie néoadjuvante ou de stade pT3-T4 ou N+, quand ils ne pouvaient recevoir un traitement au préalable (dans cette situation précise, les patients ne devaient pas être éligibles à une chimiothérapie adjuvante ou l’avaient refusée).
Premiers résultats
Avec un suivi médian de 36,1 mois, la médiane de survie sans maladie était de 22,0 mois avec nivolumab contre 10,9 mois chez les patients en ITT (HR = 0,71 ; IC 95 % : 0,58-0,86) et de 52,6 vs 8,4 mois chez les patients avec PD-L1 ≥ 1 % (HR = 0,52 ; IC 95 % : 0,37-0,72). Ce bénéfice a été observé dans la plupart des sous-groupes analysés, notamment âge, sexe, PS (ECOG) et statut ganglionnaire (11). Ces résultats probants ont permis une extension d’AMM en faveur d’une utilisation du nivolumab, renforcée récemment par les données également positives concernant la SG (diminution de 24 % du risque de décès dans la population en ITT) (12). Une actualisation de cette étude majeure a été présentée après un suivi médian de 36 mois.
Méthode
Les patients de l’étude CheckMate 274 ont été randomisés selon un rapport 1:1 pour recevoir soit du nivolumab (240 mg toutes les 2 semaines), soit un placebo pendant au maximum 1 an en traitement adjuvant. La randomisation était stratifiée en fonction de l’expression de PD-L1, du statut ganglionnaire et de l’administration antérieure d’une chimiothérapie néoadjuvante. Les critères d’évaluation principaux étaient la survie sans maladie dans les populations en ITT et avec une expression de PD-L1 ≥ 1 %. La SG était un critère secondaire dans ces mêmes populations. Les données de SG chez les patients atteints de CUIM proviennent d’analyses intermédiaires pré-planifiées pour les populations ITT et PD-L1 ≥ 1 %. Le suivi de la SG reste en cours, car les seuils statistiques prédéfinis pour la signification dans les populations ITT et PD-L1 ≥ 1 % n’avaient pas été atteints au moment de ces analyses.
Sur les 709 patients randomisés dans la population en ITT, 560 malades (79 %) présentaient un CUIM (279 dans le groupe nivolumab et 281 dans le groupe placebo), dont 284 (51 %) avaient reçu une chimiothérapie néoadjuvante à base de cisplatine.
Résultats
Avec un suivi médian de 36,1 mois dans la population en ITT, l’amélioration significative de la survie sans maladie en faveur d’un traitement par immuno-thérapie se maintient, tant chez tous les patients atteints de CUIM (HR = 0,63 ; IC 95 % : 0,51-0,78) que chez ceux ayant reçu une chimiothérapie préalable (HR = 0,58 ; IC 95 % : 0,43-0,79) ou n’en ayant pas reçu (HR = 0,69 ; IC 95 % : 0,50-0,94). Concernant les données de SG, on notait une diminution significative du risque de décès de 30 % en faveur du nivolumab chez les patients atteints de CUIM (HR = 0,70 ; IC 95 % : 0,55-0,90) et dans le sous-groupe de malades avec une expression tumorale de PD-L1 ≥ 1 % (HR = 0,48 ; IC 95 % : 0,29-0,77). Ce bénéfice était également observé chez les patients bénéficiant d’une chimiothérapie préalable (HR = 0,74 ; IC 95 % : 0,53-1,03) ou non (HR = 0,67 ; IC 95 % : 0,47-0,95). Le profil de tolérance restait cohérent avec les données précédentes observées dans la population ITT, sans identification de nouveaux signaux en termes d’innocuité.
En pratique – Ces résultats confirment clairement l’utilisation du nivolumab en situation adjuvante comme un nouveau standard thérapeutique chez les patients atteints d’un carcinome urothélial opéré à haut risque de récidive. Toutefois, à l’instar de la prise en charge adjuvante dans le carcinome rénal à cellules claires, les résultats concernant la place de l’immunothérapie en situation adjuvante restent contradictoires (Imvigor-010, AMBASSADOR). Au-delà d’un possible effet de classe, il est absolument indispensable d’identifier quels malades devront bénéficier réellement d’un traitement adjuvant.
RC48-C017 (actualisation) : disitamab védotin + toripalimab en péri-opératoire dans le carcinome urothélial infiltrant la vessie avec expression d’HER2
Sheng X et al. Neoadjuvant treatment with disitamab vedotin plus perioperative toripalimab in patients with muscle-invasive bladder cancer (MIBC) with HER2 expression: Updated efficacy and safety results from the phase II RC48-C017 trial. J Clin Oncol 2025 ; 43 : abstr. 665.
Le modèle de ciblage d’HER2 validé dans les cancers du sein semble à présent s’étendre à d’autres pathologies comme le cancer de la vessie métastatique. Il existe un pourcentage significatif de tumeurs urothéliales (10 à 20 %) présentant une surexpression d’HER2 ou une amplification d’HER2, également associées à un comportement biologique agressif et à un mauvais pronostic clinique. Récemment, le disitamab védotin (RC48-ADC) a montré des résultats impressionnants dans une étude de phase II (RC48-C005) incluant des patients atteints d’une carcinome urothélial HER2+ (IHC 3+ ou FISH+) avec TRO de 50,5 % et un taux de contrôle de la maladie (TCM) de 82,2%. Les médianes de SSP et de SG étaient de 5,9 et 14,8 mois chez des malades ayant reçu pour la plupart deux lignes thérapeutiques ou plus (13). Cet anticorps a été testé en association avec le toripalimab (anti-PD-1) avec des données très prometteuses (TRO à 71,8 %), notamment chez les malades porteurs d’une tumeur HER2+ et PD-L1+, suggérant un effet synergique des ADC et des inhibiteurs de checkpoints immunitaires. De nouvelles données ont été présentées, cette fois-ci au stade péri-opératoire chez les patients atteints d’une CUIM avec une expression d’HER2.
Méthode
Un essai de phase II (RC48-C017), à bras unique, a été mené afin d’évaluer l’efficacité et la tolérance d’un traitement néoadjuvant associant disitamab védotin (un anticorps monoclonal ciblant HER2, conjugué à la monométhyl auristatine) et toripalimab (un anti-PD-1) en péri-opératoire chez des patients atteints d’un CUIM (cT2-4a N0-1 M0) et exprimant HER2 (immunohistochimie [IHC] ≥ 1+ selon un test local) avec une indication de cystectomie radicale à visée curative associée à un curage ganglionnaire pelvien. Les malades inclus recevaient du disitamab védotin (2 mg/kg) et du toripalimab (3 mg/kg) toutes les 2 semaines pendant six cycles en phase néoadjuvante. Après la chirurgie, ils poursuivaient un traitement adjuvant par toripalimab (3 mg/kg toutes les 2 semaines) pour un maximum de 20 cycles. Le critère d’évaluation principal était le taux de pCR (ypT0N0) évalué par les investigateurs. Les critères secondaires comprenaient le taux de réponse pathologique downstaging (≤ ypT1N0M0), la SG et la tolérance.
Résultats
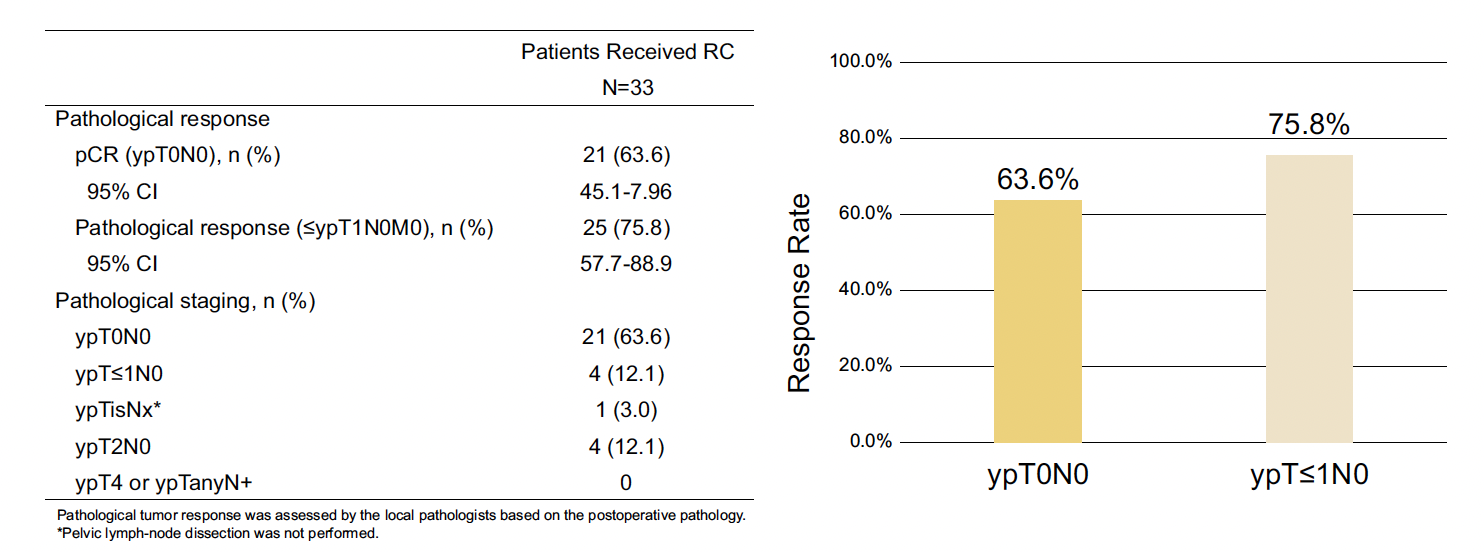
Les résultats d’efficacité et de sécurité de cette étude ont été actualisés avec également une analyse post-hoc de la SSE. Au cut-off, 47 patients ont été inclus et traités. Parmi eux, 68,1 % (n = 32) présentaient une expression HER2 low (n = 5 avec IHC1+ et n = 27 avec IHC2+) et 31,9 % (n = 15) une sur-expression d’HER2 (IHC3+). 83 % des patients étaient atteints d’une CUIM de stade T2-4N0M0 et 17 % de stade cT2-4aN1M0. Trente-trois (70,2 %) ont pu bénéficier d’une cystectomie radicale associée à un curage ganglionnaire pelvien. Le taux de pCR était de 63,6 % (IC 95 % : 45,1-79,6) et le taux de downstaging de 75,8 % (IC 95 % : 57,7-88,9) (Fig. 4). On notait un taux de pCR de 84,6 % chez les patients avec une surexpression d’HER2 (IHC 3+). Dans les sous-groupes stratifiés, le taux de pCR était de 77,8 % chez les patients avec un statut PD-L1+ et de 62,5 % chez ceux PD-L1-. Le taux de SSE à 1 an était de 89,5 % (IC 95 % : 69,8-96,7). Les données de SG restent immatures à ce stade. Le profil de tolérance était conforme avec les données précédemment présentées à l’ASCO 2024, sans apparition de nouveau signal de toxicité. Aucun événement indésirable n’a entraîné de retard dans la réalisation de la chirurgie.
Figure 4 – RC48-C017 : taux de réponse pathologique complète et de downstaging.
En pratique – Les données actualisées de l’étude RC48-C017 confirment l’efficacité prometteuse et la tolérance acceptable du traitement péri-opératoire associant disitamab védotin et toripalimab chez les patients atteints de CUIM et exprimant HER2. Le taux de pCR impressionnant dans cette population laisse peut-être espérer des stratégies de préservation vésicale chez des patients sélectionnés potentiellement fragiles, dans l’attente des données de SG. Ces résultats justifient pleinement des investigations complémentaires dans des essais randomisés de plus grande ampleur.
iNDUCT-GETUG V08 : durvalumab + sels de platine en néoadjuvant dans le carcinome urothélial des voies urinaires localisé à haut risque
Houede N et al. Safety and efficacy of neoadjuvant immunotherapy with durvalumab (MEDI 4736) in combination with neoadjuvant chemotherapy (gemcitabine/cisplatin or carboplatin) in patients with operable high-risk upper tract urothelial carcinoma. J Clin Oncol 2025 ; 43 : abstr. 661.
Une étude française (cocorico !) a évalué l’efficacité et la tolérance d’un traitement néoadjuvant associant une chimiothérapie à base de sel de platine et une immunothérapie (durvalumab) chez une petite cohorte de patients atteints d’un carcinome urothélial des voies supérieures (CUVS) à haut risque, répondant potentiellement à un besoin actuellement non couvert en onco-urologie.
Méthode
Cet essai clinique académique de phase II (iNDUCT-GETUG V08) a été mené dans 10 centres français. Les patients éligibles présentaient un CUVS non métastatique, de haut grade, identifié sur une biopsie tumorale par urétéroscopie ou cytologie urinaire, associée à un aspect infiltrant de la paroi du bassinet rénal/uretère observé par scanner. Les malades inclus recevaient un traitement par durvalumab associé à une chimiothérapie par cisplatine et gemcitabine (cohorte 1) ou par carboplatine et gemcitabine (cohorte 2) toutes les 3 semaines pour un total de quatre cycles, déterminée en fonction du débit de filtration glomérulaire, avant la réalisation d’une néphro-urétérectomie. L’objectif principal était d’évaluer le taux de pCR (ypT0) pour chaque combinaison thérapeutique.
Les patients
Au total, 50 patients ont été inclus entre 2021 et 2023, avec 30 dans la cohorte 1 et 19 dans la cohorte 2 (un malade a retiré son consentement). L’âge médian au diagnostic était de 66 ans et 58 % des patients étaient des hommes. 90 % (n = 44) ont pu bénéficier des quatre cycles de traitement. Cinq malades de la cohorte 1 ont dû recevoir du carboplatine en cours de traitement. Seulement trois patients n’ont pas pu être opérés (deux dans la cohorte 1 et un dans la 2).
Résultats
Après chirurgie, 19 malades de la cohorte 1 (63 %) présentaient une tumeur résiduelle non infiltrante (ypT0, ypTis/ypTa ou ypT1) contre neuf (42 %) de la cohorte 2. Le taux de pCR était de 13 % dans la cohorte 1 (n = 4) et de 5 % dans la cohorte 2 (n = 1). Aucun événement indésirable lié à l’immunothérapie n’a été observé. On notait essentiellement une toxicité médullaire imputable à la chimiothérapie (deux cas de neutropénie de grade 3, un de neutropénie de grade 4, un de thrombopénie de grade 3 et un d’anémie de grade 3).
En pratique – L’utilisation du durvalumab associé à une chimiothérapie à base de platine, en particulier le cisplatine, a montré une activité prometteuse chez les patients atteints d’un CUVS à haut risque avec quelques pCR et un taux élevé de tumeurs résiduelles non infiltrantes (downstaging). Le profil de tolérance était satisfaisant, sans augmentation du risque chirurgical. Une étude contrôlée randomisée de phase III (iNDUCT-3) comparant la chimiothérapie néoadjuvante seule ou associée à une immunothérapie chez des patients atteints d’un CUVS localisé à haut risque sera bientôt ouverte pour confirmer les résultats encourageants de cet essai porté par le GETUG.
Carcinome urothélial métastatique
EV-302 (actualisation à 2 ans) : enfortumab védotin et pembrolizumab dans le carcinome urothélial métastatique
Powles T et al. EV-302: Updated analysis from the phase 3 global study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/mUC). J Clin Oncol 2025 ; 43 : abstr. 664.
L’étude EV-302 a permis d’obtenir des résultats d’efficacité sans précédent en faveur d’une association enfortumab védotin et pembrolizumab en comparaison à une chimiothérapie à base de platine avec une amélioration significative de la SSP et de la SG dans une large population de patients atteints de carcinome urothélial métastatique (14). Cette combinaison est désormais notre standard thérapeutique en 1re ligne métastatique et bénéficie de l’octroi d’un accès précoce depuis quelques mois en France. Les données de cette phase III majeure ont été actualisées lors du congrès de l’ASCO-GU.
Méthode
Dans cette étude de phase III, les patients atteints d’un carcinome urothélial métastatique (n = 886) recevaient :
• soit un traitement par enfortumab védotin (jusqu’à progression ou toxicité) et pembrolizumab (pour une durée maximale de 2 ans),
• soit une chimiothérapie par cisplatine ou carboplatine et gemcitabine (avec six cycles au maximum).
Les données d’EV-302 ont été actualisées avec 12 mois de suivi supplémentaires, portant à plus de 2 ans le suivi médian de l’essai. Une analyse exploratoire a évalué l’efficacité et la tolérance du traitement chez les patients ayant obtenu une réponse complète confirmée (cCR). Au 8 août 2024, 886 patients avaient été randomisés (442 dans le bras expérimental et 444 dans le bras standard).
Résultats
Avec un suivi médian de 29,1 mois (IC 95 % : 28,5-29,9), les résultats restaient nettement en faveur de l’association dans la population en ITT, avec un bénéfice significatif en SSP (12,5 mois (10,4-16,6) vs 6,3 mois (6,2-6,5)) (HR = 0,48 ; IC 95 % : 0,41-0,57) et en SG (33,8 mois (26,1-39,3) vs 15,9 mois (13,6-18,3)) (HR = 0,51 ; IC 95 % : 0,43-0,61), indépendamment de l’éligibilité au cisplatine ou de la présence de métastases hépatiques. Le taux de cCR était de 67,5 % dans le bras association (dont 30,4 % de réponse complète) contre 44,2 % (14,5 % de réponse complète). La durée médiane de réponse était de 23,3 mois avec l’association (IC 95 % : 17,8-NE) contre 7,0 mois (IC 95 % : 6,2-9,0). La durée médiane de réponse complète n’a pas été atteinte dans le bras expérimental, tandis qu’elle était de 15,2 mois (IC 95 % : 10,3-NE) dans le bras chimiothérapie. Les taux de SSP et de SG à 2 ans étaient respectivement de 78,2 % (vs 53,7 %) et de 95,4 % (vs 85,8 %) chez les patients sous traitement expérimental ayant bénéficié d’une cCR. Les taux d’événements indésirables liés au traitement (TRAE) de grades ≥ 3 étaient de 57,3 % dans le bras association (252/440) contre 69,5 % dans le bras chimiothérapie (301/433). Aucun décès lié au traitement n’a été observé dans le sous-groupe des patients ayant obtenu une cCR.
En pratique – Les données de suivi prolongé confirment la durabilité de l’efficacité du traitement, sans nouveau signal défavorable en termes de tolérance. Ces résultats renforcent la position de cette combinaison en tant qu’incontestable standard thérapeutique en première ligne méta-statique. Les taux de SSP et de SG à 2 ans des malades bénéficiant d’une cCR suggèrent une possible désescalade thérapeutique chez les patients longs répondeurs et potentiellement fragiles.
Carcinome rénal à cellules claires
COSMIC-313 (résultats finaux) : cabozantinib nivolumab et ipilimumab en 1re ligne métastatique du carcinome rénal à cellules claires
Albiges L et al. Cabozantinib (C) in combination with nivolumab (N) and ipilimumab (I) in previously untreated advanced renal cell carcinoma (aRCC): Final results of COSMIC-313. J Clin Oncol 2025 ; 43 : abstr. 438.
Suite aux dernières avancées, la recherche a continué d’explorer de nouvelles approches pour renforcer la prise en charge des patients atteints d’un cancer du rein métastatique. L’étape semblant la plus pertinente était d’intensifier davantage le traitement pour encore améliorer le devenir des malades.
L’étude COSMIC-313
L’étude de phase III COSMIC-313 évaluait pour la première fois l’efficacité et la tolérance d’une combinaison de référence (nivolumab et ipilimumab) face à un triplet avec le cabozantinib chez les patients atteints d’un carcinome rénal à cellules claires (CRCC) de pronostic intermédiaire ou défavorable. En dépit d’une amélioration significative, mais encore immature de la SSP (HR = 0,73 ; IC 95 % : 0,57-0,94 ; p = 0,013), il n’existait qu’une augmentation marginale du TRO par rapport au traitement de référence avec un faible taux de réponse complète dans les deux bras (16). En l’absence des données matures de SG, il semblait difficile de prédire quelle place potentielle pouvait occuper cette combinaison de deux immunothérapies et d’un inhibiteur de tyrosine kinase dans le paysage thérapeutique du cancer du rein métastatique. Les dernières données de cette étude concernant notamment l’analyse finale de la SG ont été présentées par Laurence Albiges.
Méthode
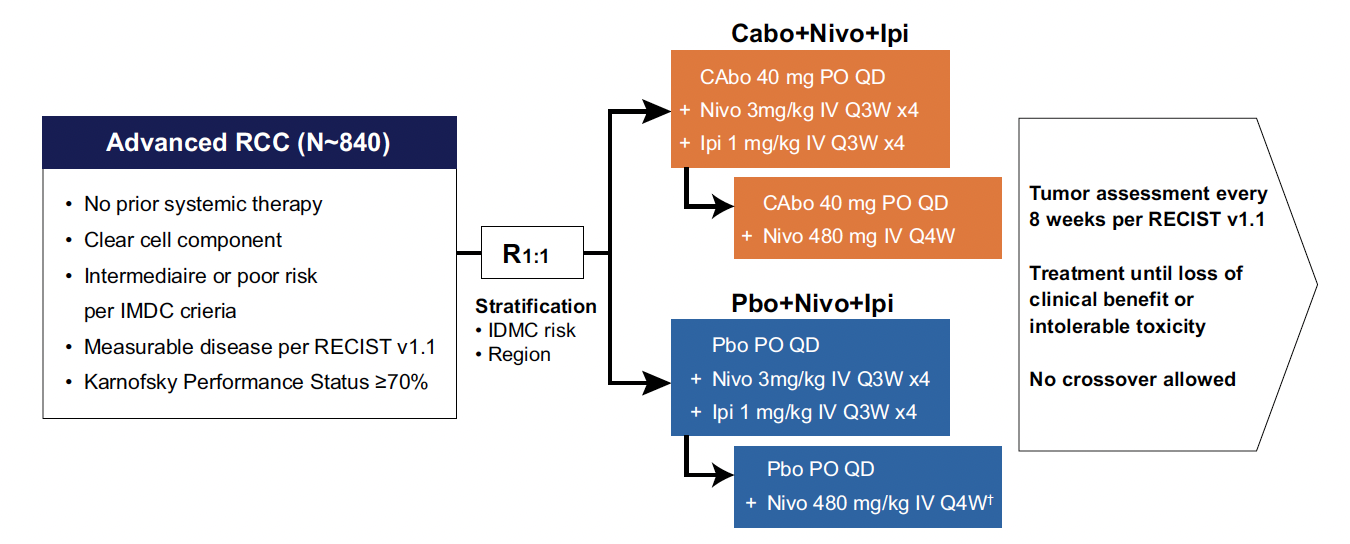
Les patients inclus dans COSMIC-313, atteints d’un carcinome rénal avancé à risque intermédiaire ou élevé selon l’IMDC et n’ayant jamais été traités, ont été randomisés pour recevoir soit du cabozantinib à 40 mg une fois par jour, soit un placebo. Tous les malades recevaient un traitement par immunothérapie (nivolumab 3 mg/kg IV et ipilimumab 1 mg/kg IV toutes les 3 semaines pendant quatre cycles suivis de nivolumab 480 mg IV toutes les 4 semaines jusqu’à 2 ans) (Fig. 5). Le critère de jugement principal était la SSP, évaluée par un comité indépendant en aveugle selon RECIST 1.1, chez les 550 premiers patients randomisés. La SG chez tous les patients randomisés était un critère secondaire. Une analyse exploratoire de biomarqueurs a été effectuée dans le but d’identifier des sous-ensembles immunitaires (à partir de données d’un séquençage ARN) éventuellement associés à une amélioration de la SG dans les deux bras. Au total, 855 patients ont été randomisés (428 dans le groupe cabozantinib, nivolumab et ipilimumab et 427 dans le groupe standard) ; 75 % étaient porteurs d’un cancer du rein avec un risque IMDC intermédiaire.
Figure 5 – COSMIC-313 : schéma de l’étude.
Résultats
Avec un suivi médian de 45,0 mois, le bénéfice significatif en SSP se maintenait en faveur du bras expérimental dans la population en ITT avec une médiane de SSP de 16,6 mois (14,0-22,6) vs 11,2 mois (9,3-14,0) (HR = 0,82 ; IC 95 % : 0,69-0,98), notamment dans le groupe IMDC intermédiaire (22,1 vs 11,3 mois ; HR = 0,76 ; IC 95 % : 0,62-0,93). Concernant la SG, aucune différence significative n’a été observée dans les deux bras, que ce soit dans la population en ITT (41,9 vs 42,0 mois ; HR = 1,02 ; IC 95 % : 0,85-1,23 ; p = 0,84) ou selon les groupes de risque IMDC. Le TRO était plus élevé avec le triplet (46 vs 37 %, dont 42 vs 33 % des patients avec une réponse partielle) et l’incidence de maladie progressive d’emblée plus faible (8 vs 20 %). Les TRAEs de grade 3/4 étaient de 75 % avec le cabozantinib contre 43 %, avec notamment une augmentation des transaminases supérieure à 20 %. Seulement 58 % des patients dans le bras expérimental ont pu recevoir les quatre cycles initiaux d’immunothérapie (vs 74 %) et 92 % ont dû recevoir un traitement avec une adaptation posologique (vs 76 %) en lien avec les TRAEs (avec 49 vs 26 % d’arrêt d’un des composants). L’analyse des biomarqueurs n’a pas permis d’identifier un sous-groupe d’intérêt, notamment concernant les niveaux initiaux de c-Met ou de PD-L1, même si une plus grande abondance de macrophages M2 était associée à une amélioration de la SG sous triplet (HR = 0,51 ; IC 95 % : 0,31-0,86). D’autres analyses exploratoires des signatures angiogéniques et immunitaires sont en cours.
En pratique – Avec ces données actualisées de l’étude COSMIC-313, l’utilisation d’un traitement associant cabozantinib, nivolumab et ipilimumab en situation de 1re ligne continue de bénéficier aux patients atteints de carcinome rénal avancé à risque intermédiaire ou élevé (SSP et TRO), les analyses de sous-groupes retrouvant un effet positif, mais limité, uniquement chez les malades à risque intermédiaire selon les critères IMDC. Quoi qu’il en soit, l’absence d’amélioration de la SG ne soutient clairement pas l’usage des triplets en situation de 1re ligne métastatique pour le moment, même si des essais sont en cours avec plusieurs associations intégrant d’autres immunothérapies (anti-LAG3, anti-TIGIT) ou certaines molécules innovantes comme les inhibiteurs de HIF-2α avec le belzutifan (LITESPARK-012).
CheckMate 9ER (actualisation > 5 ans) : nivolumab + cabozantinib versus sunitinib en
1re ligne métastatique du carcinome rénal à cellules claires
Motzer RJ et al. Nivolumab plus cabozantinib (N+C) vs sunitinib (S) for previously untreated advanced renal cell carcinoma (aRCC): Final follow-up results from the CheckMate 9ER trialJ Clin Oncol 2025 ; 43 : abstr. 439.
Lors du congrès de cette année, les données de l’étude CheckMate 9ER ont été actualisées avec un suivi à long terme (> 5 ans).
Méthode
On rappelle que les patients atteints de carcinome rénal avancé et inclus dans cette étude ont été randomisés en deux groupes avec :
• soit du nivolumab 240 mg toutes les
2 semaines associé au cabozantinib 40 mg une fois par jour (n = 323),
• soit du sunitinib 50 mg/jour (4 semaines sur 6 pour chaque cycle) (n = 328),
jusqu’à progression de la maladie ou toxicité inacceptable avec une durée maximale d’utilisation pour l’immunothérapie de 2 ans. Le critère principal était la SSP selon RECIST v1.1, évaluée par un comité indépendant en aveugle (BICR) et les critères secondaires étaient la SG, le TRO selon RECIST v1.1 (BICR) et la tolérance.
Résultats
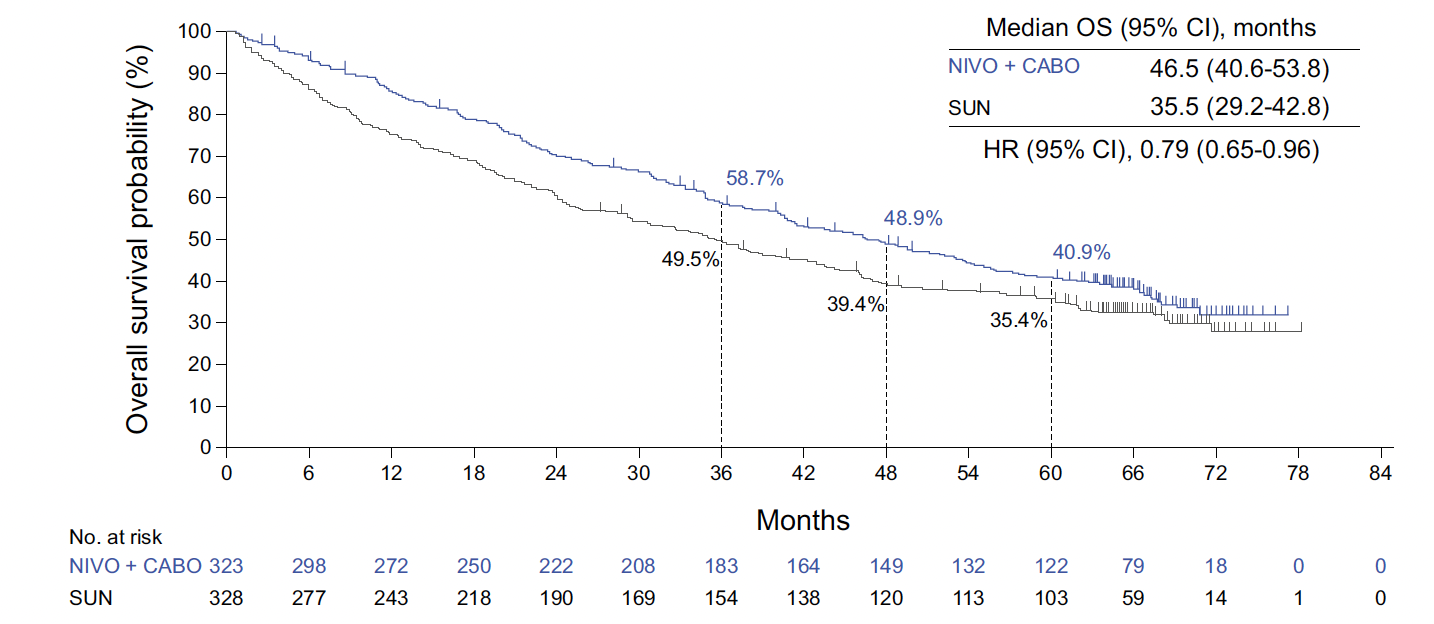
Avec un suivi de 67,6 mois, le bénéfice global en termes de SSP (16,4 vs 8,3 mois ; HR = 0,58 ; IC 95 % : 0,49-0,70) et en SG (46,5 vs 35,5 mois ; HR = 0,79 ; IC 95 % : 0,65-0,96) en faveur du traitement expérimental s’est maintenu dans la population en ITT (Fig. 6). Le taux de SSP et de SG à 60 mois étaient respectivement de 13,6 % (vs 3,6 %) et de 40,9 % (vs 35,4 %). Le TRO sous nivolumab et cabozantinib était de 55,7 % (vs 27,4 %) dont 13,9 % de réponse complète (vs 4,6 %) avec un taux de durée de réponse à 60 mois de 22,0 % (vs 10 %).
Figure 6 – CheckMate 9ER : données actualisées de survie globale en intention de traiter (ITT).
Il n’existait pas de nouveau signal défavorable en termes d’innocuité avec un taux d’effets indésirables liés au traitement de grades ≥ 3 de 67,8 % dans le bras expérimental vs 55,3 % dans le bras sunitinib. Aucun nouveau décès n’a été rapporté depuis la dernière mise à jour de la base de données.
En pratique – Ces résultats renforcent ce traitement comme standard de 1re ligne métastatique chez les patients atteints de CRCC. Si aucune comparaison directe n’est possible avec les autres combinaisons consensuelles, qui avaient toutes comme bras comparateur un traitement par anti-angiogénique, l’étude des différents objectifs principaux ou secondaires et les analyses en sous-groupe restent également instructives pour guider le prescripteur dans son choix thérapeutique. D’autres éléments, comme l’expérience du clinicien, le profil de toxicité de l’association et les facteurs liés à la maladie (sites métastatiques, caractéristiques histologiques, profil évolutif) et à ceux du patient, doivent également être pris en considération. La recherche de biomarqueurs prédictifs d’efficacité ou pronostiques pourrait également permettre de définir la stratégie thérapeutique la plus optimale. Un projet européen à grande échelle, CARE-1, visera à optimiser le traitement de 1re ligne des patients atteints d’un cancer du rein métastatique via la mise en œuvre d’un biomarqueur de routine (PD-L1).
Analyse post-hoc de CheckMate 214 : évaluation du taux plasmatique de KIM-1 comme biomarqueur pronostique et prédictif
Xu W et al. Evaluation of circulating kidney injury marker-1 (KIM-1) as a prognostic and predictive biomarker in advanced renal cell carcinoma (aRCC): Post-hoc analysis of CheckMate 214. J Clin Oncol 2025 ; 43 : abstr. 437.
Il semble désormais indispensable d’identifier un biomarqueur pertinent de routine pour éclairer la prise de décision thérapeutique du carcinome rénal, notamment en situation adjuvante. Ce raisonnement avait déjà fait l’objet d’une présentation lors du congrès de l’ASCO 2024 concernant l’utilisation d’un biomarqueur circulant (KIM-1) évaluée sur une analyse exploratoire et rétrospective de l’essai IMmotion010 qui semblait démontrer son intérêt pronostique et prédictif de réponse à une immunothérapie adjuvante. Une analyse post-hoc de CheckMate 214 vient étayer cette hypothèse, cette fois-ci au stade métastatique.
Méthode
L’essai CheckMate 214 a confirmé la supériorité d’une combinaison d’immunothérapie (nivolumab et ipilimumab) par rapport au sunitinib en situation de 1re ligne métastatique du CRCC, avec des résultats récemment consolidés après un suivi médian de 7,5 ans. Dans cette analyse post-hoc, des tests d’électrochimiluminescence évaluaient les taux KIM-1 sur les échantillons plasmatiques disponibles à l’inclusion et 3 semaines après la première dose d’immunothérapie ou un cycle de sunitinib (50 mg/jour, 4 semaines/6). Les données de 821 patients ont pu être analysées (soit 75 % de la population ITT de CheckMate 214).
Résultats
Il a été montré qu’un taux initial élevé de KIM-1 était associé à une SG plus courte, quel que soit le groupe de risque IMDC, le statut de néphrectomie ou la charge tumorale. L’avantage de l’association par rapport au sunitinib est observé dans tous les tertiles de KIM-1. Concernant l’effet de la variation de KIM-1 à 3 semaines (avant la 2e dose) chez les patients sous immunothérapie, on constatait qu’une diminution ≥ 30 % de KIM-1 après la 1re dose de traitement était fortement associée à une amélioration de la SSP (70,8 vs 4,2 mois si augmentation > 30 % de KIM-1), de la SG (85,4 vs 26,6 mois) et du TRO plus élevé (69,3 vs 13,9 %). Aucune association similaire n’a été observée chez les patients traités par sunitinib.
En pratique – KIM-1 pourrait potentiellement servir de biomarqueur précoce et non invasif pour le suivi de l’efficacité de l’immunothérapie chez les patients atteints de CRCC et permettre une adaptation rapide des stratégies thérapeutiques. Ces données devront être confirmées de manière prospective. Il sera aussi question de son accessibilité, sa reproductibilité et son coût.
KEYMAKER-U03 (03B) : combinaisons thérapeutiques dans le carcinome rénal à cellules claires avancé en progression après un inhibiteur de PD-(L)1 et VEGF-TKI
Albiges L et al. KEYMAKER-U03 Substudy 03B: Pembrolizumab (pembro) and targeted therapy combinations for advanced clear cell renal cell carcinoma (ccRCC). J Clin Oncol 2025 ; 43 : abstr. 440.
Les données randomisées pour soutenir la poursuite d’un inhibiteur de checkpoint immunitaire après l’échec d’un traitement de 1re intention avec une immunothérapie faisaient encore défaut jusqu’aux résultats de CONTACT-03. Il s’agissait de la première phase III randomisée évaluant l’efficacité et la tolérance d’un inhibiteur de PD-L1 chez des malades préalablement traités par immunothérapie. L’ajout d’atézolizumab au cabozantinib n’a pas montré de bénéfice clinique chez les patients atteints d’un carcinome rénal métastatique en progression après un traitement par inhibiteur de checkpoint (17). Les résultats d’une étude de phase III similaire (TiNivo-2), cette fois-ci avec le tivozanib et nivolumab (un anti-PD-1), confirmaient malheureusement l’échec d’un rechallenge d’une immunothérapie avec un inhibiteur de tyrosine chez les patients en progression. Reste la possibilité de nouvelles associations avec d’autres immunothérapies ou des thérapies innovantes comme les inhibiteurs de HIF-2α. Dans ce contexte, la sous-étude 03B de l’essai de phase I/II KEYMAKER-U03 a été conçue pour évaluer plusieurs combinaisons avec du pembrolizumab ou des agents expérimentaux chez des patients atteints de CRCC et préalablement traités par immunothérapie et un TKI ciblant VEGF.
Méthode
KEYMAKER-U03 (sous-étude-03B) évaluait plusieurs combinaisons thérapeutiques chez des patients atteints de CRCC avancé en progression après un traitement par inhibiteur de PD-(L)1 et VEGF-TKI. Ils étaient randomisés (1:1) dans plusieurs bras contenant des thérapies ciblées avec :
• le bras B4 comprenant pembrolizumab 400 mg IV toutes les 6 semaines et belzutifan (120 mg/j),
• le bras B5 comprenant lenvatinib (20 mg/j) et belzutifan,
• ou le bras de référence comprenant pembrolizumab et lenvatinib.
Les critères d’évaluation principaux étaient les données de sécurité et le TRO selon RECIST v1.1, évalué par un comité indépendant en aveugle (BICR). Parmi les critères secondaires, on notait la durée de réponse, le taux de contrôle de la maladie, la SSP et la SG.
Le plan d’inclusion comportait initialement 50 patients par bras, avec un arrêt prévu si le taux de SSP à 6 mois était ≤ 40 %. Au final, 62 et 64 malades ont été inclus respectivement dans les bras B4 et B5 contre 73 dans le bras de référence.
Résultats
Avec des suivis médians respectifs de 16,6 mois (B4), 17,6 mois (B5) et 19,4 mois (référence), le taux d’effets indésirables de grades 3 à 5 étaient de 64,5 % (40/62 patients), 77,8 % (49/64 patients) et 76,7 % (56/73 patients) respectivement. Plusieurs décès liés au traitement ont été recensés avec deux patients du bras B5 (hémorragie cérébrale, hémorragie intracrânienne) et un du bras de référence (perforation œsophagienne).
Concernant les données d’efficacité, on notait des taux de réponse objective de 19 % dans B4, 47 % dans B5 et 40 % dans le bras de référence. Le taux de bénéfice clinique était respectivement de 32 % (B4), 59 % (B5) et 58 % (référence) avec des durées médianes de réponse non atteintes sous pembrolizumab et belzutifan, 22,1 mois sous belzutifan et lenvatinib et 8,3 mois sous pembrolizumab et lenvatinib. Les médianes de SSP et de SG étaient respectivement de 5,4 mois (2,8-6,9), 12,5 mois (5,9-26,3) et 9,4 mois (6,9-11,2) et de 27,4 mois (12,6 mois-NR) et 32,3 mois (22,4-NR) (médiane de SG non atteinte dans le bras de référence). Les taux de SG à 12 mois étaient de 68 % (B4), 80 % (B5) et 82 % (référence).
En pratique – Ces résultats soutiennent clairement l’exploration approfondie de la combinaison lenvatinib et belzutifan chez les patients atteints de CRCC avancé, conformément à l’étude LITESPARK-011 (vs cabozantinib).
ARC-20 : expansion de dose du casdatifan en monothérapie chez des patients atteints d’un carcinome rénal à cellules claire métastatique prétraités
Choueiri TK et al. Casdatifan (Cas) monotherapy in patients (pts) with previously treated clear cell renal cell carcinoma (ccRCC): Safety, efficacy and subgroup analysis across multiple doses from ARC-20, a phase 1 open-label study J Clin Oncol 2025 ; 43 : abstr. 441.
Le belzutifan, un inhibiteur sélectif HIF-2α qui bloque l’hétéro-dimérisation de HIF-2α avec HIF-1β, stoppant l’activation des gènes impliqués dans la carcinogenèse, a fait l’objet de plusieurs présentations ces derniers mois (LITESPARK-005) et pourrait potentiellement enrichir notre arsenal thérapeutique. D’autres inhibiteurs de HIF-2α sont à l’étude avec les premières données préliminaires d’efficacité et de tolérance comme le DFF332, HS-10516, NKT2152 ou le casdatifan. Ce dernier a fait l’objet d’une présentation lors de la dernière journée du congrès de l’ASCO-GU, dans une étude de phase I (ARC-20).
Méthode
ARC-20 était une étude de phase I, ouverte, évaluant l’efficacité et la tolérance du casdatifan, un inhibiteur de HIF-2α, sous la forme d’une petite molécule administrée par voie orale, qui bloque efficacement la transcription des gènes dépendant de HIF-2α. Les patients inclus de ≥ 18 ans étaient atteints de CRCC, naïfs d’inhibiteurs de HIF-2α et préalablement traités par anti-PD-(L)1 et inhibiteurs de tyrosine kinase ciblant VEGFR. Les critères d’évaluation principaux étaient l’incidence des effets indésirables liés au traitement (TRAEs) et le TRO selon RECIST v1.1.
Après une phase d’escalade de dose permettant de s’assurer de l’innocuité du traitement, 93 patients ont été inclus dans une phase d’expansion de dose (33 à la dose de 50 mg 2 x/j, 31 à la dose de 50 mg/j et 29 à la dose de 100 mg 2 x/j). Le nombre médian de lignes de traitement antérieures étaient de 3 (1-7) dans une population homogène dans les trois cohortes.
Résultats
Concernant les données de tolérance, on notait un taux de TRAEs de grades ≥ 3 de l’ordre de 40 à 50 % selon des doses reçues, avec notamment un effet de classe bien identifié chez les inhibiteurs de HIF-2α comme une anémie (36 % tous bras, toutes doses) et une hypoxie. Aucun effet indésirable de grades ≥ 4 n’a été observé.
Avec des suivis médians respectifs de 15, 12 et 5 mois selon les cohortes, des réponses ont été observées dans tous les groupes de risque selon IMDC, quelle que soit la dose reçue, avec/sans traitement antérieur par inhibiteur mTOR (TRO de 25 % à 50 mg/j, 29 % à 50 mg 2 x/j et 33 % à 100 mg 2 x/j). On notait également des taux de contrôle de la maladie > 80 % dans les trois cohortes. Les résultats exploratoires d’efficacité (SSP et SG) et des analyses de biomarqueurs complémentaires (immunohistochimie de HIF-1α et HIF-2α, mutations VHL et gènes liés au carcinome rénal, signatures transcriptomiques prédictives) sont en attente.
En pratique – Ces données encourageantes soutiennent la faisabilité de phase III avec des effectifs de plus grande ampleur. Dans ce contexte, une étude de phase III (PEAK-1) évaluera prochainement l’efficacité et la tolérance de cet inhibiteur de HIF-2α à la dose retenue de 100 mg deux fois par jour associé au cabozantinib chez des malades préalablement traités par anti-PD-(L)1.
Carcinome rénal non à cellules claires
CALYSPO : survie globale et ADN tumoral circulant dans le carcinome rénal papillaire avancé avec dérégulation de la voie MET
Jackson-Spence F et al. Final overall survival and new ctDNA analysis in MET-driven advanced papillary renal cancer (CALYPSO) J Clin Oncol 2025 ; 43 : abstr. 444.
L’utilisation exponentielle des inhibiteurs de checkpoint en monothérapie ou combinaison chez les patients atteints de CRCC métastatique a naturellement incité à la recherche clinique concernant les autres entités tumorales rénales. Les données actualisées de KEYNOTE-B61 ont récemment confirmé le bénéfice de l’association pembrolizumab et lenvatinib avec une réponse tumorale significative dans tous les types de tumeurs (à un degré moindre pour le carcinome à cellules chromophobes), faisant de cette combinaison un standard thérapeutique de 1re ligne chez les patients atteints d’un CRNCC métastatique, en dépit d’études de larges effectifs qui restent difficiles à concevoir (18). À ce jour, l’utilisation de ces thérapies n’est pas clairement étayée par la biologie. L’inhibition du driver oncogénique MET est peut-être l’approche la plus logique dans ce cadre. L’ajout d’un anti-PD-L1 à un ITK ciblant MET est renforcé par les résultats prometteurs de plusieurs phases II, avec notamment l’étude CALYPSO qui retrouvait un TRO de 53 % en faveur du durvalumab et savolitinib (un inhibiteur multicible, dont MET) chez des patients atteints d’un carcinome papillaire métastatique. Les nouvelles données de cette phase II renforcent l’effet du bénéfice potentiel de l’association dans cette population spécifique.
Méthode
Les patients inclus dans CALYPSO étaient atteints de carcinome rénal papillaire avancé, qu’ils soient naïfs de traitement ou prétraités. Ils recevaient du durvalumab (1 500 mg IV toutes les 4 semaines) et du savolitinib (600 mg/j) jusqu’à progression de la maladie, toxicité inacceptable ou retrait du consentement. Les critères d’évaluation de l’efficacité comportaient le TRO selon RECIST 1 et les médianes de SSP et de SG. Une analyse de l’ADN tumoral circulant (ctDNA) a été effectuée par FoundationOne Tracker avec des prélèvements de plasma à l’inclusion et à différents temps du traitement.
Résultats
Avec un suivi médian de 41 mois, 41 malades ont été inclus dans la population en ITT avec un taux de réponse de 34 % (IC 95 % : 20-51) et des médianes respectives de SSP et de SG de 6,5 mois (IC 95 % : 2,7-11,9) et 18,3 mois (IC 95 % : 7,3-30,6). Chez les patients avec une dérégulation de la voie MET (n = 17), le taux de réponse passait à 59 % (IC 95 % : 33-82) avec des médianes de SSP et de SG de 13,9 mois (IC 95 % : 2,8-23,8) et 27,4 mois (IC 95 % : 9,2-34,7) respectivement. Il existait une différence significative en termes de SSP en fonction de (MET-driven vs Non-MET-driven) (13,9 vs 2,9 mois ; HR = 0,25 ; IC 95 % : 0,1-0,64), mais pas en termes de SG. Des analyses complémentaires en fonction de l’expression tumorale de PD-L1 et de la charge mutationnelle (TMB) ont été réalisées, ne retrouvant pas d’amélioration notable de l’efficacité clinique du traitement.
Suivi de l’ADN tumoral circulant
Concernant l’analyse exploratoire de ctDNA, 48 % des patients (10/21) étaient porteurs d’un ctDNA positif à l’inclusion (baseline) avec un effet négatif sur le taux de réponse (22 % de répondeurs seulement) et la SG (7,3 mois vs 33,3 mois chez les malades avec un ctDNA négatif, HR : 2,73 ; p = 0,02). La variation du ctDNA sous traitement était corrélée à la réponse clinique avec une SG significativement plus longue chez les malades avec disparition complète du ctDNA (clearance).
En pratique – Avec cette actualisation des résultats de CALYPSO, l’association durvalumab et savolitinib maintient une efficacité notable chez les patients atteints de carcinome rénal papillaire avancé avec une dérégulation de la voie MET, renforçant la justification de l’essai de phase III SAMETA, actuellement en cours.
L’auteur déclare avoir des liens avec BMS, Sanofi, Ipsen, Janssen, Pzifer, Bayer, Novartis, Eisai, MSD, Astellas, Merck et AstraZeneca.
Bibliographie
1. Rosenthal SA, Hu C, Sartor O et al. Effect of chemotherapy with docetaxel with androgen suppression and radiotherapy for localized high-risk prostate cancer: the randomized phase III NRG oncology RTOG 0521 trial. J Clin Oncol 2019 ; 37 : 1159-68.
2. Eastham JA, Heller G, Halabi S et al. Cancer and leukemia group B 90203 (Alliance): radical prostatectomy with or without neoadjuvant chemohormonal therapy in localized, high-risk prostate cancer. J Clin Oncol 2020 ; 38 : 3042-50.
3. Agarwal N, Azad AA, Carles J et al. Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial. Lancet 2023 ; 402 : 291-303.
4. Fizazi K, Azad AA, Matsubara N et al. First-line talazoparib with enzalutamide in HRR-deficient metastatic castration-resistant prostate cancer: the phase 3 TALAPRO-2 trial. Nat Med 2024 ; 30 : 257-64.
5. Beer TM, Armstrong AJ, Rathkopf DE et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014 ; 371 : 424-33.
6. Sartor O, de Bono J, Chi KN et al. Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021 ; 385 : 1091-103.
7. Morris MJ, Castellano D, Herrmann K et al. 177Lu-PSMA-617 versus a change of androgen receptor pathway inhibitor therapy for taxane-naive patients with progressive metastatic castration-resistant prostate cancer (PSMAfore): a phase 3, randomised, controlled trial. Lancet 2024 ; 404 : 1227-39.
8. Emmett L, Subramaniam S, Crumbaker M et al. [177Lu]Lu-PSMA-617 plus enzalutamide in patients with metastatic castration-resistant prostate cancer (ENZA-p): an open-label, multicentre, randomised, phase 2 trial. Lancet Oncol 2024 ; 25 : 563-71.
9. Powles T, Catto JWF, Galsky MD et al. Perioperative durvalumab with neoadjuvant chemotherapy in operable bladder cancer. N Engl J Med 2024 ; 391 : 1773-86.
10. Pfister C, Gravis G, Flechon A et al. Perioperative dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin in muscle-invasive bladder cancer (VESPER): survival endpoints at 5 years in an open-label, randomised, phase 3 study. Lancet Oncol 2024 ; 25 : 255-64.
11. Bajorin DF, Witjes JA, Gschwend JE et al. Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl J Med 2021 ; 384 : 2102-14.
12. Galsky MD, Witjes JA, Gschwend JE et al. Adjuvant nivolumab in high-risk muscle-invasive urothelial carcinoma: expanded efficacy from CheckMate 274. J Clin Oncol 2025 ; 43 : 15-21.
13. Sheng X, Wang L, He Z et alo. Efficacy and safety of disitamab vedotin in patients with human epidermal growth factor receptor 2-positive locally advanced or metastatic urothelial carcinoma: a combined analysis of two phase II clinical trials. J Clin Oncol 2024 ; 42 : 1391-402.
14. Powles T, Valderrama BP, Gupta S et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024 ; 390 : 875-88.
15. Loriot Y, Matsubara N, Park SH et al. Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023 ; 389 : 1961-71.
16. Choueiri TK, Powles T, Albiges L et al. COSMIC-313 investigators. cabozantinib plus nivolumab and ipilimumab in renal-cell carcinoma. N Engl J Med 2023 ; 388 : 1767-78.
17. Pal SK, Albiges L, Tomczak P et al. Atezolizumab plus cabozantinib versus cabozantinib monotherapy for patients with renal cell carcinoma after progression with previous immune checkpoint inhibitor treatment (CONTACT-03): a multicentre, randomised, open-label, phase 3 trial. Lancet 2023 ; 402 : 185-95.
18. Albiges L, Gurney H, Atduev V et al. Pembrolizumab plus lenvatinib as first-line therapy for advanced non-clear-cell renal cell carcinoma (KEYNOTE-B61): a single-arm, multicentre, phase 2 trial. Lancet Oncol 2023 ; 24 : 881-91.