L’essentiel en un clin d’œil
L’année 2024 débute à peine qu’il est déjà temps de bousculer ses acquis avec une riche actualité en onco-urologie lors du congrès de l’ASCO-GU !
Pas de scoop majeur dans le cancer de la prostate cette fois-ci, mais des éléments de réflexion et des pistes prometteuses notamment à un stade plus avancé de la maladie !
• Dans l’étude GETUG-AFU 18, l’intérêt d’une escalade de dose à 80 Gy en association à une hormonothérapie de longue durée semble être démontré chez les patients porteurs d’un cancer de la prostate localisé à haut risque et pourrait s’imposer prochainement comme un nouveau standard thérapeutique.
• Au stade métastatique, l’étude CONTACT-02 montre une amélioration significative sur son critère de jugement principal (SSP) en faveur d’un traitement associant cabozantinib et atézolizumab chez des patients atteints d’un cancer de la prostate métastatique résistant à la castration.
• BRCAAway démontre également une supériorité en survie sans progression en faveur de l’association acétate d’abiratérone (AA) et olaparib en comparaison à un traitement par inhibiteur de PARP en monothérapie.
Dans le carcinome urothélial,
• une nouvelle étude de phase III (AMBASSADOR) évalue l’apport potentiel d’une immunothérapie adjuvante (pembrolizumab) chez les patients atteints d’un carcinome urothélial récemment opéré à haut risque, avec une réduction significative du risque de récidive de la maladie.
• Le blockbuster de l’ESMO 2023 (EV-302) revient également avec des résultats d’efficacité sans précédent en faveur de l’association enfortumab védotin et pembrolizumab chez une large population de patients atteints de carcinome urothélial en 1re ligne métastatique, dans tous les sous-groupes prédéfinis.
Enfin, dans le cancer du rein,
• l’étude KEYNOTE-564 semble s’imposer comme un nouveau standard dans une population sélectionnée de patients atteints d’un carcinome rénal opéré et avec risque non négligeable de récidive, permettant pour la première fois d’obtenir un bénéfice significatif en survie globale sous immunothérapie.
• L’accent est mis également sur l’approche qualitative de la prise en charge de nos malades grâce à l’optimisation des modalités d’administration des thérapies avec le nivolumab en sous-cutané. Cette option paraît tout à fait envisageable à partir de la 2e ligne thérapeutique dans le carcinome rénal métastatique, permettant de garantir une efficacité optimale du traitement et d’améliorer le confort du patient, mais celui aussi des soignants en termes de durée d’hospitalisation et de charge médicale ou administrative.
Bonne lecture !
Cancer de la prostate
Cancer de la prostate localisé
Étude GETUG-AFU 18 (phase III)
Hennequin C et al. Long-term results of dose escalation (80 vs 70 Gy) combined with long-term androgen deprivation in high-risk prostate cancers: GETUG-AFU 18 randomized trial. ASCO-GU 2024 ; abst. LBA259.
Contexte – Le traitement par radiothérapie du cancer de la prostate (CP) localisé à haut risque, défini par la présence d’un ou plusieurs des facteurs pronostiques bien établis (PSA ≥ 20 ng/ml ; stade cT ≥ 3a ; Gleason ≥ 8 (4+4)/ISUP ≥ 4), repose sur l’association d’une déprivation androgénique par agoniste ou antagoniste de la LHRH et d’une irradiation prostatique et pelvienne. Si la réponse à la question de la durée optimale de la suppression androgénique a été apportée avec un bénéfice en faveur d’une hormonothérapie de longue durée (18 à 36 mois), il convenait de savoir si l’escalade de dose d’irradiation prostatique pouvait apporter un bénéfice aux patients. L’étude académique GETUG-AFU 18 a été conduite en ce sens.
L’étude – Cette étude randomisée (1:1) de phase III évaluait l’efficacité et la tolérance de deux doses d’irradiation prostatique (70 versus 80 Gy) en association à une hormonothérapie de 3 ans chez des patients porteurs d’un CP localisé à haut risque (présence d’au moins un facteur parmi PSA ≥ 20 ng/ml ; stade cT ≥ 3a ; Gleason ≥ 8 (4+4)/ISUP ≥ 4). Les malades devaient être tous cN0 ou pN0 sur l’imagerie conventionnelle ou sur l’analyse des ganglions lymphatiques avec une stratification en fonction d’un curage ganglionnaire pelvien, ces derniers ne recevant pas d’irradiation pelvienne. Les patients cN0 recevaient une irradiation de 46 Gy sur les aires ganglionnaires. Le critère de jugement principal de l’étude était la survie sans progression (SSP) clinique ou biologique et les critères secondaires comportaient la survie globale (SG), la toxicité aiguë et tardive et les données de qualité de vie rapportées par les patients.
Les patients – Entre juin 2009 et janvier 2013, 505 patients ont été inclus dans 25 centres français. Leur âge médian était de 70,6 ans et la valeur médiane de leur PSA était de 13,8 ng/ml. Les CP étaient de score ISUP ≥ 4 et de stade pT ≥ 3a chez respectivement 53,1 et 62,3 % des patients. 16,4 % avaient bénéficié d’un curage ganglionnaire. Les deux bras de traitement étaient plutôt homogènes notamment en termes de prévalence de ces facteurs pronostiques (29,2 % des patients présentaient au moins deux facteurs).
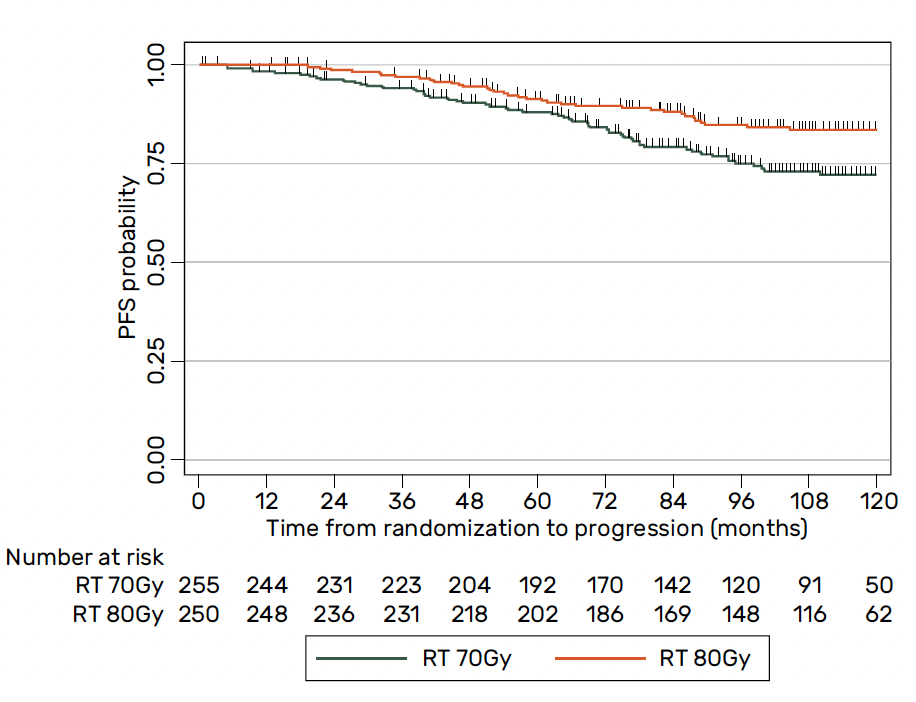
Résultats – Après un suivi médian de 9,5 ans et suite à la survenue de 92 événements (sur les 197 attendus), l’étude a démontré une amélioration significative en termes de SSP clinique ou biologique avec une réduction du risque de progression de 44 % (HR = 0,56 ; IC 95 % = 0,40-0,76 ; p = 0,0005 en faveur de la dose 80 Gy (Fig. 1). Les SSP clinique ou biologique à 5 et 10 ans étaient respectivement de 91,4 et 83,6 % dans le bras 80 Gy contre 88,1 et 72,2 % dans le bras 70 Gy. Il existait également un bénéfice significatif en survie spécifique (HR = 0,48 ; IC 95 % = 0,27-0,83 ; p = 0,0090) et en SG (HR = 0,61 ; IC 95 % = 0,44-0,85 ; p = 0,0039).
Figure 1 – GETUG-AFU 18 : données de survie sans progression clinique ou biologique.
Tolérance – Il n’existait pas de différence significative en termes de toxicité tardive avec respectivement 78,2 et 76,1 % de toxicité ≥ grade 2 avec la radiothérapie à dose augmentée et celle conventionnelle. La qualité de vie rapportée par les patients concernant la survenue potentielle de symptômes urinaires et intestinaux était également similaire.
En pratique – L’intérêt d’une escalade de dose à 80 Gy en association à une hormonothérapie de longue durée semble être démontré chez les patients porteurs d’un CP à haut risque. Les résultats de GETUG-AFU 18 pourraient donc s’imposer comme le nouveau standard thérapeutique chez ces malades. Comment extrapoler ces données en 2024 (GETUG-AFU 18 a été conçu il y a 20 ans) en sachant qu’il faut désormais tenir compte de la place indiscutable de l’adjonction d’un traitement de 2 ans par AA, suite aux résultats positifs de STAMPEDE en termes de survie sans métastases (SSM) chez les patients atteints d’un CP localisé à très haut risque (N+ ou N0 avec deux critères parmi un stade cT3 ou plus, un PSA ≥ 40 ng/ml et un score de Gleason ≥ 8) ? Dans GETUG-AFU 18, 144 patients présentaient au moins deux facteurs pronostiques, les rendant théoriquement éligibles à un traitement par hormonothérapie de nouvelle génération (HNG).
Étude EMBARK (phase III)
Shore ND C et al. Outcomes of men with high-risk biochemically recurrent prostate cancer who suspended enzalutamide monotherapy treatment in the phase 3 EMBARK study. ASCO-GU 2024 ; abst. 15.
Contexte – Entre 20 et 50 % des patients atteints d’un CP localisé présenteront une récidive biologique de la maladie caractérisée par une élévation du PSA, dans les 10 ans suivant un traitement curatif par prostatectomie radicale ou radiothérapie. Certains malades présentant un risque élevé de récidive biochimique encourent un excès de mortalité spécifique.
L’étude – Une récente étude randomisée de phase III (EMBARK) a évalué l’efficacité et la tolérance d’un traitement par enzalutamide en monothérapie ou en association à une suppression androgénique par leuprolide, en comparaison à un traitement par agoniste de LHRH, chez les patients atteints d’un CP préalablement traité et présentant une récidive biologique de très haut risque (temps de doublement du PSA ≤ 9 mois avec un taux de testostérone sérique d’au moins 150 ng/dl et un taux de PSA total ≥ 1 ng/ml après une prostatectomie radicale avec ou sans radiothérapie ou ≥ 2 ng/ml par rapport à une irradiation externe prostatique). L’arrêt du traitement était autorisé à la semaine 37, après une évaluation du marqueur tumoral à 36 semaines si les patients présentaient un taux de PSA < 0,2 g/ml. Dans le cas contraire, le traitement systémique était poursuivi. Le critère d’évaluation principal de cette étude était la SSM évaluée par une revue centrale indépendante en aveugle, dans le bras traitement combiné par rapport au bras standard leuprolide seul. Un critère d’évaluation secondaire clé était la SSM dans le bras enzalutamide en monothérapie par rapport au groupe leuprolide seul. Les autres critères d’évaluation secondaires étaient les données de SG, de qualité de vie rapportées par les patients et le profil de tolérance.
Résultats – Les premiers résultats présentés lors du congrès de l’AUA 2023 ont été publiés dans le NEJM (1). Après un suivi médian de 60,7 mois, on notait une amélioration significative de la SSM en faveur du traitement combiné (HR = 0,42 ; IC 95 % = 0,30-0,61 ; p < 0,001) et de l’enzalutamide en monothérapie en comparaison à un traitement par agoniste de la LHRH (HR = 0,63 ; IC 95 % ; 0,46-0,87 ; p = 0,005) avec une SSM à 5 ans de 87,3 % (IC 95 % = 83,0-90,6) dans le bras enzalutamide associé à leuprolide, 71,4 % (IC95 % = 65,7-76,3) dans le bras leuprolide seul et 80,0 % (IC 95 % = 75,0-84,1) dans le bras enzalutamide en monothérapie. Il existait également une tendance à l’amélioration significative de la SG en faveur de l’association sur une analyse intermédiaire.
Les données concernant le devenir des patients pour lesquels le traitement a pu être suspendu à la semaine 37 sur la base de la réponse biologique ont également été présentées lors du congrès de l’ASCO-GU de cette année. Elles concernaient 321 (91 %) patients dans le bras avec l’enzalutamide associé à l’agoniste de la LHRH et 240 (68 %) dans le bras leuprolide seul. Parmi les patients pour lesquels le traitement a été suspendu, on notait une amélioration significative de la SSM dans le bras combinaison en comparaison à une déprivation androgénique seule (HR = 0,47 ; IC 95 % = 0,31-0,72 ; p = 0,0003) avec un taux de SSM à 3 ans de 94,4 % en faveur du traitement combiné (versus 90 % dans le bras leuprolide seul). Deux ans après l’arrêt du traitement, 16,8 % (IC 95 % = 12,9-21,4) des malades recevant une association et 9,6 % (IC 95 = 6,2-14,0) des patients sous leuprolide seul présentaient toujours un taux de PSA indétectable (p = 0,0089). En revanche, aucune différence significative n’a été observée dans la population de patients pour lesquels le traitement n’a pas pu être arrêté, avec un taux de SSM à 3 ans de 76,2 % dans le groupe traitement combiné et 67 % dans le groupe leuprolide seul, la taille de l’échantillon de malades dans le bras de traitement combiné étant très restreinte (n = 9).
En pratique – Parmi les patients présentant une réponse biologique optimale et ayant pu interrompre leur traitement systémique, on constate le maintien d’un bénéfice en termes de SSM en faveur d’une association enzalutamide et leuprolide comparativement à une déprivation androgénique seule. Aucune différence significative n’a été observée dans la population de patients n’ayant pas suspendu leur thérapie. Il sera difficile de tirer des conclusions dans cette situation au vu du nombre limité de malades. Les patients ayant reçu un traitement combiné avant l’interruption de leur thérapie ont présenté une amélioration significative du taux de PSA indétectable à 2 ans par rapport à ceux qui avaient reçu du leuprolide seul. Ces données sur le devenir des patients en l’absence de traitement systémique sont rassurantes et permettront de limiter l’effet à moyen/long terme de leur thérapie sur le plan de la qualité de vie et d’éviter les complications potentielles d’une suspension androgénique prolongée.
Cancer de la prostate métastatique
Étude CONTACT-2 (phase III)
Agarwal N et al. CONTACT-2: Phase 3 study of cabozantinib (C) plus atezolizumab (A) vs second novel hormonal therapy (NHT) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). ASCO-GU 2024 ; abst. 18.
Contexte – À l’instar du carcinome rénal, la question d’un ciblage de plusieurs drivers oncogéniques comme MET et VEGFR2 directement impliqués dans le processus de cancérogenèse de certaines tumeurs s’est également posée avec le cabozantinib chez les patients atteints d’un CPm. Malgré les données prometteuses d’un essai de phase II, cet inhibiteur de tyrosine kinase n’a pas permis d’obtenir d’amélioration significative de la SG dans deux études randomisées de phase III, au décours d’un traitement par docétaxel, en comparaison à la prednisone (COMET-1) ou à une chimiothérapie par mitoxantrone (COMET-2). Le cabozantinib a également été évalué dans une récente étude multi-cohorte (COSMIC-021), cette fois-ci en association avec une immunothérapie (atézolizumab) chez des patients atteints d’un CPRCm (cohorte 6) et préalablement traités par au moins une HNG (2). Les résultats encourageants de cet essai (taux de réponse objective (TRO) de 23 %, taux de contrôle de la maladie (TCM) de 84 % et médiane de SSP de 5,5 mois) ont soutenu la faisabilité de l’étude CONTACT-02 présentée à l’ASCO-GU.
L’étude – Cet essai de phase III évaluait l’efficacité et la tolérance d’un traitement associant cabozantinib à 40 mg/j et atézolizumab 1 200 mg IV toutes les 3 semaines (n = 248) en comparaison à une HNG par AA ou enzalutamide (n = 253) chez les patients atteints d’un CPRCm en progression et préalablement traités par une HNG, l’utilisation d’un traitement préalable par docétaxel étant autorisée uniquement au stade cancer de prostate hormonosensible métastatique (CPHSm). Les caractéristiques des patients étaient homogènes dans les deux bras (23 % présentaient des métastases hépatiques, 23 % avaient préalablement été traités par docétaxel et 72 versus 74 % avaient reçu une HNG au stade CPRCm).
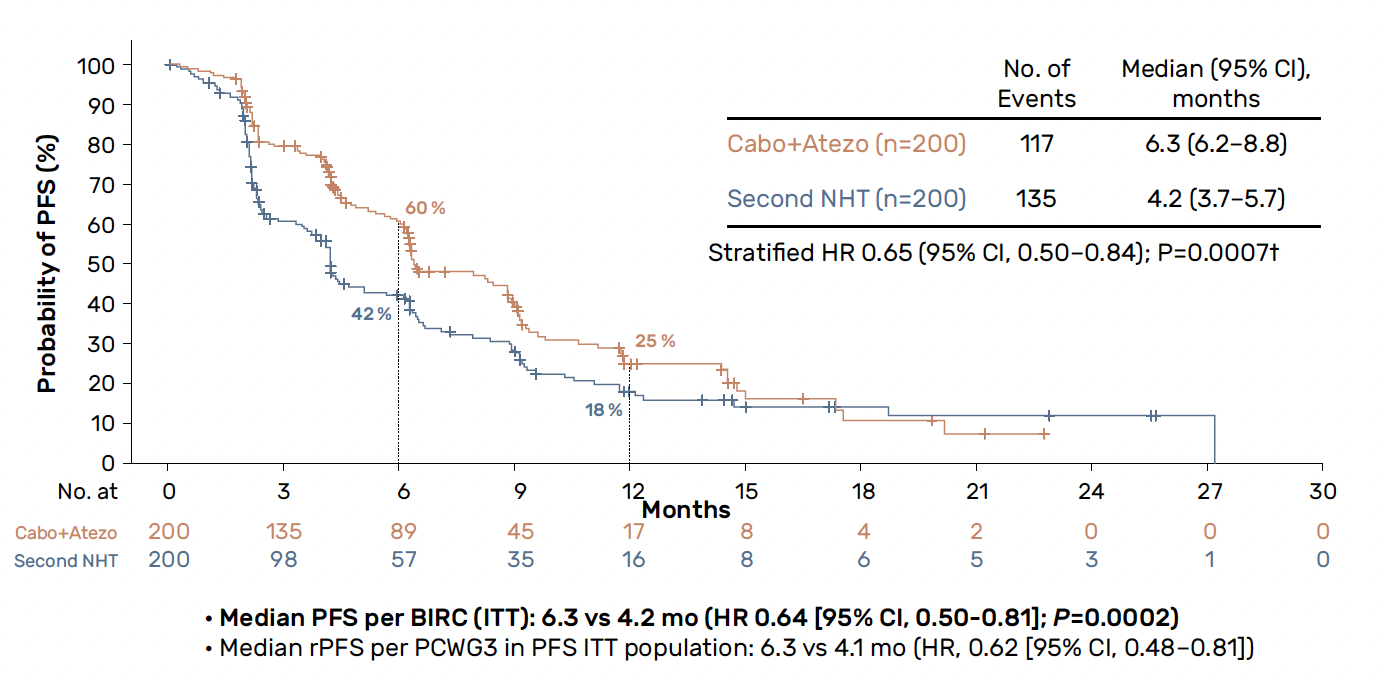
Résultats – Après une médiane de suivi de 12 mois, CONTACT-02 a montré un bénéfice significatif en faveur de l’association sur son critère de jugement principal (rSSP) dans la population en ITT (6,3 versus 4,2 mois ; HR = 0,65 ; IC 95 % = 0,50-0,84) (Fig. 2). La SSP était également améliorée en analyse de sous-groupe pour les malades présentant des métastases hépatiques (6,0 versus 2,1 mois ; HR = 0,47 ; IC 95 % = 0,30-0,74) ouosseuses (6,3 versus 4,1 mois ; HR = 0,67 ; IC 95 % = 0,50-0,88) et ayant reçu un traitement antérieur par docétaxel au stade CPRCm (8,8 versus 4,1 mois ; HR = 0,55 ; IC 95 % = 0,32-0,96). L’analyse intermédiaire concernant la SG (maturité à 49 %) montrait une tendance à l’amélioration non significative en faveur de l’association avec une médiane de 16,7 versus 14,6 mois dans le bras comparateur (HR = 0,79 ; IC 95 % = 0,58-1,07). Le TRO était également plus élevé dans le bras expérimental (14 versus 4 %), tout comme le TCM (72,2 versus 54,4 %).
Figure 2 – CONTACT-2 : données de survie sans progression.
En pratique – Il s’agit de la première étude de phase III montrant une amélioration significative sur son critère de jugement principal en faveur d’un traitement associant un inhibiteur de tyrosine kinase et une immunothérapie chez des patients atteints d’un CPRCm, préalablement traité par HNG, notamment dans une population avec une tumeur potentiellement agressive avec des métastases viscérales et pour laquelle il existe un besoin impérieux sur le plan thérapeutique. Cependant, l’amplitude de ce bénéfice paraît modérée et cela, d’autant plus lorsque que l’on connaît la faiblesse potentielle du bras comparateur après une progression sous HNG pour laquelle il est généralement proposé une chimiothérapie. On peut également s’interroger sur l’effet additif de l’atézolizumab dans cette association en l’absence de biomarqueurs pertinents, l’utilisation des inhibiteurs de checkpoints ayant déjà été évaluée dans plusieurs essais cliniques récents avec de larges effectifs, tous négatifs. Il aurait peut-être été pertinent d’inclure un bras complémentaire avec du cabozantinib en monothérapie.
Étude BRCAAway (phase II)
Maha H et al. BRCAAway: A randomized phase 2 trial of abiraterone, olaparib, or abiraterone + olaparib in patients with metastatic castration-resistant prostate cancer (mCRPC) bearing homologous recombination-repair mutations (HRRm). ASCO-GU 2024 ; abst. 19.
Contexte – La place des inhibiteurs de PARP en association avec une HNG se précise chez les patients atteints d’un CPRCm avec les récentes études TALAPRO2 (talazoparib et enzalutamide), MAGNITUDE (niraparib et AA) et surtout PROPel (olaparib et AA) dont l’analyse finale a montré qu’un traitement par AA et olaparib prolongeait la survie globale de plus de 7 mois par rapport à l’AA dans la population en ITT (3). Si l’efficacité des inhibiteurs de PARP chez les patients avec mutation BRCA1/2 a donc largement été démontrée en monothérapie (études PROfound et TRITON-3) ou en association avec une hormonothérapie ciblant le récepteur aux androgènes (ARPI), aucune étude n’a comparé un inhibiteur de PARP en monothérapie avec une association à une HNG.
L’étude – Dans ce contexte, l’étude BRCAAway s’est intéressée à l’efficacité et la tolérance d’un traitement de 1re ligne par olaparib associé à l’AA en comparaison à l’olaparib et à l’HNG en monothérapie chez les patients atteints d’un CPRCm et porteurs d’une mutation de BRCA1, BRCA2 ou ATM. Les données préliminaires avaient été présentées lors de l’ASCO 2022 et ont été actualisées lors de ce congrès.
Dans cet essai randomisé de phase II, les patients inclus étaient atteints d’un CPRCm, naïfs de traitement au stade de résistance à la castration et devaient être porteurs d’une mutation somatique ou germinale de BRCA1, BRCA2 ou ATM. Après randomisation (1:1:1), ils recevaient soit un traitement par AA en association à la prednisone (bras 1), soit de l’olaparib à 300 mg x 2/j (bras 2), soit une association des deux thérapies (bras 3). Dans le cas où les malades recevaient un traitement en monothérapie, un cross-over était autorisé à la progression. Le critère de jugement principal de l’étude était la SSP radiologique. Le TRO, la réponse biologique et la toxicité étaient des critères de jugement secondaires. Parmi 165 patients screenés et éligibles, 61 étaient porteurs d’une altération BRCA ou ATM (n = 3 pour BRCA1, n = 46 pour BRCA2, n = 11 pour ATM et un patient avait des altérations multiples).
Résultats – Après une médiane de suivi respective de 16, 15 et 23 mois, la rSSP était de 8,4 mois dans le bras AA, 14 mois dans le bras olaparib et 39 mois dans le bras AA + olaparib. Il existait une diminution significative du risque de progression de la maladie de 72 % chez les patients bénéficiant d’une association en comparaison à l’AA seul (HR = 0,28 ; IC 95 % = 0,13-0,67) et de 68 % en comparaison avec l’olaparib en monothérapie (HR = 0,32 ; IC 95 % = 0,14-0,75). Le taux de réponse biologique était grandement amélioré dans les bras AA et olaparib (95 versus 61 % et 67 % respectivement). Parmi les malades traités par olaparib et AA en monothérapie, huit patients ont pu bénéficier d’un cross-over à la progression dans chaque bras. Pour ces patients, la médiane de survie sans progression après le cross-over était similaire (8,3 et 7,2 mois respectivement) avec une médiane de SSP à partir de la randomisation de 16 mois. Au cut-off, les données de SG n’étaient pas encore matures (seulement cinq décès).
En pratique – Cette étude de phase II est la première à démontrer une supériorité en SSP en faveur de l’association AA et olaparib en comparaison à un traitement par inhibiteur de PARP en monothérapie chez des patients atteints d’un cancer CPRCm et porteurs d’une mutation de BRCA1/2 ou ATM. Ces résultats semblent conforter l’hypothèse d’une synergie entre les inhibiteurs de PARP et les HNG. De plus, même si le nombre de patients ayant bénéficié d’un cross-over reste faible (et que l’étude n’avait pas la puissance statistique suffisante pour la comparer), la médiane de SSP des séquences thérapeutiques AA puis olaparib et olaparib puis AA était plus courte (16 mois) que celle de l’association AA et olaparib (39 mois). Cette étude reste limitée par la faiblesse de l’effectif de patients dans chaque bras et a inclus 11 patients porteurs d’une mutation ATM, dont le bénéfice d’un traitement par inhibiteur de PARP n’est pas clairement démontré. De plus, on rappelle qu’il faudra tenir compte de l’absence d’utilisation d’une HNG en phase d’hormono-sensibilité comme dans l’étude PROpel, une situation désormais obsolète.
Cancer de la vessie
Carcinome urothélial localisé
Étude AMBASSADOR (phase III)
Apolo AB et al. AMBASSADOR Alliance A031501: Phase III randomized adjuvant study of pembrolizumab in muscle-invasive and locally advanced urothelial carcinoma (MIUC) vs observation. ASCO-GU 2024 ; abst. LBA531.
Contexte – Le concept d’une immunothérapie au décours d’une chirurgie radicale reste séduisant. Elle pourrait théoriquement offrir aux patients à haut risque de récidive une stratégie de rattrapage efficace et bien tolérée chez les malades n’ayant pas suffisamment répondu à une chimiothérapie néoadjuvante (présence de résidu tumoral, envahissement ganglionnaire…) ou n’ayant pas reçu de traitement avant l’intervention chirurgicale. Dans ce cadre, plusieurs études ont évalué la place d’une immunothérapie adjuvante. L’étude CheckMate-274 évaluait l’utilisation et la tolérance d’un traitement par nivolumab (240 mg toutes les 2 semaines pendant 1 an) en comparaison à un placebo, chez des patients atteints d’un carcinome urothélial (CU) récemment opéré, de stade ypT2-T4 ou yN+ après une chimiothérapie néoadjuvante ou de stade pT3-T4 ou N+, quand ils ne pouvaient recevoir un traitement au préalable (dans cette situation précise, les patients ne devaient pas être éligibles à une chimiothérapie adjuvante ou l’avaient refusée). Avec un suivi médian de 36,1 mois, la médiane de survie sans maladie était de 22,0 mois avec nivolumab contre 10,9 mois avec un placebo chez les patients en ITT (HR = 0,71 ; IC 95 % = 0,58-0,86) et de 52,6 mois avec nivolumab versus 8,4 mois avec placebo chez les patients avec PD-L1 ≥ 1 % (HR = 0,52 ; IC 95 % = 0,37-0,72). Ce bénéfice a été observé dans la plupart des sous-groupes analysés, notamment selon l’âge, le sexe, le PS-ECOG et le statut ganglionnaire. En revanche, les patients n’ayant pas eu de chimiothérapie néoadjuvante à base de cisplatine ne semblaient pas bénéficier du nivolumab (HR = 0,91 ; IC 95 % = 0,70-1,17), tout comme chez les malades avec une absence d’expression de PD-L1 (HR = 0,84 ; IC 95 % = 0,66-1,06). Ces résultats positifs ont été publiés dans le NEJM et ont permis un accès précoce et une récente extension d’AMM en faveur d’une utilisation du nivolumab, en dépit des données concernant la SG (4). Dans le même cadre, les premiers résultats d’une autre étude (AMBASSADOR), cette fois-ci avec le pembrolizumab, ont été présentés cette année.
L’étude – Il s’agissait d’une étude ouverte de phase III incluant 702 patients atteints d’un CU localisé ou localement avancé opéré (≥ ypT et/ou ypN+/marges positives après une chimiothérapie néoadjuvante ou ≥ pT3 et/ou pN+/marges positives chez les patients inéligibles à une chimiothérapie néoadjuvante par cisplatine ou l’ayant refusée). Les malades étaient randomisés (1:1) entre un bras recevant un traitement adjuvant par pembrolizumab 200 mg IV toutes les 3 semaines pendant 18 cycles au maximum et un bras surveillance simple. Les deux critères principaux d’évaluation étaient la survie sans maladie et la SG.
Les patients – Environ deux tiers avaient reçu un traitement néoadjuvant. Seuls 2,4 % ont été recrutés en raison de la présence de marges positives. Près de 60 % étaient porteurs d’une tumeur surexprimant PD-L1 (CPS ≥ 10 %). Environ 22 % étaient atteints d’un CU des voies excrétrices supérieures. 28 % traités par pembrolizumab et 35 % sous surveillance ont finalement retiré leur consentement. 27 % des patients qui devaient être surveillés ont finalement reçu une immunothérapie (5 % avant la survenue d’une récidive et 22 % après).
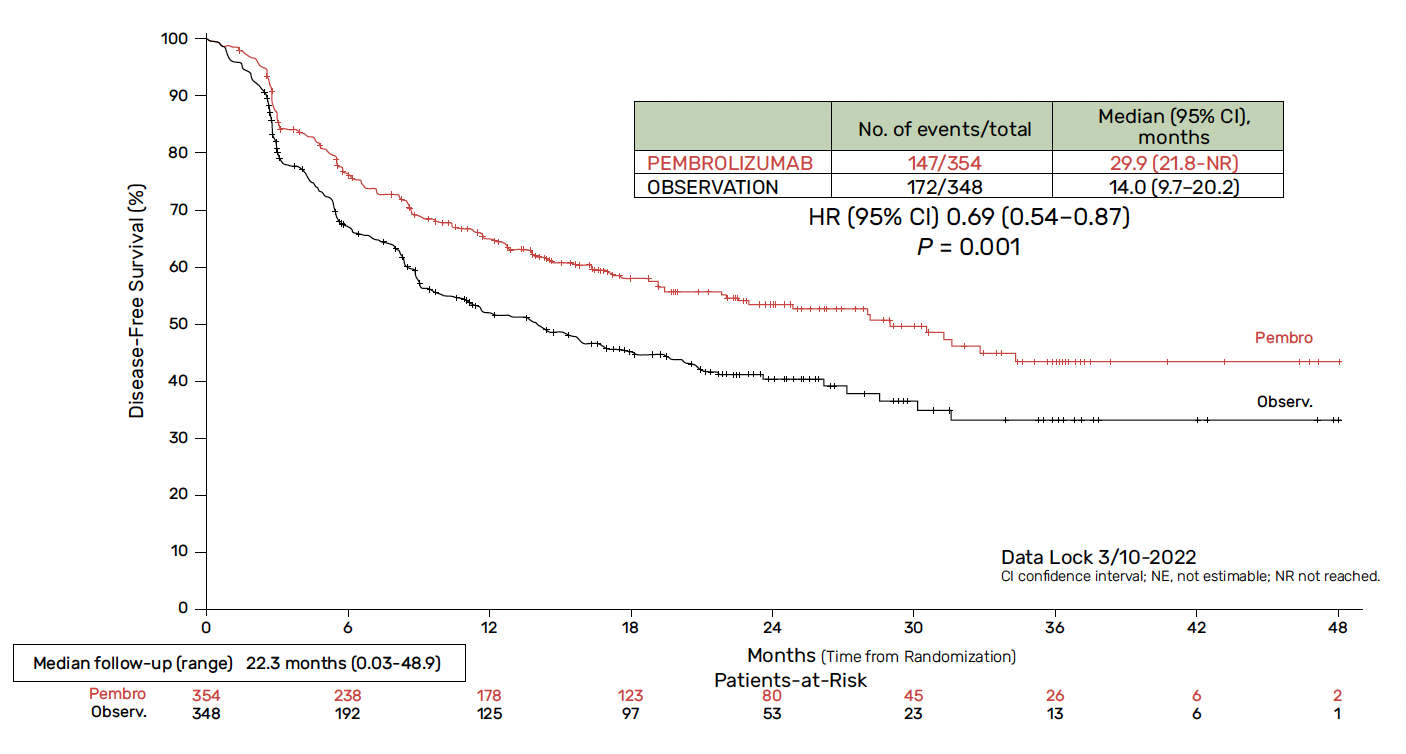
Résultats – Avec un suivi médian de 22,3 mois, l’utilisation d’un traitement adjuvant par pembrolizumab permettait une réduction significative du risque de récidive de 31 % (29 versus 14 mois ; HR = 0,69 ; IC 95 % = 0,54-0,87 ; p = 0,001) (Fig. 3). Cette amélioration de la survie sans maladie sous immunothérapie était observée quel que soit le statut PD-L1 (CPS ≥ 10 % versus CPS < 10 %) et dans la plupart des sous-groupes, à l’exception notable d’une tumeur des voies urinaires. Le statut PD-L1 semblait d’ailleurs pronostique (meilleure SSP sous pembrolizumab chez les patients avec PD-L1 avec CPS ≥ 10 %), mais non prédictif d’une réponse à l’immunothérapie. Avec un suivi médian de 36,9 mois, on notait une réduction non significative du risque de décès sous pembrolizumab (HR = 0,98 ; IC 95% = 0,76-1,26 ; p = 0,884). Là encore, la présence d’une tumeur surexprimant PD-L1 avec un score CPS ≥ 10 % n’était pas prédictive d’une meilleure réponse sous immunothérapie, mais semblait être un facteur pronostique avec une médiane de survie plus importante chez ces patients.
Figure 3 – AMBASSADOR : données de survie sans maladie en ITT.
Tolérance – Il n’existait pas de nouveau signal défavorable en termes de tolérance chez les patients sous pembrolizumab avec la survenue d’effets indésirables de grade ≥ 3 chez respectivement 48,4 et 31,8 % des malades traités ou surveillés.
En pratique – Trois études de phase III ont désormais évalué l’apport potentiel d’une immunothérapie adjuvante chez les patients atteints d’un CU récemment opéré à haut risque de récidive. Si l’étude Imvigor-10 (avec l’atézolizumab) n’a pas permis de diminuer significativement le risque de récidive de la maladie, les deux autres études sont positives sur leur critère de jugement principal. Dans l’étude CheckMate 274, l’amplitude du bénéfice en SSP chez les patients avec une tumeur exprimant PD-L1 ≥ 1 % (score TPS) a conduit les autorités européennes à restreindre l’AMM uniquement chez ces patients. Dans l’étude AMBASSADOR, le bénéfice en survie sans maladie est observé quel que soit le statut PD-L1 (score CPS), qui semble même être un facteur pronostique. Il n’est bien évidemment pas possible d’effectuer de comparaison directe entre ces deux études majeures. AMBASSADOR souffre néanmoins d’un problème méthodologique pouvant potentiellement réduire l’effet du pembrolizumab. En effet, le bras contrôle est une surveillance simple (et non un placebo), ce qui peut en partie expliquer le retrait de consentement chez un peu plus d’un tiers des patients inclus. De plus, le cross-over potentiel vers une immunothérapie dans cette population risque de réduire l’effet d’un traitement adjuvant en ITT en termes de SG. À l’instar de la prise en charge adjuvante dans le carcinome rénal à cellules claires, les résultats concernant la place de l’immunothérapie en situation adjuvante sont donc contradictoires. Au-delà d’un possible effet de classe (anti-PD-1 > anti-PD-L1), il est absolument indispensable d’identifier quels patients devront bénéficier réellement d’un traitement adjuvant.
Carcinome urothélial métastatique
Étude EV-302 (phase III)
Van Der Heijden MS et al. Enfortumab vedotin (EV) in combination with pembrolizumab (P) versus chemotherapy in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC): Subgroup analyses results from EV-302, a phase 3 global study. ASCO-GU 2024 ; abst. LBA530.
Contexte – L’année 2023 aura réellement été passionnante en onco-urologie avec la présentation de plusieurs études majeures qui viendront probablement changer nos pratiques dans les prochaines semaines, notamment dans le cancer de la vessie métastatique. Parmi elles, la très attendue EV-302 évaluant l’efficacité et la tolérance de l’enfortumab associé au pembrolizumab en situation de 1re ligne métastatique, en comparaison à un standard thérapeutique depuis plus de 30 ans par sels de platine et gemcitabine, avec des résultats présentés lors du dernier congrès de l’ESMO au-delà de nos espérances et accueillis d’une standing ovation !
L’étude – Dans cette étude de phase III, les patients atteints d’un CUm (n = 886) recevaient soit un traitement par enfortumab védotin (jusqu’à progression ou toxicité) et pembrolizumab (pour une durée maximale de 2 ans), soit une chimiothérapie par cisplatine ou carboplatine et gemcitabine (avec six cycles au maximum). Après une médiane de suivi de 17,2 mois, les premières données étaient spectaculairement en faveur de la combinaison (n = 442) devant une diminution de 55 % du risque de progression de la maladie avec une médiane de SSP de 12,5 versus 6,3 mois (HR = 0,45 ; IC 95 % = 0,38-0,54 ; p < 0,00001), une SG quasiment doublée avec une médiane de 31,5 versus 16,1 mois (HR = 0,47 ; IC 95 % = 0,38-0,58 ; p < 0,00001) et des TRO de 67,7 % (dont 29 % de réponse complète !) versus 44,4 % (p < 0,00001) (5). Cette année, des données complémentaires d’efficacité sur des analyses en sous-groupes ont été présentées. Dans cette étude, les caractéristiques des patients étaient homogènes et correspondaient au profil attendu avec 54 % de patients éligibles au cisplatine, 72 % de métastases viscérales et 58 % de tumeurs avec une surexpression de PD-L1 (CPS ≥ 10).
Résultats – Lors des analyses en sous-groupes, le bénéfice en SSP restait très en faveur de l’utilisation d’un traitement par enfortumab védotin et pembrolizumab, quels que soient l’éligibilité au cisplatine (éligible ou inéligible) et le statut PD-L1 (élevé ou faible), avec une diminution du risque de progression entre 50 et 60 % selon les groupes. Sur une analyse stratifiée en fonction des sites métastatiques, la combinaison surpassait systématiquement la chimiothérapie, indépendamment de la présence ou l’absence de métastases hépatiques et de la présence de métastases viscérales ou ganglionnaires uniquement. Un bénéfice significatif a également été observé quels que soient l’âge du patient, la race, la région géographique, le sexe, le performans status (OMS), la tumeur primitive (voies excrétrices supérieures ou inférieures) et la fonction rénale. Concernant la SG, des résultats similaires ont été systématiquement observés en faveur de l’association. Le TRO était très significativement amélioré (> 60 %) dans tous les sous-groupes évaluables.
En pratique – L’étude EV-302 a permis d’obtenir des résultats d’efficacité sans précédent en faveur d’une association enfortumab védotin et pembrolizumab en comparaison à une chimiothérapie à base de platine avec une amélioration significative de la SSP et de la SG, chez une large population de patients atteints de CUm. L’ampleur du bénéfice observé avec cette combinaison restait similaire dans tous les sous-groupes prédéfinis. Nous sommes désormais dans l’attente d’une réaction rapide de nos autorités compétentes dans l’optique d’une AMM, voire d’un accès précoce, permettant de proposer cette avancée majeure à nos malades qu’il conviendra de manier avec précaution.
Étude PemCab (phase II)
Jain RK et al. Cabozantinib plus pembrolizumab as first-line therapy for cisplatinineligible advanced urothelial carcinoma (PemCab). ASCO-GU 2024 ; abst. 539.
Contexte – À l’instar du cancer de la prostate dans l’étude COSMIC-021, le cabozantinib associé à l’atézolizumab a également été évalué dans le CUm chez les patients éligibles au cisplatine (cohorte 4) ou non (cohorte 3) avec une médiane SG de l’ordre de 13-14 mois et des TRO de 20 à 30 % (6). Une autre étude (PemCab) évaluant le cabozantinib associé cette fois au pembrolizumab a été présentée lors du congrès.
L’étude – Dans cet essai de phase II, les patients atteints d’un CUm et non éligibles à une chimiothérapie à base de cisplatine (ou la refusant) recevaient un traitement de 1re ligne par cabozantinib à la dose de 40 mg par jour associé au pembrolizumab 200 mg IV toutes les 3 semaines. Le critère de jugement principal était le TRO évalué selon RECIST avec la nécessité d’obtenir une réponse chez 17 patients au minimum (sur 35 évaluables) pour obtenir le seuil de significativité statistique. Les critères secondaires étaient les données de SG, de SSP, de durée de réponse objective, de TCM ou de tolérance. Au total, 36 patients ont été inclus, dont 23 (77,8 %) présentant des métastases viscérales, huit (22,2 %) porteurs d’une tumeur avec un score CPS ≥ 10 et 25 (69,4 %) avec une altération de la fonction rénale (clairance ≥ 30 et < 60 ml/mn).
Résultats – Cette étude est finalement revenue négative sur son critère d’évaluation principal puisque l’on notait une réponse objective chez seulement 16 patients (45,7 dont 14,2 % de réponse complète), soit en dessous du seuil de significativité statistique avec une durée de réponse objective de 14,7 mois. Le TCM était de 71,4 %. Après un suivi médian de 14,3 mois, les médianes de SSP et de SG étaient respectivement de 7,6 mois (IC 95 % = 5,3-12,6) et de 17,1 mois (IC 95 % =12,6-NR).
En pratique – Dans une population restreinte de patients non éligibles à une chimiothérapie de 1re ligne à base de cisplatine, l’utilisation du cabozantinib combiné au pembrolizumab est associée à une efficacité modeste en termes de SSP (7,6 mois) et de SG (17,1 mois) mais également à un TRO n’atteignant pas le seuil de significativité statistique. PemCab s’ajoute donc à une récente étude de phase III avec un effectif plus large (LEAP-011), également négative, cette fois-ci avec le lenvatinib et le pembrolizumab. Le cabozantinib est actuellement évalué dans une autre étude, en situation de maintenance avec l’avélumab chez les patients répondeurs au décours d’une chimiothérapie à base de sels de platine (MainCav).
Étude UNITE
Nizam A et al. Outcomes in patients (pts) with advanced urothelial carcinoma (aUC) treated with enfortumab vedotin (EV) after switch maintenance avelumab (MAv) in the UNITE study. ASCO-GU 2024 ; abst. 537.
Contexte – Suite aux résultats positifs de l’étude de phase III EV-301, évaluant l’utilisation de l’enfortumab védotin en comparaison avec une chimiothérapie conventionnelle (paclitaxel, docétaxel ou vinflunine) chez les patients atteints d’un CUm et préalablement traités par une chimiothérapie à base de sels de platine et une immunothérapie (anti-PD-1/PD-L1), nous disposons désormais d’une nouvelle arme thérapeutique en situation de 3e ligne métastatique avec cet anticorps conjugué à un cytotoxique (7). Dans l’intervalle, l’avélumab, un anticorps anti-PD-L1, s’est également positionné comme stratégie de maintenance thérapeutique chez les patients atteints d’un CUm en réponse après un traitement de 1re ligne à base de sels de platine grâce aux données récentes de l’étude JAVELIN Bladder 100 qui montraient un bénéfice significatif en SG et en SSP en faveur de cette immunothérapie (8). Les données d’efficacité de l’enfortumab au décours d’un traitement de maintenance par avélumab sont manquantes, les patients inclus dans l’étude EV-301 n’ayant pas reçu cette thérapie. Une étude rétro-spective multicentrique (UNITE) a été conduite pour analyser le devenir des patients traités par enfortumab au décours d’un traitement de maintenance par avélumab et vérifier la conformité des résultats obtenus par l’étude EV-301, dans une situation de “vraie-vie”.
L’étude – UNITE est une étude de cohorte rétrospective multicentrique portant sur 633 malades atteints d’un CUm sur 16 sites américains. Les données sur les résultats de l’enfortumab védotin dans des sous-groupes de patients d’intérêt ont été publiées en 2021. Les patients ayant reçu une chimiothérapie à base de sels de platine suivie d’une thérapie d’entretien par avélumab, puis d’un traitement par enfortumab védotin ont été inclus. Le taux de réponse observé par l’investigateur a été étudié pour les patients évaluables ayant reçu au moins un cycle d’enfortumab védotin. Les données de SSP et de SG après la mise en place de l’anticorps conjugué à un cytotoxique ont été recueillies. Parmi 633 patients, 49 ont reçu un traitement séquentiel avec une chimiothérapie à base de sels de platine, de l’avélumab en maintenance puis de l’enfortumab védotin. Concernant le traitement reçu en 1re ligne, 67 % des patients ont bénéficié d’une chimiothérapie à base de cisplatine, 26 % à base de carboplatine et 6 % à la fois à base de cisplatine et de carboplatine.
Résultats – À l’issue de cette thérapie, on notait 12 % de réponse complète, 59 % de réponse partielle et 29 % de maladie stabilisée. Le délai médian entre le début du traitement à base de platine et la mise en place de l’enfortumab védotin était de 8,5 mois (IC 95 % = 3,9-21,2). Après un suivi médian de 8,5 mois (IC 95 % = 6,7-15,0), le TRO sous anticorps conjugué à un cytotoxique était de 54 % (dont 51 % de réponse partielle). La SSP médiane depuis le début du traitement par enfortumab védotin était de 7,0 mois (IC 95 % = 5,8-13,3 mois) et la SG médiane était de 13,3 mois (IC 95 % = 10,8-NR). La médiane de SSP mesurée depuis le début d’une chimiothérapie à base de platine jusqu’à la progression ou le décès après la mise en place de l’enfortumab védotin était de 17,5 mois (IC 95 % = 15,2-22,5) et la SG médiane de 22,5 mois (IC 95 % = 18,6-NR).
En pratique – Dans cette petite cohorte rétrospective, le devenir des patients atteints d’un CU avancé traités par enfortumab védotin au décours d’une stratégie de maintenance par avélumab était conforme aux résultats observés de l’étude EV-301 (SSP et SG de 5,5 et 12,9 mois). Ces données confortent l’utilisation de l’enfortumab védotin comme traitement de 3e ligne après une progression sous avélumab, mais devront être validées sur des effectifs plus larges.
Cancer du rein
Cancer du rein localisé
Études KEYNOTE-564 et CheckMate 914 (phase III)
Choueiri TK et al. Overall survival results from the phase 3 KEYNOTE-564 study of adjuvant pembrolizumab versus placebo for the treatment of clear cell renal cell carcinoma (ccRCC). ASCO-GU 2024 ; abst. LBA359.
Motzer RJ et al. Adjuvant nivolumab monotherapy vs placebo for localized renal cell carcinoma at high risk of relapse after nephrectomy: Results from Part B of the randomized, phase 3 CheckMate 914 trial. ASCO-GU 2024 ; abst. LBA358.
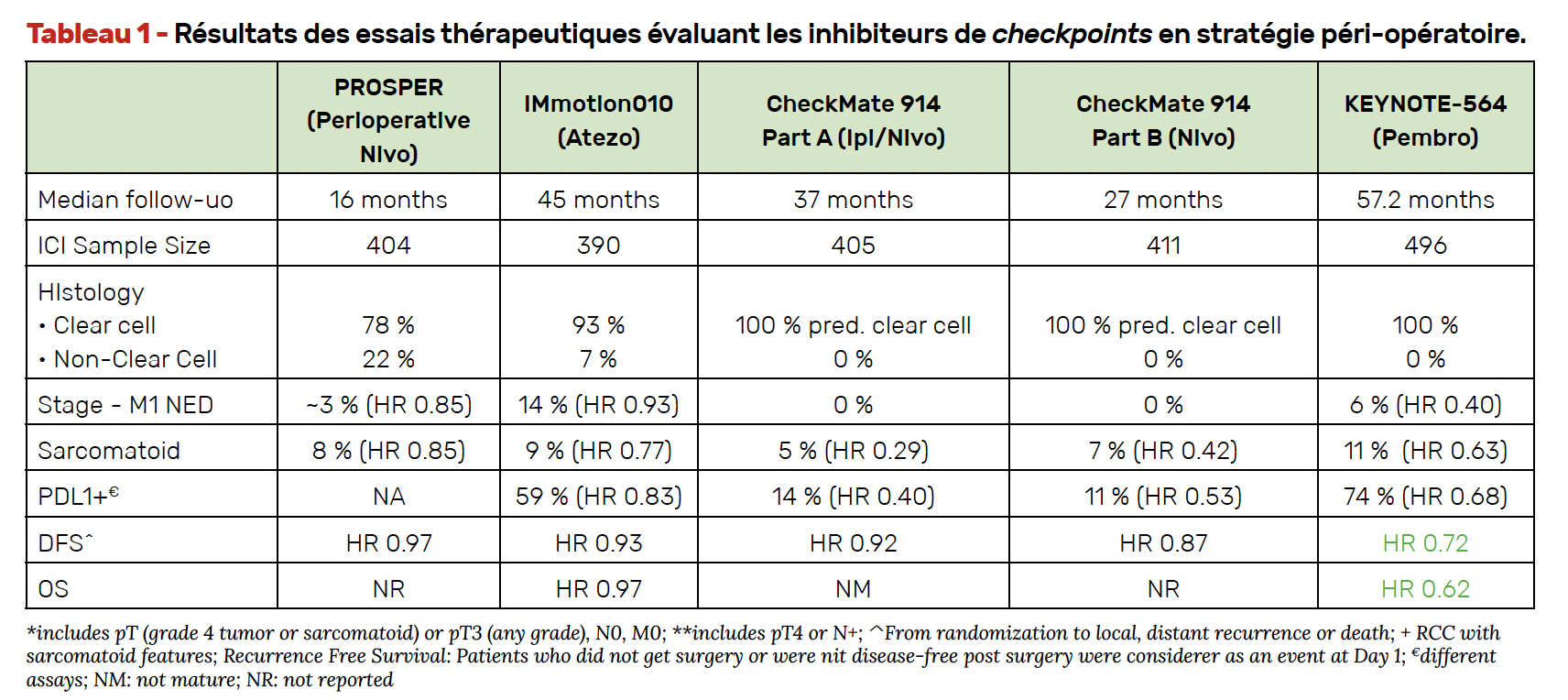
Contexte – Les inhibiteurs de tyrosine kinase et immunothérapies ont considérablement révolution-né la prise en charge du cancer du rein (CR) métastatique. Pour autant, il existe toujours un besoin non satisfait en situation adjuvante pour réduire efficacement le risque de récidive après une chirurgie radicale (30 % de récidive métastatique tous stades et tous types confondus) et augmenter le taux de guérison. Ces dernières années, beaucoup d’études de phase III ont évalué l’utilisation des inhibiteurs de tyrosine kinase avec des résultats peu probants chez les patients atteints d’un carcinome rénal à cellules claires (CRCC) à haut risque de récidive après une chirurgie. Seule l’étude S-TRAC avec le sunitinib a montré un signal positif en survie sans maladie, mais sans bénéfice en SG et avec un risque non négligeable de toxicité.
Plus récemment, l’étude KEYNOTE-564, avec le pembrolizumab utilisé pendant 1 an en situation adjuvante, a permis d’obtenir un bénéfice significatif en SSR avec un profil de tolérance beaucoup plus acceptable dans ce cadre. Les données à 30 mois publiées à l’ASCO-GU 2022 ont consolidé ce gain en survie sans maladie (HR = 0,63 ; IC 95 % = 0,50-0,80 ; p < 0,0001) et permis l’octroi d’un accès précoce depuis quelques semaines (9). D’autres études évaluant l’utilisation d’autres immunothérapies dans la prise en charge péri-opératoire du CR ont alimenté les discussions lors des derniers congrès internationaux, avec des résultats malheureusement négatifs sur leur critère de jugement principal (survie sans maladie) en contradiction avec l’étude KEYNOTE-564 dont les données actualisées de SG ont enfin été présentées.
L’étude KEYNOTE-564 – Les patients inclus étaient atteints d’un CRCC récemment opéré avec un risque de récidive intermédiaire (tumeurs pT2 grade 4 ou sarcomatoïde, N0 et tumeurs pT3, tous grades, N0) ou élevé (tumeurs pT4, tous grades, N0 et tumeurs pN+). Les malades avec oligo-métastases pouvaient être inclus à la condition que les lésions secondaires soient réséquées dans le même temps opératoire que la tumeur primitive (M1 NED). Après randomisation (1:1), ils recevaient soit du pembrolizumab 200 mg IV (n = 496), soit un placebo (n = 498) toutes les 3 semaines pendant ≥ 17 cycles (environ 1 an) ou jusqu’à la récidive de la maladie, une toxicité inacceptable ou un retrait du consentement. Les caractéristiques des 994 patients inclus étaient homogènes dans les deux bras.
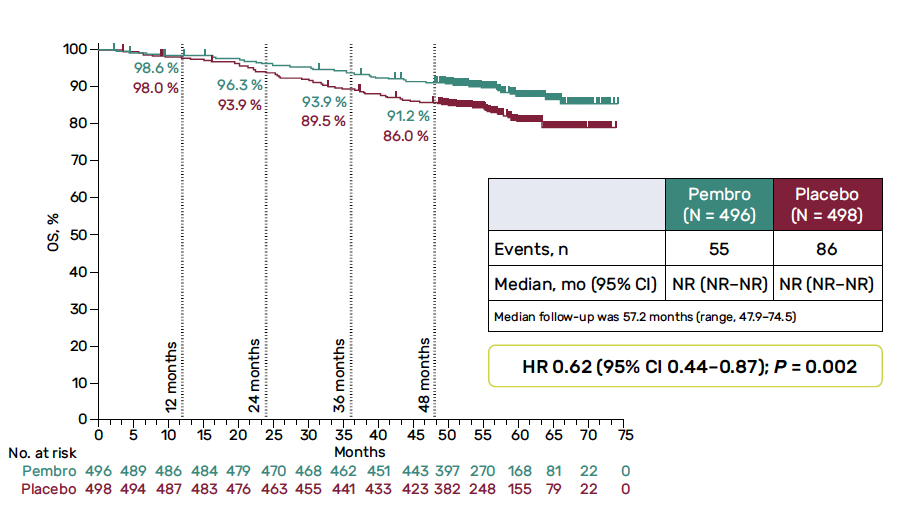
Résultats – Après un suivi médian de 57,2 mois, l’étude KEYNOTE-564 s’est également révélée positive sur son critère d’évaluation secondaire avec une diminution du risque de décès de 38 % (HR = 0,62 ; IC 95 % = 0,44-0,87 ; p = 0,002) en faveur d’un traitement adjuvant par pembrolizumab, avec un taux de survie à 48 mois de 91,2 % (versus 86 % dans le groupe placebo) (Fig. 4). Ce bénéfice était observé dans la plupart des sous-groupes d’intérêt prédéfinis notamment en cas de statut PD-L1 positif (CPS ≥ 1) et en cas de maladie M0. Le bénéfice en SSP était également confirmé (HR = 0,72 ; IC 95 % = 0,59-0,87). Il n’existait pas de nouveau signal défavorable en termes de tolérance avec un taux d’effets indésirables en lien avec le traitement de tous grades de 79,1 % (contre 53 %) et de grade ≥ 3 de 18,6 % (contre 1,2 %) dans le groupe pembrolizumab. Il s’agit de la première étude de grande ampleur ayant montré un bénéfice en survie globale dans une population de patients atteints d’un CR opéré avec un risque élevé de récidive.
Figure 4 – KEYNOTE-564 : données de survie globale en ITT.
L’étude CheckMate 914 – Ces résultats contrastaient avec ceux de l’étude CheckMate 914 présentés le même jour, une nouvelle fois négative, cette fois-ci pour les patients traités par nivolumab en monothérapie (bras B). Les données du bras A n’avaient montré aucun bénéfice en termes de survie sans maladie pour le traitement adjuvant nivolumab et ipilimumab par rapport au placebo dans la population globale de l’étude. Les patients inclus étaient atteints d’un CR avec une histologie à cellules majoritairement claires (avec ou sans contingent sarcomatoïde), ayant bénéficié d’une néphrectomie radicale ou partielle entre 4 et 12 semaines avant la randomisation, avec un stade pT2a (grade 3/4) N0M0, pT2b- T4 (tous grades) N0M0, ou pT (tous grades) N1M0, sans aucun signe de maladie résiduelle ou de métastases à distance.
Résultats – Avec un suivi médian de 27,0 mois, l’analyse du critère de jugement principal n’a pas retrouvé d’amélioration significative de la survie sans maladie chez les patients traités par nivolumab en monothérapie par rapport au placebo (HR = 0,87 ; IC 95 % = 0,62-1,21 ; p = 0,3962) avec des taux de survie sans maladie à 12 mois de 83,3 versus 78,2 % et à 18 mois de 78,4 versus 75,4 %.
En pratique – L’étude KEYNOTE-564 a donc montré qu’un traitement adjuvant pembrolizumab pendant 1 an permettait pour la première fois d’obtenir un bénéfice significatif en SG dans une population sélectionnée de patients atteints d’un CR opéré et à risque non négligeable de récidive. Cette stratégie devrait donc tout naturellement s’imposer comme un nouveau standard dans les prochains mois. Les données de cette étude majeure sont toutefois contradictoires avec plusieurs essais réalisés dans le même cadre, dont CheckMate 914 (Tab. 1). Cette différence aurait pu initialement s’expliquer en partie par un excès de toxicité concernant cette étude avec notamment 28 % de grade ≥ 3 et 32 % d’interruption de traitement dans le bras A. Le profil de tolérance du bras B ne semble pas corroborer cette hypothèse avec une durée médiane de traitement presque optimale (5,1 mois) et un taux d’interruption de 9,6 % seulement. La faible population de patients avec une tumeur exprimant PD-L1 dans l’étude CheckMate 914 (14 % dans le bras A et 11 % dans le bras B) comparativement aux patients de l’étude KEYNOTE-564 (74 %) pourrait être l’une des explications. Au-delà d’essayer d’expliquer ces résultats contrastés avec des traitements et des stratégies différentes, il convient surtout d’identifier quel patient doit réellement bénéficier d’un traitement adjuvant (56,6 % des malades de l’étude KEYNOTE-564 n’ont pas récidivé sous placebo), les systèmes pronostiques (UISS, score de Leibovitch…) paraissant désormais obsolètes à l’ère de la médecine personnalisée.
Cancer du rein métastatique
Étude CheckMate 67T
George S et al. Subcutaneous nivolumab (NIVO SC) vs intravenous nivolumab (NIVO IV) in patients with previously treated advanced or metastatic clear cell renal cell carcinoma (ccRCC): Pharmacokinetics (PK), efficacy, and safety results from CheckMate 67T. ASCO-GU 2024 ; abst. LBA360.
Contexte – L’évolution des paradigmes de soins passe également par de nouvelles options d’administration des traitements qui réduisent la charge médicale des patients et améliorent l’efficacité des systèmes de santé. L’administration sous-cutanée (SC) d’anticorps pour diverses indications de cancer s’est révélée efficace et particulièrement bien tolérée. C’est notamment le cas du trastuzumab dans le cancer du sein. De plus, cette forme galénique est généralement préférée à la perfusion intraveineuse (IV) par les malades et permet d’améliorer l’utilisation des ressources de santé en réduisant le temps de préparation, la durée d’hospitalisation et la charge administrative. Le nivolumab SC a déjà été évalué dans une phase d’escalade de dose d’un essai de phase I-II (CheckMate 8KX). Les analyses pharmacocinétiques dans la population de patients traités dans cette étude et les données historiques du nivolumab IV ont permis d’établir une dose forfaitaire de 1 200 mg de nivolumab SC pour une utilisation ultérieure. C’est dans ce contexte que l’étude CheckMate 67T a été présentée lors du congrès de l’ASCO-GU.
L’étude – Il s’agissait d’une étude de phase III multicentrique, randomisée, de non-infériorité et ouverte, évaluant les données pharmacocinétiques et le taux de réponse objective du nivolumab SC en comparaison à une perfusion IV de l’immunothérapie chez des patients atteints d’un CRCC localement avancé ou métastatique, en situation de 2e ou de 3e ligne thérapeutique. Les malades inclus étaient randomisés (1:1) pour recevoir soit nivolumab SC 1 200 mg toutes les 4 semaines (n = 248), soit nivolumab IV à 3 mg/kg toutes les 2 semaines (n = 247). Le traitement était poursuivi jusqu’à progression de la maladie, survenue d’une toxicité inacceptable, d’un décès, retrait du consentement, ou la fin des 2 années d’utilisation. Les co-critères pharmacocinétiques principaux des tests de non-infériorité étaient la concentration moyenne à 28 jours (Cavgd28) et la concentration sérique minimale à l’état d’équilibre (Cminss). Le critère majeur d’évaluation secondaire pour les tests de non-infériorité était le TRO selon une revue centrale indépendante en aveugle (BICR).
Résultats – La non-infériorité pour les co-critères pharmacocinétiques principaux a bien été obtenue tout comme celle concernant le TRO (60 % dans le bras SC contre 45 % dans le bras IV ; RR =1,33 ; IC 95% = 0,94-1,87). Concernant les autres critères secondaires d’efficacité, le TCM et le délai médian de réponse (3,7 mois) étaient similaires dans les deux bras (~ 63 %). La médiane de SSP était numériquement plus longue chez les patients traités par nivolumab en SC (7,2 contre 5,7 mois) bien que cette différence ne soit pas statistiquement significative (HR =1,06 ; IC 95 % = 0,84-1,34).
Tolérance – Il n’existait pas de signal défavorable en termes de tolérance concernant la forme SC. Les taux d’événements indésirables (tous grades confondus ou de grade ≥ 3) liés au traitement et ceux ayant conduit à l’arrêt du traitement étaient similaires dans les deux bras.
En pratique – L’étude CheckMate 67T a démontré que l’administration SC du nivolumab était non inférieure à la voie IV en termes de données pharmacocinétiques et d’efficacité (TRP). Les mé-dianes de SSP, le TCM et le délai de réponse étaient similaires dans les deux bras. Ces données soutiennent que le nivolumab en injection SC est désormais une option tout à fait envisageable à partir de la 2e ligne thérapeutique dans le CRm, permettant de garantir une efficacité optimale du traitement et d’améliorer le confort du patient, mais aussi celui des soignants en termes de durée d’hospitalisation et de charge médicale ou administrative.
Étude LITESPARK-005 (phase III)
Powles T et al. Belzutifan versus everolimus in participants (pts) with previously treated advanced renal cell carcinoma (RCC): Patient-reported outcomes (PROs) in the phase 3 LITESPARK-005 study. ASCO-GU 2024 ; abst. 361.
Contexte – Les premières données de l’étude LITESPARK-005 évaluant le belzutifan (n = 374) en comparaison avec l’évérolimus (n = 372) chez les patients atteints d’un CRCCm prétraité (une à trois lignes thérapeutiques systémiques antérieures incluant un anti-PD-1/L1 et un inhibiteur de tyrosine kinase) ont été présentées lors de l’ESMO 2023. Après un suivi médian de 18,4 mois (première analyse intermédiaire) et de 25,7 mois (deuxième analyse intermédiaire), dans une population lourdement prétraitée (45 % des patients avaient déjà reçu trois lignes de traitement), le belzutifan a montré un bénéfice significatif en SSP (HR = 0,75 ; IC 95 % = 0,63-0,90 ; p < 0,001), avec un taux de SSP à 12 mois de 33,7 contre 17,6 % et un taux de SSP à 18 mois de 22,5 contre 9,0 %. L’analyse de la SG n’était pas encore mature avec une absence d’amélioration significative pour le moment. Sur la base des résultats de LITESPARK-005, le belzutifan a récemment été approuvé par la FDA comme traitement des patients atteints d’un CRCC avancé, après un anti-PD-1/L1 et un inhibiteur de tyrosine kinase ciblant VEGF. Cette année, le Dr Powles a présenté les résultats rapportés par les patients en termes de bénéfice clinique et de qualité de vie pour le belzutifan par rapport à l’évérolimus.
Résultats – Les résultats rapportés par les patients ont été évalués pendant la phase de traitement le premier jour des semaines 1, 3, 5 et 9, puis toutes les 4 semaines, à la fin du traitement et 30 jours après le traitement. L’index FKSI-DRS (pour la symptomatologie rénale) et le questionnaire EORTC QLQ-C30 ont été utilisés. Les critères d’évaluation secondaires comprenaient le délai jusqu’à une détérioration confirmée (TTD) des symptômes rapportés par le patient et la variation moyenne du score de qualité de vie entre le départ et la semaine 17. La population analysée concer-nait tous les participants randomisés ayant reçu au moins une dose du traitement à l’étude et qui ont effectué au moins une évaluation de leur qualité de vie avec un taux de conformité au départ > 94 %. En comparaison avec l’évérolimus, le belzutifan était associé à un délai significativement plus long d’une dégradation confirmée de la qualité de vie des patients évaluée par les questionnaires spécifiques de la maladie (FKSI-DRS) et globaux (QLQ-C30 GHS/QoL).
Tolérance – Bien que les taux d’événements indésirables de tous grades et de grades 3 à 5 soient similaires dans les deux bras, il existait une toxicité spécifique de classe avec notamment une anémie plus fréquente sous belzutifan via l’action sur la sécrétion d’EPO ou l’hypoxie (33 % de grade ≥ 3 versus 17 % pour le belzutifan) alors que la toux, les éruptions cutanées, la stomatite et l’hyperglycémie étaient plus souvent retrouvées avec l’évérolimus.
En pratique – Les résultats rapportés par les malades inclus dans l’étude LITESPARK-005 soulignent un bénéfice clinique en termes de symptômes spécifiques de la maladie et une meilleure qualité de vie des patients atteints d’un CRCCm sous belzutifan. Cette thérapie est également associée à un délai significativement plus long d’une détérioration de la qualité de vie par rapport à l’évérolimus. Ces données démontrent également que, parallèlement à l’amélioration de critères d’efficacité en termes de survie ou de TRO, l’aspect qualitatif de la prise en charge thérapeutique reste fondamental chez les patients atteints d’une maladie avancée et lourdement prétraités.
Étude CheckMate 9ER, CheckMate 914 et CLEAR (phase III)
Bourlon MT et al. Nivolumab plus cabozantinib (N+C) vs sunitinib (S) for previously untreated advanced renal cell carcinoma (aRCC): Results from 55-month follow-up of the CheckMate 9ER trial. ASCO-GU 2024 ; abst. 362.
Tannir NM et al. Nivolumab plus ipilimumab (NIVO+IPI) vs sunitinib (SUN) for first-line treat-ment of advanced renal cell carcinoma (aRCC): Long-term follow-up data from the phase 3 CheckMate 214 trial. ASCO-GU 2024 ; abst. 363.
Grünwald V et al. Subgroup analyses of efficacy outcomes by baseline tumor size in the phase 3, open-label CLEAR trial. ASCO-GU 2024 ; abst. 364.
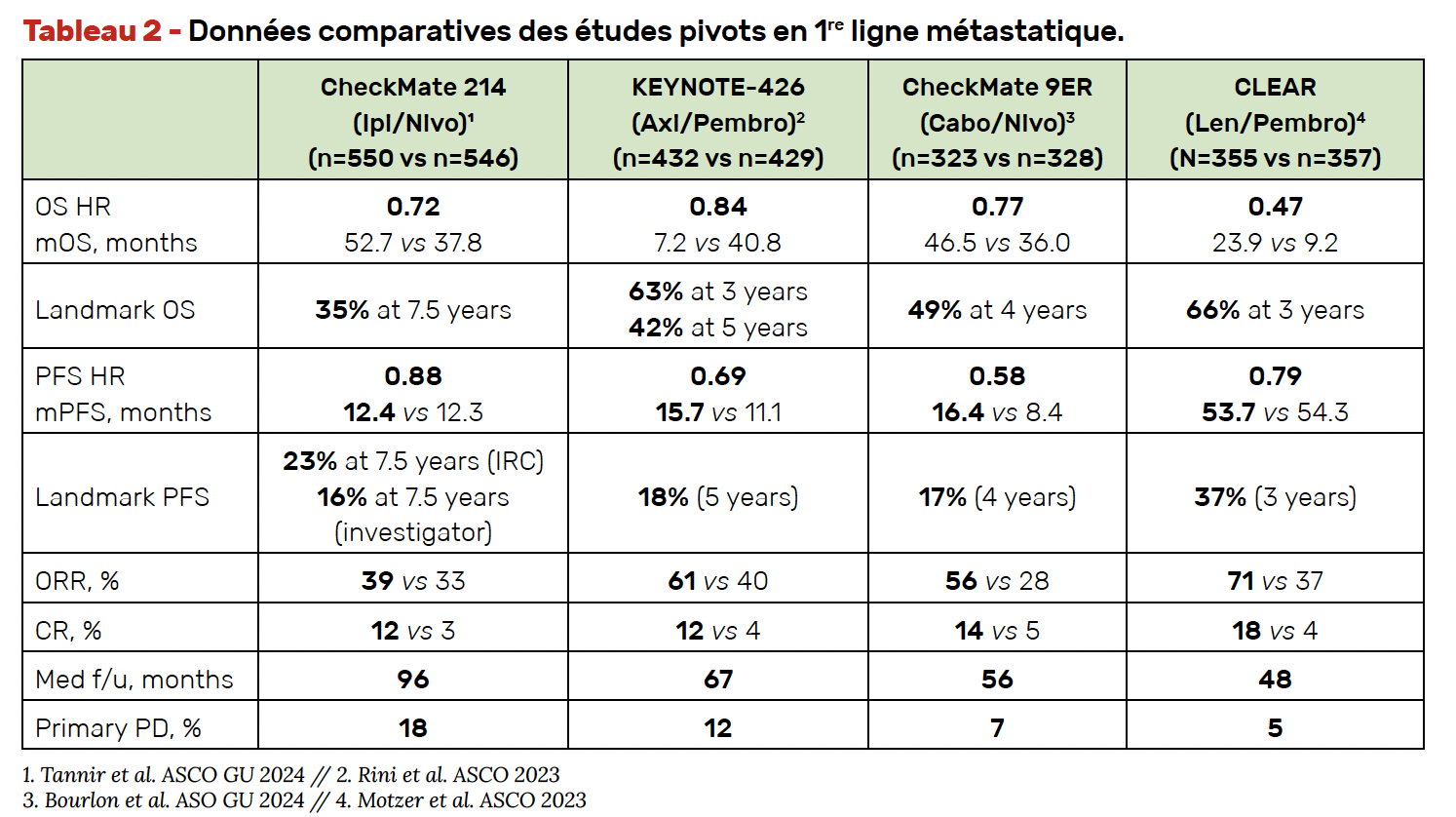
Contexte – Ces dernières années, la prise en charge thérapeutique du CR a connu une évolution majeure. La découverte des inhibiteurs de checkpoints immunitaires (anti-PD-1/anti-PD-L1 et anti-CTLA-4) a complètement révolutionné le paysage du carcinome à cellules rénales. L’immunothérapie d’abord utilisée en situation de 2e ou 3e ligne thérapeutique est désormais présente dans tous les traitements standard de 1re ligne métastatique sous la forme d’un doublet d’immunothérapie ou en association avec un inhibiteur de tyrosine kinase. En France, quatre associations sont désormais remboursées et validées en pratique courante avec pembrolizumab + axitinib (KEYNOTE-426) (10), nivolumab + cabozantib (CheckMate 9ER) (11), pembrolizumab + lenvatinib (CLEAR) (12) et nivolumab + ipilimumab (CheckMate 214) (13). Lors du congrès, cette année, les données de plusieurs études ont été actualisées avec le suivi à long terme de CheckMate 214, le suivi à 55 mois de CheckMate 9ER et une analyse en sous-groupes de CLEAR selon la charge tumorale initiale de la maladie.
L’étude CheckMate 214 – Les patients (1:1) atteints d’un CRCC avancé, recevaient soit du nivolumab à 3 mg/kg associé à l’ipilimumab à 1 mg/kg toutes les
3 semaines pour quatre injections puis nivolumab 3 mg/kg toutes les 2 semaines, soit du sunitinib 50 mg une fois par jour (pendant 4 semaines suivies de 2 semaines d’arrêt). Les critères d’évaluation comprenaient la SG, la SSP et le TRO chez les patients avec un pronostic intermédiaire/défavorable selon les critères IMDC (critère primaire), en intention de traiter (critère secondaire) et chez les patients avec un pronostic favorable (critère exploratoire). Les résultats chez les patients survivants à long terme ont été évalués en analyse post hoc.
Résultats – Avec un suivi médian désormais de 7,5 ans, le bénéfice significatif en SG de nivolumab + ipilimumab se maintenait dans la population en ITT (HR = 0,72 ; IC 95 % = 0,62-0,83) et dans le groupe IMDC intermédiaire/défavorable (HR = 0,69 ; IC 95 % = 0,59-0,81). Les données de SSP restaient similaires à celles précédemment observées (bénéfice dans le bras nivolumab + ipilimumab dans le groupe à risque intermédiaire/faible et dans le bras sunitinib dans le groupe à risque favorable), tout comme les TRO et réponse complète.
L’étude CheckMate 9ER – Les patients étaient randomisés pour recevoir soit du nivolumab 240 mg toutes les 2 semaines associé au cabozantinib 40 mg une fois par jour, soit du sunitinib 50 mg une fois par jour (4 semaines sur 6). Les données de suivi médian à 55 mois ont été publiées.
Résultats – Cette actualisation confirmait une amélioration significative en faveur de la combinaison en termes de SSP (16,4 versus 8,4 mois) (HR = 0,58 ; IC 95 % = 0,49-0,70), de SG (46,5 versus 36,0 mois) (HR = 0,77 ; IC 95 % = 0,63-0,95) et de réponse objective (TRO de 56 versus 28 %, dont 14% de réponse complète versus 5 %). Le bénéfice était observé quels que soient les sites métastatiques. Dans la population à risque favorable selon IMDC, les médianes de SSP et de SG étaient respectivement de 21,4 versus 12,8 mois (HR = 0,69 ; IC 95 % = 0,48-1,00) et 52,9 versus 58,9 mois (HR = 1,10 ; IC 95 % = 0,69-1,75) avec l’association. Le TRO était de 66,2 contre 44,4 % (dont 16,2 versus 8,3 % de réponse complète).
L’étude CLEAR – Enfin, concernant l’étude de phase III CLEAR (lenvatinib 20 mg/j et pembrolizumab 200 mg IV toutes les 3 semaines versus lenvatinib 18 mg/j + évérolimus 5 mg/j versus sunitinib 50 mg/j 4 semaines de prise/2 semaines d’arrêt), il s’agissait d’une analyse en sous-groupes en fonction du volume tumoral initial en distinguant quatre catégories de patients (Q1 < 34,72 mm, Q2 = 34,72-60,06 mm, Q3 = 60,06-108,56 mm et Q4 > 108,56 mm).
Résultats – Les données de SG semblaient corrélées au volume tumoral initial avec un taux de sur-vie globale à 3 ans sous traitement de 73 % dans Q1, 69,3 % dans Q2, 63,4 % dans Q3 et 55,6 % dans Q4. Les taux de SSP à 3 ans et de réponse objective étaient similaires, quelle que soit la catégorie de patients avec toutefois un taux de réponse complète plus important chez les malades avec un volume tumoral plus restreint (29,6 % dans Q1 et 22,5 % dans Q2 versus 11,1 % dans Q3 et 2,5 % dans Q4). On notait toutefois que 89 % des patients avec un volume tumoral restreint avaient bénéficié d’une néphrectomie contre 38 % des malades avec un volume métastatique plus important.
En pratique – Cette actualisation des données de plusieurs études pivots permet de conforter la place de trois combinaisons de traitement en 1re ligne métastatique. Si aucune comparaison directe n’est possible entre ces différentes thérapies, qui avaient toutes comme bras comparateur un traitement par anti-angiogénique, l’étude des différents objectifs principaux ou secondaires et les analyses en sous-groupes restent instructives pour guider le prescripteur dans son choix thérapeutique (Tab. 2). D’autres éléments, comme l’expérience du clinicien, le profil de toxicité de l’association et les facteurs liés à la maladie (sites métastatiques, caractéristiques histologiques, profil évolutif) et ceux des patients, doivent également être pris en considération. La recherche de biomarqueurs prédictifs d’efficacité ou pronostiques pourrait également permettre de définir la stratégie thérapeutique la plus optimale. Un projet européen à grande échelle, CARE-1, visera à optimiser le traitement de 1re ligne des patients atteints de CRm via la mise en œuvre d’un biomarqueur de routine.
L’auteur déclare avoir reçu des honoraires en tant que consultant ou conférencier de la part de BMS, Sanofi, Ipsen, Janssen, Pzifer, Bayer, Novartis, Eisai, MSD, Astellas, Merck et AstraZeneca.
Bibliographie
1. Freedland SJ, de Almeida Luz M, De Giorgi U et al. Improved outcomes with enzalu-tamide in biochemically recurrent prostate cancer. N Engl J Med 2023 ; 389 : 1453-65.
2. Agarwal N, McGregor B, Maughan BL et al. Cabozantinib in combination with atezoli-zumab in patients with metastatic castration-resistant prostate cancer: results from an ex-pansion cohort of a multicentre, open-label, phase 1b trial (COSMIC-021). Lancet On-col 2022 ; 23 : 899-909.
3. Saad F, Clarke NW, Oya M et al. Olaparib plus abiraterone versus placebo plus abi-raterone in metastatic castration-resistant prostate cancer (PROpel): final prespecified overall survival results of a randomised, double-blind, phase 3 trial. Lancet Oncol 2023 ; 24 : 1094-108.
4. Bajorin DF, Witjes JA, Gschwend JE et al. Adjuvant nivolumab versus placebo in mus-cle-invasive urothelial carcinoma. N Engl J Med 2021 ; 384 : 2102-14.
5. Powles T, Valderral BP, Gupta S et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024 ; 390 : 875-88.
6. Pal SK, McGregor B, Suárez C et al. Cabozantinib in combination with atezolizumab for advanced renal cell carcinoma: results from the COSMIC-021 Study. J Clin Oncol 2021 ; 39 : 3725-36.
7. Rosenberg JE, Powles T, Sonpavde GP et al. EV-301 long-term outcomes: 24-month findings from the phase III trial of enfortumab vedotin versus chemotherapy in patients with previously treated advanced urothelial carcinoma. Ann Oncol 2023 ; 34 : 1047-54.
8. Powles T, Park SH, Voog E et al. Avelumab maintenance therapy for advanced or meta-static urothelial carcinoma. N Engl J Med 2020 ; 383 : 1218-30.
9. Powles T, Tomczak P, Park SH et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2022 ; 23 : 1133-44.
10. Rini BI, Plimack ER, Stus V et al. Pembrolizumab plus axitinib versus sunitinib for ad-vanced renal-cell carcinoma. N Engl J Med 2019 ; 380 : 1116-27.
11. Choueiri TK, Powles T, Burotto M et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. N Engl J Med 2021 ; 384 : 829-41.
12. Motzer R, Alekseev B, Rha SY et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med 2021 ; 384 : 1289-300.
13. Motzer RJ, Tannir NM, McDermott DF et al. Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018 ; 378 : 1277-90.