Le premier biosimilaire a reçu son autorisation de mise sur le marché européenne par l’EMA (European Medical Association) en 2006 (1). Contrairement aux molécules génériques, les biosimilaires sont synthétisés à l’aide d’organismes vivants, ce qui implique une validation clinique. La biosimilarité doit être démontrée non seulement par une similarité de structure et d’activité biologique, mais aussi pour le profil d’efficacité, de sécurité, d’immunogénicité.
Les médicaments biologiques
Contraintes réglementaires
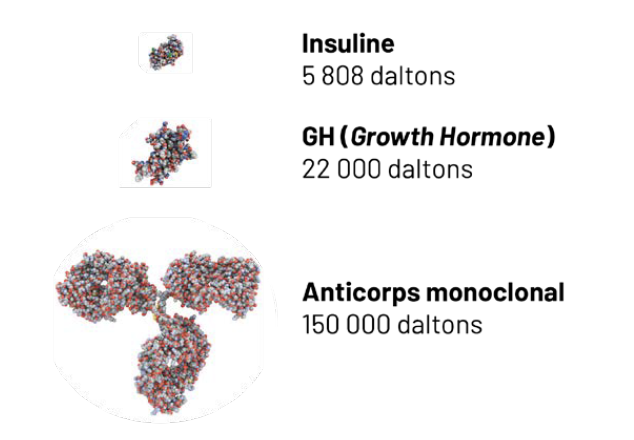
Les médicaments biologiques ou biomédicaments sont des molécules issues d’organismes vivants, allant de la simple protéine, comme une hormone, à un complexe de protéines, comme les anticorps (Fig. 1). Leur synthèse est régulée au niveau européen par la nécessité de suivre des recommandations de bonnes pratiques dont l’application est vérifiée lors d’inspections régulières. Si une partie de la chaîne de production se trouve hors de l’Union européenne, les contraintes s’appliquent également à cette partie. À cela s’ajoutent des contraintes spécifiques selon la nature de la molécule.
Figure 1 – Exemples de médicaments biologiques approuvés dans l’Union européenne (1).
La lecture de cet article est réservée aux abonnés.
Pour accéder à l'article complet
Découvrez nos offres d'abonnement
Abonnez-vous à la revue et accédez à tous les contenus du site !
- Tous les contenus de la revue en illimité
- Les numéros papier sur l'année
- Les newsletters mensuelles
- Les archives numériques en ligne
ou
Achetez cet article
ou
Inscrivez-vous gratuitement sur Onko +.fr et bénéficiez de l'accès à de nombreuses catégories du site !
- Accès aux catégories d'articles exclusives
- Les newsletters mensuelles
- Votre historique de commandes en ligne