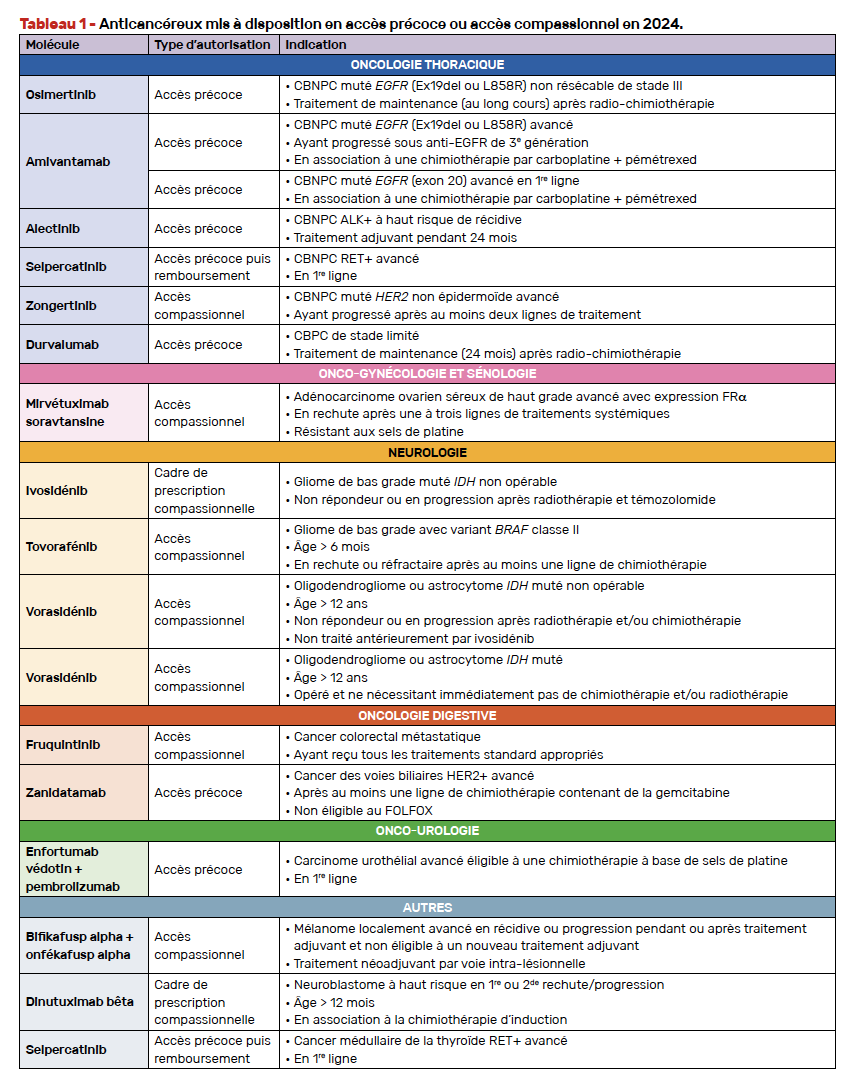
Comme chaque année, nous vous proposons un tour d’horizon des nouvelles molécules disponibles en oncologie. La recherche clinique reste active avec de nouveaux traitements accessibles cette année pour nos patients. La dynamique reste forte du côté des thérapies ciblées, de l’immunothérapie et des anticorps conjugués qui deviennent incontournables, y compris pour des cancers localisés ou localement avancés. Les informations présentées dans ce dossier ont été rédigées selon les disponibilités en date du 31 décembre 2024.
Résumé
Durant l’année 2024, neuf molécules ont été mises à disposition via une autorisation d’accès compassionnel (AAC) et neuf autres via une autorisation d’accès précoce (AAP). Parmi les molécules déjà disponibles dans le cadre d’AAP ou d’AAC, 13 ont bénéficié d’une autorisation de mise sur le marché (AMM) et d’un remboursement en droit commun.
Abstract
Anticancer treatments available in 2024 in France.
During the year 2024, nine molecules were made available through compassionate access authorization (AAC) and nine through early access authorization (AAP). Among the molecules already available under AAP or AAC, 13 have been granted marketing authorization (AMM) and reimbursed.
Introduction
Les dispositifs de mise à disposition des traitements
L’accès aux médicaments innovants est un élément majeur de la prise en charge des cancers. La France a mis en place un système dérogatoire visant à mettre à disposition des traitements innovants en attente d’autorisation de mise sur le marché (AMM) ou de remboursement. Depuis la réforme de 2021, deux grands cadres ont été mis en place, l’accès précoce (AAP) (qui remplace les ATU de cohorte) et l’accès compassionnel (AAC) (qui remplace les RTU et les ATU nominatives) (se référer au numéro de janvier 2024 pour plus de détails).
Une étude menée à partir du système national des données de santé (SNDS) a mis en évidence une croissance importante du nombre de patients traités en ATUc/AAP en oncologie, passant de 3 137 patients en 2019 à 18 341 patients en 2022 (1). Cependant, l’accès effectif à ces traitements reste contraint par la complexité des procédures administratives et de recueil des données (2).
L’ensemble des spécialités disponibles dans le cadre de ces dispositifs sont listées sur le site de l’ANSM (ansm.sante.fr/documents/reference/referentiel-des-specialites-en-acces-derogatoire) ainsi que sur le site OncoAccess (oncoaccess.sfpo.com) qui est régulièrement mis à jour par la Société française de pharmacologie oncologique (SFPO). Nous détaillons dans cet article l’ensemble des traitements anticancéreux qui ont été rendus accessibles en 2024 (Tab. 1).
Les remboursements obtenus en 2024
Nous pouvons nous réjouir du remboursement pérenne cette année de nombreux traitements auparavant disponibles en accès dérogatoire.
• L’avapritinib pour les tumeurs stromales gastro-intestinales (GIST) inopérables ou métastatiques présentant une mutation D842V du récepteur du facteur de croissance dérivé des plaquettes alpha (PDGFRA).
• Le durvalumab en association à une chimiothérapie par gemcitabine/cisplatine en première ligne de traitement pour les cancers des voies biliaires non résécables ou métastatiques.
• L’association durvalumab + trémélimumab en première ligne de traitement pour les carcinomes hépatocellulaires avancés ou non résécables et non éligibles à un traitement par l’association atézolizumab + bévacizumab.
• L’olaparib en association à l’abiratérone pour les cancers de la prostate métastatiques résistants à la castration pour lesquels la chimiothérapie n’est pas cliniquement indiquée.
• L’olaparib en monothérapie ou en association à une hormonothérapie pour le traitement adjuvant des cancers du sein précoces à haut risque HER2- et présentant une mutation germinale des gènes BRCA1/2.
• L’osimertinib en traitement adjuvant des cancers bronchiques non à petites cellules avec mutation activatrice de l’EGFR par délétion de l’exon 19 ou substitution de l’exon 21 (L858R).
• Le pembrolizumab en traitement adjuvant des carcinomes rénaux à cellules claires à risque accru de récidive post-néphrectomie.
• Le pembrolizumab en traitement péri-opératoire (néoadjuvant en association à une chimiothérapie puis adjuvant en monothérapie) des cancers du sein triple négatifs à haut risque de récidive.
• Le riprétinib pour les GIST avancées ayant reçu au préalable un traitement par au moins trois inhibiteurs de la kinase, dont l’imatinib.
• Le sacituzumab govitécan pour les cancers du sein triple négatifs non résécables ou métastatiques, ayant reçu préalablement deux lignes de traitement systémiques ou plus.
• Le selpercatinib pour les cancers médullaires de la thyroïde avancés présentant une mutation du gène RET, qui nécessitent un traitement systémique après un traitement antérieur par cabozantinib et/ou vandétanib.
• Le trastuzumab déruxtécan pour les adénocarcinomes de l’estomac ou de la jonction œsogastrique HER2-positifs localement avancés ou métastatiques ayant reçu préalablement au moins deux lignes de traitement incluant le trastuzumab.
• Le trastuzumab déruxtécan pour les cancers du sein HER2+ non résécables ou métastatiques ayant reçu au préalable au moins une ligne de traitement anti-HER2.
Les remboursements perdus en 2024
A contrario, l’année 2024 a également vu certains médicaments perdre leur prise en charge financière suite à leur évaluation défavorable par la commission de la transparence de la HAS.
• L’association niraparib/acétate d’abiratérone, jusqu’à présent disponible en accès précoce en traitement de première ligne des cancers de la prostate métastatiques résistants à la castration avec altération des gènes BRCA1/2, n’est plus disponible. Cependant, nos patients peuvent désormais bénéficier de l’olaparib, indépendamment du statut BRCA.
Osimertinib / Cancer bronchique non à petites cellules avec mutation EGFR
L’osimertinib s’est imposé dans le traitement des cancers bronchiques non à petites cellules (CBNPC) avec mutation de l’EGFR, d’abord en situation métastatique puis en situation adjuvante après chirurgie. Dans les cancers de stade III non résécables, dont jusqu’à un tiers présente une mutation de l’EGFR, le traitement standard reposait sur la radiochimiothérapie suivie d’une immunothérapie d’entretien par durvalumab. Cependant, le bénéfice de cette dernière est largement incertain chez les patients avec mutation de l’EGFR, qui présentent par ailleurs des taux de rechutes plus importants, en particulier au niveau cérébral. Il était donc logique de tester l’osimertinib dans ces stades III non résécables.
L’étude LAURA
Schéma – L’étude LAURA était un essai randomisé de phase III, évaluant l’efficacité et la tolérance d’un traitement d’entretien par osimertinib au long cours par rapport au placebo chez les patients atteints d’un CBNPC de stade III avec mutation commune de l’EGFR (Ex19del ou L858R) n’ayant pas progressé après radio-chimiothérapie (3).
Au total, 216 patients ont été randomisés avec un ratio 2/1. Parmi eux, on retrouvait une majorité d’Asiatiques (plus de 80 %), de femmes et de non-fumeurs. Près de la moitié présentait un stade IIIB et un tiers un stade IIIA.
Résultats – L’étude était positive sur son critère de jugement principal de survie sans progression (SSP), passant de 5,6 mois (IC 95 % : 3,7-7,4) à 39,1 mois (IC 95 % : 31,5-NA) avec un hazard ratio impressionnant à 0,16 (IC 95 % : 0,10-0,24 ; p < 0,001). La survie globale (SG) ne ressortait pas sur l’analyse intermédiaire, mais n’était pas mature.
Tolérance – Le profil de tolérance était correct, avec 35 % de toxicités de grade ≥ 3 dans le bras osimertinib contre 12 % dans le bras placebo. De façon intéressante, bien que les taux de pneumopathies radiques soient un peu plus importants dans le groupe osimertinib (48 versus 38 %), seulement 2 % étaient de grade ≥ 3.
L’osimertinib est disponible en accès précoce comme traitement de maintenance chez les patients atteints d’un CBNPC non résécable de stade III, avec mutation activatrice de l’EGFR par délétion de l’exon 19 ou substitution de l’exon 21 (L858R) et dont la maladie n’a pas progressé pendant ou après une radio-chimiothérapie à base de platine.
Amivantamab / Cancer bronchique non à petites cellules avec mutation EGFR
Les mutations EGFR sont les anomalies moléculaires actionnables les plus fréquentes dans les CBNPC. Le traitement de première ligne en situation métastatique repose sur l’osimertinib, éventuellement associé à une chimiothérapie. Les patients traités par osimertinib développent quasi inéluctablement des mécanismes de résistance, dont le plus fréquent est l’activation de la voie MET. L’amivantamab est un anticorps bispécifique EGFR-MET avec une activité pro-immunitaire qu’il était donc intéressant d’utiliser dans cette situation.
L’étude MARIPOSA-2
L’étude MARIPOSA-2 a évalué l’intérêt de l’amivantamab et du lazertinib (un nouvel anti-EGFR de 3e génération) dans les situations de résistance aux anti-EGFR (4).
Schéma – Il s’agissait d’un essai randomisé de phase III, évaluant les associations amivantamab + chimiothérapie et amivantamab + lazertinib + chimiothérapie par rapport à une chimiothérapie seule chez des patients atteints de CBNPC avancés avec mutation EGFR classique (Ex19del ou L858R) en progression sous osimertinib.
Parmi les 970 patients randomisés, environ 70 % présentaient une délétion de l’exon 19 et 70 % également avaient reçu l’osimertinib en première ligne.
Résultats – Le critère de jugement principal de SSP était significativement amélioré dans le bras amivantamab + lazertinib + chimiothérapie (médiane de 8,3 mois ; HR versus chimiothérapie seule à 0,44 ; IC 95 % : 0,35-0,56 ; p < 0,001) et le bras amivantamab + chimiothérapie (médiane de 6,3 mois ; HR versus chimiothérapie seule à 0,48 ; IC 95 % : 0,36-0,64 ; p < 0,001) par rapport à la chimiothérapie seule (médiane de 4,2 mois). Ce bénéfice était globalement homogène dans l’ensemble des sous-groupes d’intérêt.
Tolérance – Le profil de tolérance était cependant difficile, avec 72 % de toxicités de grade 3-4 dans le groupe amivantamab + chimiothérapie et 92 % dans le groupe amivantamab + lazertinib + chimiothérapie, avec notamment une surtoxicité hématologique, une toxicité cutanée et des réactions à la perfusion qu’il faudra apprendre à gérer. On notait par ailleurs des événements thrombo-emboliques fréquents, faisant recommander une anticoagulation préventive. Au vu des hazard ratios similaires entre les deux groupes expérimentaux et de la surtoxicité notable de l’association amivantamab + lazertinib + chimiothérapie, seule l’association amivantamab + chimiothérapie a été retenue par les autorités de santé.
L’amivantamab est disponible en accès précoce en association à une chimiothérapie par carboplatine + pémétrexed dans le traitement des patients atteints d’un CBNPC avancé avec mutation EGFR classique (Ex19del ou L858R) ayant progressé sous anti-EGFR de troisième génération.
Amivantamab / Cancer bronchique non à petites cellules avec mutation EGFR
Les insertions dans l’exon 20 sont les troisièmes anomalies d’EGFR les plus fréquentes dans les CBNPC, mais ne sont pas sensibles aux inhibiteurs de tyrosine kinase ciblant EGFR. L’amivantamab a été évalué chez ces patients car des données pré-cliniques montraient que la structure de cet anticorps bispécifique ciblant EGFR et MET pouvait “bypasser” la résistance naturelle aux anti-EGFR.
L’étude PAPILLON
À la suite de la phase I CHRYSALIS, le bien nommé essai PAPILLON visait à évaluer l’efficacité de l’amivantamab chez les patients atteints d’un CBNPC dépendant d’une insertion dans l’exon 20 d’EGFR (5).
Schéma – Il s’agissait d’un essai randomisé de phase III comparant l’association amivantamab + chimiothérapie par rapport à une chimiothérapie seule chez des patients métastatiques naïfs de traitement.
Au total, 308 patients ont été randomisés, avec une majorité de femmes et d’Asiatiques.
Résultats – Le critère de jugement principal de SSP était atteint, passant de 6,7 mois (IC 95 % : 5,6-7,3) à 11,4 mois (IC 95 % : 9,8-13,7 ; HR : 0,40 ; IC 95 % : 0,30-0,53 ; p < 0,001) avec l’ajout de l’amivantamab à la chimiothérapie. Le taux de réponse objective (TRO) était également amélioré, passant de 47 à 73 %.
Tolérance – Le profil de tolérance était semblable à celui de MARIPOSA-2, avec principalement une toxicité hématologique et cutanée ainsi que des réactions à la perfusion.
L’amivantamab est également disponible en accès précoce en association à une chimiothérapie par carboplatine + pémétrexed dans le traitement de première ligne des patients atteints d’un CBNPC avancé avec mutation EGFR par insertion de l’exon 20.
Alectinib / Cancer bronchique non à petites cellules ALK+
Les réarrangements du gène ALK concernent environ 5 % des CBNPC et principalement des patients jeunes et non fumeurs. Le risque de récidive après traitement local ± chimiothérapie adjuvante est élevé (de 45 % pour les stades IB à 75 % pour les stades III à 5 ans), avec en particulier des métastases cérébrales.
L’étude ALINA
De façon similaire à l’étude ADAURA, qui a imposé l’osimertinib en situation adjuvante dans les CBNPC avec mutation EGFR, l’étude ALINA a évalué la place de l’alectinib en situation adjuvante dans les CBNPC avec réarrangement d’ALK (6).
Schéma – Il s’agissait d’un essai randomisé en ouvert de phase III, incluant des patients opérés d’un CBNPC de stades IB (≥ 4 cm), II ou III, avec réarrangement d’ALK et éligibles à une chimiothérapie par sels de platine. Les patients étaient randomisés dans les 12 semaines suivant la chirurgie entre un traitement par alectinib pendant 24 mois ou une chimiothérapie à base de sels de platine pendant quatre cycles.
Parmi les 257 patients inclus, la majorité était non fumeurs et 55 % présentaient un stade IIIA.
Résultats – L’objectif principal de survie sans maladie (SSM) était largement atteint avec un hazard ratio à 0,24 (IC 95 % : 0,13-0,43 ; p < 0,001). De façon intéressante, le bénéfice semble se maintenir après l’arrêt de l’alectinib puisque la SSM à 3 ans passe de 54 à 88,7 % avec ce traitement.
Tolérance – Le profil de tolérance était correct avec principalement des troubles digestifs et des élévations des CPK de grade 1-2 sous alectinib. On notera par ailleurs que les patients traités par alectinib ne recevaient pas de chimiothérapie adjuvante, contrairement à ADAURA, où l’osimertinib venait s’ajouter à la chimiothérapie adjuvante.
L’alectinib est disponible en accès précoce dans le traitement adjuvant, après résection complète de la tumeur, des patients atteints d’un CBNPC ALK+ à haut risque de récidive.
Selpercatinib / Cancer bronchique non à petites cellules avec fusion de RET
Les fusions de RET concernent environ 1 à 2 % des CBNPC et sont associées à une moindre efficacité de l’immunothérapie. Le selpercatinib est un inhibiteur de tyrosine kinase ciblant RET de façon sélective qui avait déjà fait la preuve de son efficacité dans le traitement des CBNPC et cancers thyroïdiens avec altération de RET en lignes avancées.
L’étude LIBRETTO-431
Schéma – L’étude LIBRETTO-431 était un essai randomisé de phase III comparant le selpercatinib à une chimiothérapie à base de sels de platine ± immunothérapie comme traitement de première ligne chez des patients atteints de CBNPC avancé avec fusion de RET (7). Le protocole prévoyait que le critère de jugement principal (SSP) soit d’abord évalué dans la population des patients pour lesquels l’investigateur avait l’intention d’associer le pembrolizumab à la chimiothérapie en cas de randomisation dans le bras contrôle.
Au total, 261 patients ont été randomisés, dont 212 dans la population “intention de traitement par pembrolizumab”. On notait 50 % de femmes, une majorité d’Asiatiques et 20 % des métastases cérébrales.
Résultats – L’analyse intermédiaire a mis en évidence un gain significatif en SSP, passant de 11,2 mois (IC 95 % : 8,8-16,8) dans le groupe chimiothérapie + pembrolizumab à 24,8 mois (IC 95 % : 16,9-NA) dans le groupe selpercatinib (HR : 0,46 ; IC 95 % : 0,31-0,70 ; p < 0,001). Le TRO était également plus important, passant de 65 à 84 %. Le gain en SSP était également observé dans la population globale avec un HR à 0,53. Les données de SG ne sont en revanche pas encore matures.
Tolérance – Le profil de tolérance du selpercatinib était marqué par des perturbations du bilan hépatique (22 % de grade ≥ 3), de l’hypertension (20 % de grade ≥ 3) et des œdèmes (3 % de grade ≥ 3). En revanche, ces patients présentaient moins de toxicités hématologiques et digestives, ainsi qu’une meilleure qualité de vie que dans le groupe chimiothérapie ± immunothérapie.
Le selpercatinib était disponible en accès précoce comme traitement de première ligne des patients atteints d’un CBNPC avancé présentant une fusion du gène RET. Il est depuis décembre disponible en pharmacie de ville, en première ligne, mais aussi en lignes avancées.
Zongertinib / Cancer bronchique non à petites cellules avec mutation HER2
Les mutations d’HER2 (en particulier de l’exon 20) concernent environ 2 à 4 % des CBNPC et sont principalement retrouvées chez les femmes et les non-fumeurs. Elles peuvent également intervenir comme mécanisme de résistance aux anti-EGFR.
L’étude Beamion LUNG-1
Le zongertinib est un inhibiteur de tyrosine kinase ciblant spécifiquement HER2. Son efficacité dans les CBNPC a été évaluée dans l’étude de phase Ib Beamion LUNG-1, dont les premiers résultats ont été présentés à l’ASCO 2024 (8).
Résultats – Parmi la quarantaine de patients évaluables, le TRO était de 74 % et la SSP médiane n’était pas atteinte (IC 95 % : 7,6 mois-NE).
Tolérance – Les principales toxicités étaient hématologiques et digestives.
Le zongertinib est disponible en accès compassionnel pour les patients atteints d’un CBNPC non épidermoïde avec mutation du domaine tyrosine kinase du gène HER2 ayant reçu au moins deux lignes de traitement antérieures.
Durvalumab / Cancer bronchique à petites cellules limité
Les cancers bronchiques à petites cellules (CBPC) restent des cancers de mauvais pronostic, même lorsqu’ils sont limités au thorax, avec de nombreuses rechutes après radio-chimiothérapie. Si les CBNPC avaient accès, après radio-chimiothérapie, à une immunothérapie de consolidation depuis l’étude PACIFIC, il aura fallu attendre l’étude ADRIATIC pour évaluer cette stratégie dans les CBPC (9).
L’étude ADRIATIC
Schéma – Il s’agissait d’un essai randomisé de phase III évaluant l’intérêt d’un traitement adjuvant pendant 24 mois par durvalumab seul ou durvalumab + trémélimumab par rapport au placebo chez les patients atteints d’un CBPC limité au thorax n’ayant pas progressé après radio-chimiothérapie.
Parmi les 730 patients randomisés, près de 90 % présentaient un cancer de stade III, 65 % ont reçu une chimiothérapie par cisplatine étoposide, près de 30 % une irradiation thoracique bifractionnée et 50 % une irradiation cérébrale prophylactique.
Résultats – Les deux co-critères de jugements principaux étaient positifs, avec une amélioration de la SG passant de 33,4 mois (IC 95 % : 25,5-39,9) dans le groupe placebo à 55,9 mois (IC 95 % : 37,3-NA) avec le durvalumab (HR : 0,73 ; IC 98 % : 0,54-0,98 ; p = 0,01), et de la SSP passant de 9,2 mois (IC 95 % : 7,4-12,9) à 16,6 mois (IC 95 % : 10,2-28,2) avec le durvalumab (HR : 0,76 ; IC 97 % : 0,59-0,98 ; p = 0,02).
Tolérance – Le profil de tolérance était rassurant avec 24 % de toxicités de grade 3-4 dans les deux groupes, et des pneumopathies interstitielles de grade 3-4 chez 8,8 % des patients traités par durvalumab contre 6 % avec le placebo. Les résultats pour le groupe durvalumab + trémélimumab ne sont pas encore connus.
Le durvalumab est disponible en accès précoce dans le traitement adjuvant des patients atteints d’un CBPC de stade limité, dont la maladie n’a pas progressé après une radio-chimiothérapie concomitante à base de sels de platine.
Mirvétuximab soravtansine / Adénocarcinome séreux de haut grade de l’ovaire
La prise en charge des cancers de l’ovaire a été largement améliorée par les anti-PARP. Cependant, le pronostic reste sombre en situation de rechute résistante aux sels de platine.
Le mirvétuximab soravtansine est un anticorps drogue conjugué (ADC) ciblant le récepteur alpha du folate (FRα), qui est communément surexprimé dans les cancers ovariens, avec une chimiothérapie de type poison du fuseau.
L’étude FORWARD I
Son efficacité dans les cancers de l’ovaire résistants aux sels de platine a d’abord été évalué dans l’étude de phase III randomisée FORWARD I qui n’avait pas mis en évidence de bénéfice par rapport à une chimiothérapie (10). Cependant, la sélection des patients sur le statut FRα reposait sur une méthode probablement trop sensible, ce qui avait dilué le bénéfice du traitement expérimental. Une nouvelle méthode d’évaluation du statut FRα a été développée et a conduit à un nouvel essai clinique.
L’étude MIRASOL
Schéma – L’étude MIRASOL était un essai randomisé de phase III comparant le mirvétuximab soravtansine à une chimiothérapie au choix de l’investigateur (paclitaxel, doxorubine pégylée ou topotécan) chez des patientes présentant un carcinome ovarien séreux de haut grade, en situation platine résistante et ayant reçu entre une et trois lignes de traitements systémiques (11). Les patientes devaient présenter une expression forte du FRα, définie par le score PS2+ avec un test compagnon.
Parmi les 453 patientes randomisées, près de la moitié était en 4e ligne, 55 % avaient reçu un inhibiteur de PARP et 60 % du bévacizumab.
Résultats – L’objectif principal était rempli avec une SSP passant de 3,98 mois (IC 95 % : 4,21-5,23) à 5,62 mois (IC 95 % : 4,34-5,95 ;
p < 0,001). On notait également une amélioration du TRO (15,9 versus 42,3 %) et surtout de la SG passant de 12,75 à 16,46 mois (HR 0,67, IC95 0,50-0,89 ; p = 0,005).
Tolérance – Le profil de tolérance du mirvétuximab soravtansine était marqué par des toxicités oculaires à type de kératite nécessitant une collaboration étroite avec les ophtalmologistes.
Le mirvétuximab soravtansine est disponible en accès compassionnel comme traitement des patientes atteintes d’un adénocarcinome séreux de haut grade de l’ovaire, avec expression du récepteur alpha du folate (FRα), en rechute après une à trois lignes de traitements systémiques et résistant aux sels de platine. Un accès précoce est à l’étude dans cette indication.
Ivosidénib / Gliome de bas grade IDH muté inopérable
Les gliomes diffus sont des tumeurs cérébrales malignes incluant les gliomes de bas grade ainsi que les glioblastomes. La transformation des gliomes de bas grade vers des formes agressives se traduit par une augmentation de la prise de contraste à l’IRM et est généralement associée à une mutation dans le gène de l’isocitrate déshydrogénase (IDH1).
L’ivosidénib est un inhibiteur de la forme mutée de l’enzyme IDH1, déjà utilisé dans les leucémies aiguës myéloïdes ainsi que dans les cholangiocarcinomes avancés avec mutation de l’IDH1.
L’étude AG120-C-002
Cette molécule a été étudiée dans les tumeurs cérébrales dans le cadre de l’essai AG120-C-002 (12).
Schéma – Il s’agissait d’une étude de phase I, multicentrique portant sur la sécurité d’emploi, la pharmacocinétique et l’activité clinique de l’ivosidénib administré par voie orale à des patients présentant des tumeurs solides, y compris des gliomes, avec mutation IDH1. Les patients ont reçu le traitement à la dose de 200 à 1 200 mg/j pendant 28 jours selon un schéma standard 3 + 3 pendant la phase d’escalade, puis ont reçu l’ivosidénib à la dose de 500 mg/j pendant la phase d’expansion.
Résultats – Parmi les 66 patients avec un gliome IDH1 muté, un patient a eu comme meilleure réponse une réponse partielle et 44 patients (66,7 %) ont atteint une stabilisation de la maladie. Le taux de contrôle était de 85,7 % chez les 35 patients dont la tumeur ne prenait pas le contraste (bas grade) contre 45,2 % chez les 31 patients dont la tumeur prenait le contraste (haut grade). Les durées médianes de SSP étaient respectivement de 13,6 mois (IC 95 % : 9,2-33,2) pour les tumeurs ne prenant pas le contraste et de 1,4 mois (IC 95 % : 1,0-1,9) pour les tumeurs prenant le contraste.
L’ivosidénib est disponible via un cadre de prescription compassionnelle dans le traitement des patients atteints d’un gliome de bas grade IDH muté inopérable, non répondeur ou en progression après radiothérapie (ou non éligible) et au moins une ligne de chimiothérapie à base de témozolomide (ou non éligible).
Tovorafénib / Gliome de bas grade avec altération de BRAF
Le gliome de bas grade est la tumeur du système nerveux central la plus fréquente chez l’enfant, représentant environ 30 % des tumeurs cérébrales pédiatriques. Bien que considérées comme indolentes et potentiellement guérissables à certains endroits par résection chirurgicale complète, les tumeurs situées dans des zones critiques du cerveau et/ou présentant une biologie agressive qui ne se prêtent pas à une résection complète peuvent induire des déficits fonctionnels. Par ailleurs, les lignes de traitements systémiques ne sont pas nombreuses et souvent décevantes. Cependant, ces tumeurs présentent dans environ 30-40 % des cas des altérations génomiques BRAF.
L’étude FIREFLY-1
Schéma – Le tovorafénib est un inhibiteur de tyrosine kinase de type II ciblant RAF. Son efficacité a été étudiée dans l’étude FIREFLY-1, un essai clinique multicentrique de phase II à un seul bras (13). Les patients éligibles devaient avoir un gliome pédiatrique de bas grade récidivant ou réfractaire présentant avec altération activatrice de BRAF et avoir reçu au moins une ligne de traitement systémique antérieur.
Résultats – Parmi les 76 patients présentant une maladie mesurable, le taux de réponse globale était de 51 % et la durée médiane de réponse était de 13,8 mois.
Tolérance – À noter la présence d’effets indésirables de grade ≥ 3 dans 42 % des cas et 7 % d’arrêts de traitement pour toxicité. Les effets indésirables principaux liés au traitement étaient le changement de la couleur des cheveux (76 %), une anémie (49 %) et une élévation des CPK (56 %).
Le tovorafénib est disponible en accès compassionnel dans le traitement des patients âgés de plus de 6 mois présentant un gliome de bras grade, porteur d’une fusion/réarrangement de BRAF ou d’une mutation BRAF V600 non V600E, en rechute ou réfractaire, ayant reçu au moins une ligne de chimiothérapie standard et non atteints de neurofibromatose de type 1.
Vorasidénib / Oligodendrogliome ou astrocytome IDH muté inopérable
Les oligodendrogliomes et les astrocytomes font partie des tumeurs cérébrales primitives malignes les plus fréquentes. Les oligodendrogliomes se développent à partir des oligodendrocytes qui recouvrent et protègent les nerfs dans le cerveau, tandis que les astrocytomes se développent à partir des astrocytes, qui sont des cellules qui soutiennent et protègent les neurones. Ces tumeurs cérébrales peuvent elles aussi présenter des mutations de l’IDH1 et/ou de l’IDH2. Ces mutations conduisent à une surproduction d’un métabolite oncogène, le 2-hydroxyglutarate (2-HG), qui entraîne une altération de la différenciation cellulaire et contribue à l’oncogenèse.
Le vorasidénib est un inhibiteur des formes mutées des enzymes IDH1 et IDH2. Leur inhibition entraîne la diminution de la production anormale du 2-HG conduisant à la différenciation des cellules malignes et à une diminution de leur prolifération.
L’étude AG881-C-002
Schéma – L’étude AG881-C-002 est une étude multicentrique de phase I ayant évalué le vorasidénib chez 93 patients atteints de tumeurs solides mutées IDH1/2, dont 52 atteints de gliomes ayant récidivé après traitement standard par radiothérapie et/ou chimiothérapie (14). Ces rechutes ne devaient pas être opérables et les patients ne devaient pas avoir reçu d’ivosidénib.
Résultats – Le TRO était de 18 % dans la cohorte de patients atteints de gliome. La médiane de SSP était de 36,8 mois pour les patients atteints de gliome non rehaussé et de 3,6 mois pour les patients atteints de gliome rehaussé. L’évaluation du volume tumoral montrait une tendance à l’amélioration avec une réduction durable de la taille tumorale dans l’ensemble de la cohorte.
Tolérance – Le profil de toxicité était marqué par des cytolyses, mais était globalement favorable.
Le vorasidénib est disponible en accès compassionnel dans le traitement des patients âgés de plus de 12 ans présentant un oligodendrogliome ou un astrocytome IDH muté, inopérable, non répondeur ou en progression après un traitement par radiothérapie et/ou chimiothérapie (ou présentant une intolérance à ces traitements) et non traité antérieurement par ivosidénib.
Vorasidénib / Oligodendrogliome ou astrocytome IDH muté
Le traitement de choix de ces tumeurs reste la chirurgie. Malheureusement les résections ne sont pas toujours optimales du fait des localisations tumorales et de l’infiltration, d’où la nécessité de traitements adjuvants efficaces.
L’étude INDIGO
Schéma – L’étude INDIGO est une étude randomisée de phase II menée en double insu, évaluant le vorasidénib chez les patients atteints de gliome de grade II avec une mutation de l’IDH1 ou de l’IDH2, présentant un reliquat tumoral post-chirurgie, mais ne nécessitant pas de traitement immédiat par chimiothérapie et/ou radiothérapie (15).
Au total, 331 patients ont été randomisés pour recevoir du vorasidénib ou un placebo et le suivi médian était de 14,2 mois.
Résultats – La SSP était significativement améliorée, passant de 11,1 à 27,7 mois avec le vorasidénib, soit un HR à 0,39 (IC 95 % : 0,27-0,56 ;
p < 0,001). Le délai avant la prochaine intervention était également amélioré (HR : 0,26).
Tolérance – Le profil de tolérance était marqué par des effets indésirables de grade ≥ 3 survenus chez 22,8 % des patients ayant reçu du vorasidénib contre 13,5 % chez ceux ayant reçu un placebo, avec principalement des cytolyses hépatiques.
Le vorasidénib est donc également disponible en accès compassionnel dans le traitement des patients âgés de plus de 12 ans présentant un oligodendrogliome ou un astrocytome IDH muté, ne prenant majoritairement pas le contraste, ayant bénéficié d’un traitement par chirurgie et ne nécessitant pas immédiatement de chimiothérapie et/ou de radiothérapie.
Fruquintinib / Cancer colorectal métastatique réfractaire
La prise en charge du cancer colorectal métastatique repose sur la chimiothérapie par 5-fluorouracile, combinée à l’oxaliplatine et/ou l’irinotécan et des thérapies ciblées anti-EGFR ou anti-VEGF selon le statut moléculaire et la latéralité du primitif. Dans les situations de résistance à la chimiothérapie, le regorafénib et la trifluridine/tipiracil associée au bévacizumab apportent des gains modestes au prix de toxicités importantes. L’avènement de thérapies davantage ciblées offre de nouvelles perspectives lorsque les lignes précédentes se retrouvent épuisées. Parmi elles, les inhibiteurs sélectifs des récepteurs du facteur de croissance de l’endothélium vasculaire (VEGFR), tels que le fruquintinib, paraissent une option intéressante.
L’étude FRESCO-2
Schéma – Le fruquintinib a été évalué dans l’étude FRESCO-2, un essai de phase III mené chez des patients ayant un cancer colorectal métastatique réfractaire à l’ensemble des lignes actuellement proposables, avec une randomisation 2/1 versus placebo (16).
Parmi les 691 patients inclus, environ 20 % présentaient des tumeurs du côlon droit et près des deux tiers étaient mutées RAS. Les patients avaient reçu une médiane de quatre lignes et 40 % avaient été exposés à la fois au regorafénib et à la trifluridine/tipiracil.
Résultats – L’étude était positive sur son critère de jugement principal avec une augmentation de la SG, passant de 4,8 mois (IC 95 % : 4,0-5,8) à 7,4 mois (IC 95 % : 6,7-8,2), soit un HR à 0,66 (IC 95 % : 0,55-0,80 ; p < 0,0001).
Tolérance – Sur le plan de la tolérance, on notait 63 % de toxicités de grade 3 ou plus sous fruquintinib contre 50 % sous placebo, avec principalement hypertension, asthénie et syndrome main-pied. Les analyses de qualité de vie sont encore en cours.
Le fruquintinib est disponible en accès compassionnel dans le traitement des patients atteints d’un cancer colorectal métastatique après tous les traitements standard appropriés et pour lesquels aucune autre option satisfaisante n’est disponible ou recommandée.
Zanidatamab / Cancer des voies biliaires HER2+ IHC3+ non résécable localement avancé ou métastatique
Les cholangiocarcinomes sont des tumeurs rares dont le pronostic reste sombre. Le traitement systémique en situation métastatique repose à ce jour sur une première ligne de chimiothérapie par gemcitabine + cisplatine associée à une immunothérapie par durvalumab, et une seconde ligne par FOLFOX, quand le patient y est éligible, avec des SG de l’ordre de 12 mois. La médecine de précision a permis différentes avancées dans la prise en charge de ces patients, avec des traitements ciblant FGFR2 ou IDH1 qui sont des altérations fréquentes dans ces tumeurs. La voie HER2 est également de grand intérêt avec des mutations activatrices, amplification ou surexpression, dont la fréquence atteint 18 % dans les cholangiocarcinomes extra-hépatiques. Son inhibition spécifique représente donc une possibilité thérapeutique intéressante. Le zanidatamab est un anticorps bispécifique ciblant deux épitopes différents de l’HER2, pour lequel les modèles précliniques suggéraient une efficacité plus importante que l’association trastuzumab + pertuzumab.
L’étude HERIZON-BTC-01
Schéma – L’efficacité et la tolérance du zanidatamab ont été évaluées dans l’étude HERIZON-BTC-01, un essai multicentrique monobras de phase IIb (17). Les patients devaient présenter une tumeur des voies biliaires (vésicule biliaire ou cholangiocarcinome) métastatique avec amplification d’HER2 et avoir progressé après au moins une ligne de chimiothérapie contenant de la gemcitabine. Les patients ont reçu 20 mg/kg de zanidatamab par voie intraveineuse toutes les 2 semaines. Le critère d’évaluation principal était le TRO.
Parmi les 847 patients screenés, 171 présentaient une amplification d’HER2, soit un taux de 20 %. Au final, 87 patients ont été inclus, dont 80 avec une IHC 2 ou 3+ (cohorte 1) et sept avec une IHC 0 ou 1+ (cohorte 2).
Résultats cohorte 1 (amplification + IHC+) – Le taux de réponse objective était de 41,3 % (IC 95 % : 30,4-52,8), avec une SSP médiane de 5,5 mois (IC 95 % : 3,7-7,2). Dans les analyses en sous-groupes, le bénéfice semblait essentiellement drivé par les tumeurs avec IHC 3+ plutôt que 2+.
Résultats cohorte 2 (amplification mais IHC-) – La SSP était de 1,9 mois
(IC 95 % : 1,2-NA) et aucune réponse objective n’a été observée.
Tolérance – Le profil de tolérance était en revanche correct, avec essentiellement des réactions à la perfusion de grade 1-2, quelques diarrhées et les toxicités cardiaques que nous connaissons bien avec les anti-HER2.
Le zanidatamab est disponible en accès précoce dans le traitement des patients atteints d’un cancer des voies biliaires HER2+ IHC3+ non résécable, localement avancé ou métastatique, après au moins une ligne de traitement systémique contenant de la gemcitabine et inéligibles au protocole FOLFOX.
Enfortumab védotin + pembrolizumab / Carcinome urothélial non résécable ou métastatique
Depuis plusieurs décennies, la chimiothérapie à base de sels de platine constituait le traitement de première ligne du carcinome urothélial localement avancé ou métastatique. L’avènement de l’immunothérapie avec l’avélumab en traitement de maintenance chez les patients ne progressant pas sous chimiothérapie par sels de platine avait plus récemment apporté un gain de survie, mais le pronostic restait sombre.
L’arrivée de l’enfortumab védotin, un ADC comprenant un anticorps ciblant la nectine 4 couplé à une chimiothérapie cytotoxique appartenant à la classe des poisons du fuseau, représentait une évolution importante dans la prise en charge de ces patients.
L’étude EV-301
L’étude EV-301 avait déjà démontré sa supériorité par rapport à la chimiothérapie chez des patients prétraités par chimiothérapie et immunothérapie et conduit à l’obtention d’une AMM européenne, avec la mise en place d’un accès précoce en France dès 2021 (18). Cependant, son indication en première ligne n’avait pas encore été étudiée.
L’étude EV-302
Schéma – L’étude EV-302, une étude de phase III multicentrique, visait à évaluer l’efficacité de l’association enfortumab védotin + pembrolizumab versus chimiothérapie à base de sels de platine (malheureusement sans entretien par durvalumab alors que cela était devenu le standard) chez les patients atteints de carcinomes urothéliaux avancés et/ou métastatiques sans traitement préalable (19).
Au total, 886 patients ont été randomisés et 55 % d’entre eux étaient considérés comme éligibles à une chimiothérapie par cisplatine.
Résultats – Après un suivi médian relativement court de 17,2 mois, les médianes de SG et de SSP ont été doublées dans le bras enfortumab védotin + pembrolizumab par rapport au bras chimiothérapie, passant respectivement de 16,1 à 31,5 mois (HR : 0,47 ; IC 95 % : 0,38-0,58 ; p < 0,001) et de 6,3 à 12,5 mois (HR : 0,45 ; IC 95 % : 0,38-0,54 ; p < 0,001). L’analyse en sous-groupes montre que l’ensemble des patients tire un bénéfice de cette nouvelle association, quels que soient les sites métastatiques, l’éligibilité au cisplatine, le statut PD-L1 (évalué par le score CPS avec un cut-off à 10) ou encore le primitif tumoral (vessie versus haut appareil urinaire).
Tolérance – Les effets secondaires liés au traitement de grade ≥ 3 étaient globalement moins fréquents sous enfortumab védotin + pembrolizumab (69,5 versus 55,9 %). Les effets secondaires les plus fréquents tous grades confondus étaient la neuropathie (50 %), le prurit (40 %) et l’alopécie (33 %). Parmi les effets secondaires de grade ≥ 3, on notait des toxicités cutanées pour 8 % des patients, qu’il va falloir apprendre à dépister et gérer.
L’association enfortumab védotin et pembrolizumab est disponible en accès précoce dans le traitement de première ligne des patients atteints d’un carcinome urothélial non résécable ou métastatique et éligibles à une chimiothérapie à base de sels de platine.
Bifikafusp alfa + onfékafusp alfa / Mélanome localement avancé en récidive ou progression
La prise en charge des mélanomes a été transformée par l’avènement de l’immunothérapie et des thérapies ciblées, d’abord en situation métastatique, puis en adjuvant et, plus récemment, en néoadjuvant. L’utilisation d’injections intra-tumorales d’immunothérapies pourrait permettre d’améliorer l’efficacité des traitements néoadjuvants tout en limitant le risque de toxicités. L’association bifikafusp alfa + onfékafusp alfa résulte de la fusion d’anticorps et de cytokines ciblant l’interleukine 2 et le TNF-alpha ainsi qu’un marqueur de l’angiogenèse exprimé par les cellules de mélanome. Cette association avait déjà été étudiée et avait montré son intérêt dans une étude de phase II (NCT02076633) chez des patients atteints de mélanomes non résécables.
L’étude PIVOTAL
Schéma – L’association bifikafusp alfa + onfékafusp alfa a cette fois-ci été évaluée en situation néoadjuvante dans l’étude PIVOTAL, une étude randomisée de phase III menée chez des patients atteints d’un mélanome localement avancé, résécable, de stade III (20). Le bras expérimental consistait en une injection intra-tumorale suivie de la chirurgie 4 semaines après, tandis que, pour le bras contrôle, il s’agissait d’un simple traitement chirurgical 4 semaines après randomisation. Dans les deux bras, il existait la possibilité d’un traitement adjuvant standard.
Résultats – Les résultats présentés à l’ASCO 2024 concernant 256 patients sont en faveur de l’association bifikafusp alfa + onfékafusp alfa avec une médiane de survie sans récidive (SSR) passant de 6,9 à 16,7 mois, soit un hazard ratio à 0,59 (IC 95 % : 0,41-0,86 ; p = 0,005). De même, la survie sans métastase était améliorée dans le bras expérimental (HR : 0,60 ; IC 95 % : 0,37-0,95). Par ailleurs, le taux de réponse complète sur la pièce opératoire dans le bras expérimental était de 21 %.
Tolérance – Il est à noter que la tolérance du traitement était très bonne, avec essentiellement des événements locaux, dont une majorité de faible grade.
L’association bifikafusp et onfékafusp est disponible en accès compassionnel dans le traitement néoadjuvant par voie intra-lésionnelle des patients atteints d’un mélanome localement avancé en récidive ou progression pendant ou après au moins un traitement adjuvant systémique et non éligibles à un nouveau traitement adjuvant.
Dinutuximab bêta / Neuroblastome à haut risque en rechute/progression
La prise en charge des neuroblastomes récidivants/réfractaires chez les enfants reste un enjeu majeur en oncologie pédiatrique. Le traitement repose sur la chimiothérapie avec une association d’irinotécan et de témozolomide, mais il était nécessaire de tester l’apport de thérapies ciblées pour améliorer les résultats.
Le dinutuximab bêta est un anticorps monoclonal chimérique de type IgG1 qui réagit spécifiquement avec les groupements GD2 qui sont fortement exprimés à la surface des cellules de neuroblastome. Plusieurs études se sont intéressées à l’association du dinutuximab bêta à la chimiothérapie dans les neuroblastomes récidivants/réfractaires, notamment l’étude COG ANBL1221, et plus récemment l’étude BEACON, deux études randomisées de phase II (21, 22).
L’étude BEACON
Schéma – Pour l’étude BEACON, une randomisation avec un rapport à 2/1 a été réalisée pour recevoir une chimiothérapie seule ou bien en association, avec dinutuximab bêta. Il est à noter que l’essai avait un plan factoriel avec également une randomisation entre deux schémas de chimiothérapie. Un total de 65 patients a été randomisé.
Résultats – Le TRO (critère de jugement principal) était significativement augmenté avec l’ajout du dinutuximab bêta, passant de 18 à 35 % (p = 0,19 pour un objectif < 0,23). On notait par ailleurs une tendance à l’amélioration de la SSP avec un hazard ratio à 0,63 (IC 95 % : 0,32-1,25), sans effet sur la SG.
Tolérance – Dans l’ensemble, le traitement expérimental était légèrement plus toxique avec un taux de toxicités de grade ≥ 3 passant de 30 à 41%, avec essentiellement des toxicités neurologiques.
Le dinutuximab bêta est disponible en association à la chimiothérapie d’induction via un cadre de prescription compassionnelle dans le traitement des patients âgés d’au moins 12 mois atteints d’un neuroblastome à haut risque en première ou seconde rechute/progression.
Selpercatinib / Carcinome médullaire de la thyroïde avancé RET muté
Les cancers médullaires de la thyroïde sont des tumeurs neuroendocrines dépendant dans environ 40 % d’une altération de RET (principalement mutations contrairement aux CBNPC qui mettent en jeu des translocations de RET). Cette mutation peut être constitutionnelle (dans le cadre d’une néoplasie endocrinienne multiple) ou bien somatique. Le traitement des cancers médullaires de la thyroïde avancés reposait jusqu’à présent sur le vandétanib et le cabozantinib, deux inhibiteurs de kinase multicibles, ciblant notamment RET, mais de façon partielle. Le selpercatinib est le premier inhibiteur spécifique de RET. Il était donc logique de l’évaluer chez ces patients.
L’étude LIBRETTO-531
Schéma – L’étude LIBRETTO-531 était un essai randomisé de phase III comparant le selpercatinib au traitement choisi par l’investigateur, parmi le cabozantinib et le vandétanib, chez des patients présentant un cancer médullaire de la thyroïde avec mutation de RET et naïfs de traitement systémique (23).
Au total, 291 patients ont été inclus, ce qui représente un effort important pour cette maladie rare. Les deux tiers des patients présentaient la mutation M918T et les trois quarts des patients du groupe contrôle recevaient du cabozantinib.
Résultats – L’objectif principal de SSP a été atteint avec un hazard ratio de 0,28 (IC 95 % : 0,16-0,48) et une médiane non atteinte dans le groupe selpercatinib contre 16,8 mois (IC 95 % : 12,2-25,1) dans le groupe contrôle. Le taux de SSP à 24 mois était de 76 % dans le groupe selpercatinib contre 37 % dans le groupe contrôle. Le TRO était également supérieur, passant de 39 à 69 %. Les données de SG ne sont pas encore matures, mais les courbes semblent déjà se détacher sur les premières données rapportées.
Tolérance – Elle est également améliorée, avec un taux d’événements de grade ≥ 3 de 53 % dans le groupe selpercatinib contre 76 % avec le cabozantinib/vandétanib. Les principales toxicités du selpercatinib sont des perturbations du bilan hépatique, des troubles digestifs, de l’hypertension et des œdèmes.
Le selpercatinib était disponible en accès précoce comme traitement de première ligne des patients atteints d’un carcinome médullaire de la thyroïde avancé présentant une mutation du gène RET. Il est depuis décembre disponible en pharmacie de ville.
Conclusion
Avec ces nouvelles indications disponibles en 2024, l’arsenal thérapeutique de l’oncologue continue de s’étoffer. De façon rassurante, de nombreuses indications auparavant disponibles en accès dérogatoire ont rejoint le droit commun, assurant un accès pérenne pour nos patients. Ces succès ne doivent cependant pas faire oublier les contraintes financières qui risquent de remettre en cause la soutenabilité du modèle français auquel nous sommes attachés.
Les auteurs n’ont pas déclaré de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Martin T, Rioufol C, Favier B et al. Impact of early access reform on oncology innovation in france: approvals, patients, and costs. BioDrugs Clin Immunother Biopharm Gene Ther 2024 ; 38 : 465‑75.
2. Levêque D, Beck M, Cotton M. Dispensation for access to novel anticancer agents in France. Lancet Oncol 2023 ; 24 : 719‑20.
3. Lu S, Kato T, Dong X et al. Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024 ; 391 : 585‑97.
4. Passaro A, Wang J, Wang Y et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024 ; 35 : 77‑90.
5. Zhou C, Tang KJ, Cho BC et al. Amivantamab plus chemotherapy in NSCLC with EGFR exon 20 insertions. N Engl J Med 2023 ; 389 : 2039‑51.
6. Wu YL, Dziadziuszko R, Ahn JS et al. Alectinib in resected ALK-positive non–small-cell lung cancer. N Engl J Med 2024 ; 390 : 1265‑76.
7. Zhou C, Solomon B, Loong HH et al. First-line selpercatinib or chemotherapy and pembrolizumab in RET fusion-positive NSCLC. N Engl J Med 2023 ; 389 : 1839‑50.
8. Heymach J, Opdam F, Barve MA et al. Phase Ia/Ib trial of zongertinib (BI 1810631), a HER2-specific tyrosine kinase inhibitor (TKI), in patients (pts) with HER2 aberration-positive solid tumors: Updated Phase Ia data from Beamion LUNG-1, including progression-free survival (PFS) data. J Clin Oncol 2024 ; 42 : 8514.
9. Cheng Y, Spigel DR, Cho BC et al. Durvalumab after chemoradiotherapy in limited-stage small-cell lung cancer. N Engl J Med 2024 ; 391 : 1313‑27.
10. Moore KN, Oza AM, Colombo N et al. Phase III, randomized trial of mirvetuximab soravtansine versus chemotherapy in patients with platinum-resistant ovarian cancer: primary analysis of FORWARD I. Ann Oncol 2021 ; 32 : 757‑65.
11. Moore KN, Angelergues A, Konecny GE et al. Mirvetuximab soravtansine in FRα-positive, platinum-resistant ovarian cancer. N Engl J Med 2023 ; 389 : 2162‑74.
12. Mellinghoff IK, Ellingson BM, Touat M et al. Ivosidenib in Isocitrate dehydrogenase 1–mutated advanced glioma. J Clin Oncol 2020 ; 38 : 3398‑406.
13. Kilburn LB, Khuong-Quang DA, Hansford JR et al. The type II RAF inhibitor tovorafenib in relapsed/refractory pediatric low-grade glioma: the phase 2 FIREFLY-1 trial. Nat Med 2024 ; 30 : 207‑17.
14. Mellinghoff IK, Penas-Prado M, Peters KB et al. Vorasidenib, a dual inhibitor of mutant IDH1/2, in recurrent or progressive glioma; results of a first-in-human phase I trial. Clin Cancer Res 2021 ; 27 : 4491‑9.
15. Mellinghoff IK, Bent MJ van den, Blumenthal DT et al. Vorasidenib in IDH1- or IDH2-mutant low-grade glioma. N Engl J Med 2023 ; 389 : 589‑601.
16. Dasari A, Lonardi S, Garcia-Carbonero R et al. Fruquintinib versus placebo in patients with refractory metastatic colorectal cancer (FRESCO-2): an international, multicentre, randomised, double-blind, phase 3 study. Lancet 2023 ; 402 : 41‑53.
17. Harding JJ, Fan J, Oh DY et al. Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZON-BTC-01): a multicentre, single-arm, phase 2b study. Lancet Oncol 2023 ; 24 : 772‑82.
18. Powles T, Rosenberg JE, Sonpavde GP et al. Enfortumab vedotin in previously treated advanced urothelial carcinoma. N Engl J Med 2021 ; 384 : 1125‑35.
19. Powles T, Valderrama BP, Gupta S et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024 ; 390 : 875‑88.
20. Hauschild A, Hassel JC, Ziemer M et al. Phase 3 study (PIVOTAL) of neoadjuvant intralesional daromun vs. immediate surgery in fully resectable melanoma with regional skin and/or nodal metastases. J Clin Oncol 2024 ; 42 : LBA9501.
21. Gray J, Moreno L, Weston R et al. BEACON-Immuno: Results of the dinutuximab beta (dB) randomization of the BEACON-Neuroblastoma phase 2 trial – A European Innovative Therapies for Children with Cancer (ITCC–International Society of Paediatric Oncology Europe Neuroblastoma Group (SIOPEN) trial. J Clin Oncol 2022 ; 40 : 10002.
22. Mody R, Naranjo A, Van Ryn C et al. Irinotecan–temozolomide with temsirolimus or dinutuximab in children with refractory or relapsed neuroblastoma (COG ANBL1221): an open-label, randomised, phase 2 trial. Lancet Oncol 2017 ; 18 : 946‑57.
23. Hadoux J, Elisei R, Brose MS et al. Phase 3 trial of selpercatinib in advanced RET-mutant medullary thyroid cancer. N Engl J Med 2023 ; 389 : 1851‑61.