Comme chaque année, nous vous proposons un tour d’horizon des nouvelles molécules disponibles en oncologie. La recherche clinique reste active avec de nouveaux traitements accessibles cette année pour nos patients. La dynamique reste forte du côté des thérapies ciblées, de l’immunothérapie et des anticorps conjugués qui deviennent incontournables.
Les informations présentées dans ce dossier ont été rédigées selon les disponibilités en date du 31 décembre 2023.
Résumé
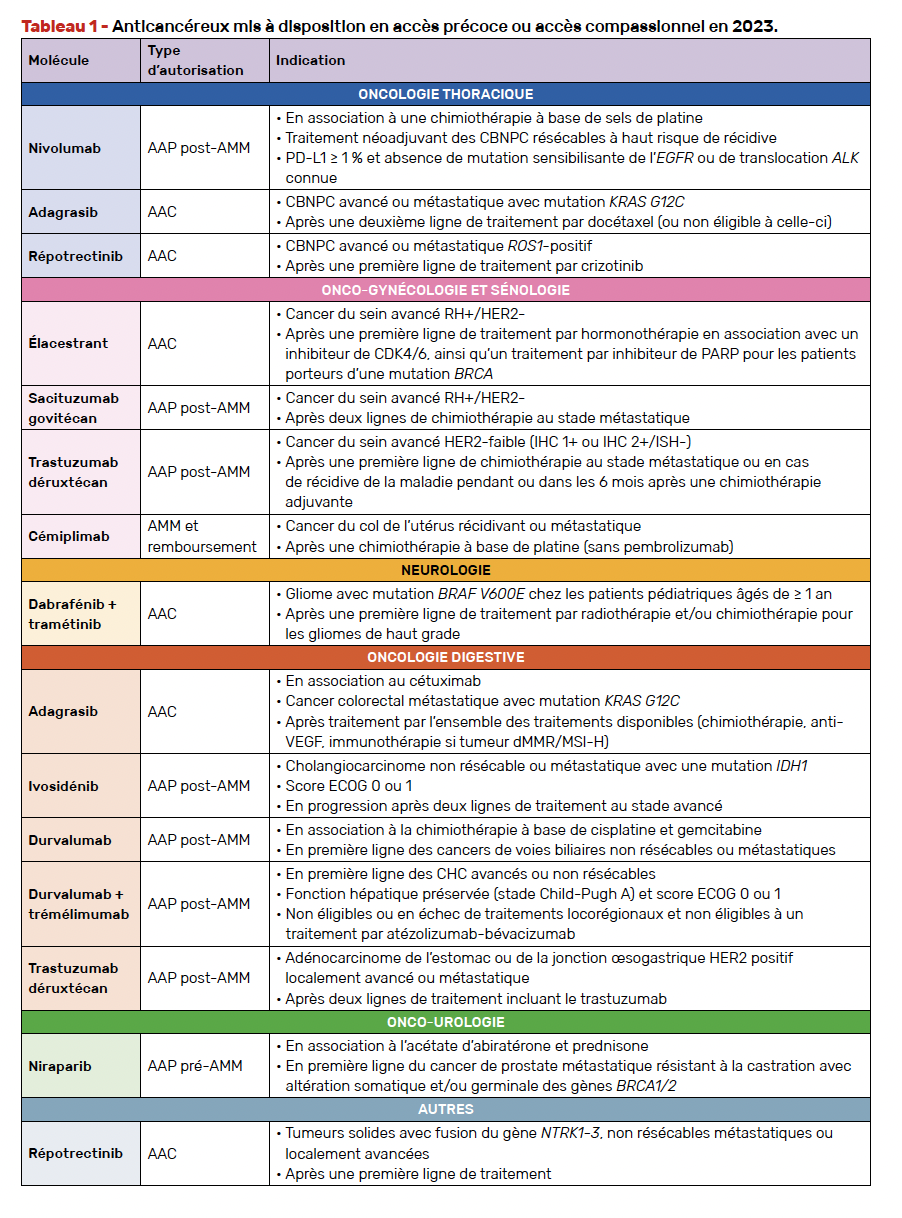
Durant l’année 2023, sept molécules ont été mises à disposition via une autorisation d’accès compassionnel (AAC) et deux molécules via une autorisation d’accès précoce (AAP). Parmi les molécules déjà disponibles dans le cadre d’AAP ou d’AAC, six ont bénéficié d’une autorisation de mise sur le marché (AMM) et restent disponibles dans le cadre d’une AAP “post-AMM” tandis que huit sont désormais inscrites sur la liste en sus et donc remboursées en droit commun. Cependant, d’autres molécules comme le sotorasib ont vu leur renouvellement refusé.
Abstract
Anticancer treatments available to the oncologist in 2023 in France.
During the year 2023, seven molecules were made available through compassionate access authorization (AAC) and two molecules through early access authorization (AAP). Among the molecules already available under AAP or AAC, six have been granted marketing authorization (AMM) and remain available under a «post-AMM» AAP, while eight others have been included on the supplementary list and thus reimbursed. However, others drugs including sotorasib had their renewal refused.
Introduction
Les dispositifs de mise à disposition des traitements
L’accès à l’innovation pour tous les patients est l’une des priorités des différents plans cancer. Cependant, les procédures d’autorisation de mise sur le marché (AMM) et surtout de remboursement restent longues et complexes. Pour accélérer la mise à disposition des traitements innovants, un accès dérogatoire peut être accordé par les autorités de santé. Pour rappel, depuis la réforme de 2021, deux grands cadres ont été mis en place (se référer au numéro de décembre 2021 pour plus de détails).
• L’accès compassionnel (AAC) concerne les médicaments non destinés à être commercialisés dans l’indication concernée (pas de démarche en cours en vue d’une AMM) et comprend deux sous-catégories :
- le cadre de prescription compassionnel (CPC, qui remplace les RTU) encadre la prescription d’un médicament non conforme à son AMM. Cette autorisation est octroyée par l’ANSM pour une durée de 3 ans renouvelables ;
- l’autorisation d’accès compassionnel (AAC, qui remplace l’ATU nominative) a pour vocation l’accès à un médicament qui ne possède pas d’AMM et dont le laboratoire n’a pas prévu la commercialisation en France. Elle est demandée à l’initiative d’un prescripteur pour un patient donné. La durée d’une AAC est de 1 an renouvelable.
• L’accès précoce (AAP), qui remplace les ATU de cohorte, concerne les médicaments destinés à être commercialisés dans l’indication concernée. Il est octroyé par la HAS à la demande du laboratoire pour une durée de 1 an renouvelable. Il peut être demandé avant l’obtention de l’AMM (AAP pré-AMM), mais également après l’obtention de celle-ci (AAP post-AMM), pour les médicaments dont le remboursement n’est pas encore fixé.
L’ensemble des spécialités disponibles dans le cadre de ces dispositifs est listé sur le site de l’ANSM : ansm.sante.fr/documents/reference/referentiel-des-specialites-en-acces-derogatoire. Nous détaillons dans cet article l’ensemble des traitements anticancéreux qui ont été rendus accessibles en 2023 (Tab. 1).
Les remboursements obtenus en 2023
Par ailleurs, nous pouvons nous réjouir du remboursement pérenne cette année de plusieurs traitements auparavant disponibles en accès dérogatoire :
• le nivolumab en traitement adjuvant des cancers de l’œsophage ou de la jonction œsogastrique présentant une maladie résiduelle après radio-chimiothérapie et ayant bénéficié d’une résection complète ;
• le nivolumab en association à la chimiothérapie à base de 5-FU et platine en traitement de première ligne des adénocarcinomes œsogastriques HER2-négatifs PD-L1+ avec un CPS ≥ 5 % ;
• le nivolumab en traitement adjuvant du carcinome urothélial infiltrant le muscle à haut risque de récidive après résection complète avec PD-L1 ≥ 1 % ;
• l’amivantamab dans le cancer bronchique non à petites cellules avancé avec insertion dans l’exon 20 d’EGFR après chimiothérapie à base de platine ;
• le durvalumab en association à une chimiothérapie par platine et étoposide dans le cancer bronchique à petites cellules à un stade étendu ;
• le pembrolizumab en association à une chimiothérapie avec ou sans bévacizumab dans le cancer du col utérin persistant, récidivant ou métastatique, PD-L1+ avec un CPS ≥ 1 % ;
• le pembrolizumab en association à une chimiothérapie dans le cancer du sein triple négatif PD-L1+ avec un CPS ≥ 10 %, en première ligne de traitement ;
• le tucatinib en association avec le trastuzumab et la capécitabine dans le cancer du sein HER2+ avancé après deux lignes de traitement anti-HER2.
Les remboursements perdus en 2023
A contrario, l’année 2023 a également vu certains médicaments perdre leur prise en charge financière suite à leur évaluation défavorable par la commission de la transparence de la HAS. Ainsi :
• le sotorasib, jusqu’ici disponible en accès précoce dans le cancer bronchique non à petites cellules avancé avec mutation KRAS G12C, a vu son renouvellement refusé par la commission de la transparence de la HAS, au motif que le gain en survie sans progression face au docétaxel en deuxième ligne n’était pas cliniquement pertinent ;
• le poziotinib, jusqu’ici disponible en accès compassionnel dans le cancer bronchique non à petites cellules avancé avec mutation de l’exon 20 d’EGFR, a vu son développement interrompu dans cette indication.
Nivolumab / Cancer bronchique non à petites cellules localisé
Après un développement au stade métastatique puis en traitement d’entretien après radio-chimiothérapie dans les stades localement avancés, les immunothérapies poursuivent leur développement dans le cancer bronchique non à petites cellules (CBNPC) au stade localisé avec pas moins de six études de phase III en situation néoadjuvante/péri-opératoire.
L’étude CheckMate 816
Schéma – L’étude randomisée de phase III CheckMate 816 a évalué l’intérêt d’adjoindre le nivolumab à une chimiothérapie néoadjuvante à base de sels de platine chez des patients présentant un CBNPC résécable de stades IB à IIIA, sans altération moléculaire actionnable (1). Elle a inclus 358 patients, avec près de deux tiers de stades IIIA et une répartition quasiment équivalente entre les épidermoïdes et les non-épidermoïdes. Concernant le statut PD-L1, 27 % présentaient une expression entre 1 et 49 % et 22 % à plus de 50 %.
Résultats – Cette étude est positive sur ses deux critères de jugement principaux avec un pourcentage de réponse pathologique complète passant de 2,2 à 24 % avec l’ajout du nivolumab et une amélioration de la médiane de survie sans événement passant de 20,8 à 31,6 mois (HR = 0,63 ; IC 97 % = 0,43-0,91 ; p = 0,005). Les analyses en sous-groupes suggèrent que les patients présentant des stades IIIA et les tumeurs PD-L1+ tirent le plus grand bénéfice de l’immunothérapie néoadjuvante.
Tolérance – Les toxicités sont celles attendues avec un anti-PD1 et surtout le projet chirurgical n’était pas empêché par l’immunothérapie néoadjuvante.
Cette stratégie va radicalement changer le parcours de soins de nos patients, avec la nécessité désormais de réaliser une biopsie systématique avec recherche d’altérations moléculaires et évaluation du statut PD-L1 pour toutes les tumeurs de stade au moins IB.
Le nivolumab est disponible en AAP en association à une chimiothérapie à base de sels de platine dans le traitement néoadjuvant des patients atteints d’un cancer bronchique non à petites cellules résécable à haut risque de récidive, dont les tumeurs expriment PD-L1 au seuil ≥ 1 % et ne présentent pas de mutation sensibilisante de l’EGFR, ni de translocation ALK connue.
Adagrasib / Cancer bronchique non à petites cellules avancé ou métastatique avec mutation KRAS G12C
Les mutations du gène KRAS étaient considérées comme non actionnables jusqu’au développement récent d’inhibiteurs spécifiques d’une mutation portée par le codon 12 (KRAS G12C) : le sotorasib et l’adagrasib. Ces mutations KRAS G12C concernent environ 15 % des patients présentant un CBNPC et constituent donc une cible intéressante.
L’étude KRYSTAL-1
Schéma – L’étude KRYSTAL-1 est une étude de phase I/II visant à évaluer la tolérance et l’efficacité de l’adagrasib seul ou associé à d’autres traitements systémiques chez des patients atteints de tumeurs solides avec mutation de KRAS G12C. Les résultats préliminaires de la cohorte poumon ont conduit à une cohorte d’expansion, évaluant l’adagrasib en monothérapie chez 116 patients présentant un CBNPC avancé prétraité par chimiothérapie et immunothérapie (2).
Résultats – Le taux de réponse objectif (critère de jugement principal) était de 43 %, la médiane de survie sans progression de 6,5 mois et la médiane de survie globale de 12,6 mois. Parmi les patients présentant des métastases cérébrales, le taux de réponse intracrânienne était de 33 %. Les analyses translationnelles exploratoires suggèrent en revanche une moindre efficacité chez les patients présentant des co-mutations de KEAP1, dont on connaît également l’effet défavorable sur la réponse à l’immunothérapie.
Tolérance – Le profil de tolérance était marqué par des troubles digestifs (nausées et cytolyse) et une asthénie parfois invalidante, conduisant à des réductions de doses chez plus de 50 % des patients.
L’adagrasib est disponible en AAC dans le traitement du cancer bronchique non à petites cellules avancé ou métastatique avec mutation KRAS G12C, ayant reçu une deuxième ligne de traitement par docétaxel (ou non éligible à celle-ci). Il constitue donc une alternative au moins temporaire au sotorasib qui n’est malheureusement plus disponible dans cette indication.
Répotrectinib / Cancer bronchique non à petites cellules avancé ROS1+
Les altérations drivers de ROS1 concernent environ 1 à 2 % des CBNPC avancés, principalement chez des patients jeunes et non fumeurs. Le traitement de référence en première ligne repose sur le crizotinib, un inhibiteur de tyrosine kinase (TKI) de première génération. Cependant, la diffusion intra-cérébrale de ce traitement est limitée et son efficacité est restreinte par l’apparition quasi inévitable de mutations de résistance, notamment la mutation G2032R. Pour faire face à ces limites, plusieurs TKI de nouvelle génération ont été évalués, notamment le lorlatinib et l’entrectinib.
L’étude TRIDENT-1
Plus récemment, le repotrectinib, un TKI ciblant ROS1 et NTRK, a été évalué au sein de l’étude TRIDENT-1.
Schéma – Il s’agit d’une étude de phase I-II comportant notamment quatre cohortes de patients atteints de CBNPC avec fusion de ROS1. Des données d’efficacité ont été rapportées chez 71 patients naïfs de TKI et 56 patients prétraités par TKI (principalement crizotinib) (3).
Résultats – Le taux de réponse était de 79 % chez les patients naïfs et de 38 % chez les patients prétraités, tandis que la médiane de survie sans progression était de 35,7 mois chez les patients naïfs contre 9,0 mois chez les patients prétraités.
Tolérance – Le profil de tolérance était marqué par des troubles
neurologiques, en particulier des vertiges, avec nécessité de réductions de doses chez 38 % des patients, mais seulement 7 % d’interruption pour toxicité.
Le répotrectinib est disponible en AAC dans le cancer bronchique non à petites cellules avancé ou métastatique ROS1+, chez les patients ayant déjà reçu une première ligne de traitement par crizotinib.
Élacestrant / Cancer du sein localement avancé ou métastatique RH+/HER2-
L’élacestrant est un inhibiteur sélectif des récepteurs aux œstrogènes (SERD) qui a la particularité d’être administré par voie orale.
L’étude EMERALD
Schéma – L’essai de phase III EMERALD comparait la prise orale d’élacestrant à une hormonothérapie au choix de l’investigateur (fulvestrant ou inhibiteur de l’aromatase) chez 478 hommes et femmes ménopausées porteurs de cancers mammaires RH+/HER2, ayant progressé sous au moins une ligne d’hormonothérapie (40 % des patients en avaient reçu deux) et inhibiteur de CDK4/6 (4).
Résultats – L’étude est positive sur son critère de jugement principal avec une réduction du risque de progression ou de décès de 30 % (HR = 0,70 ; IC 95 % = 0,55-0,88 ; p = 0,0018) et 22,3 % de patients non progresseurs à 12 mois sous élacestrant contre 9,4 % dans le groupe contrôle. Le bénéfice semblait plus important chez les patients présentant une mutation d’ESR1 (évaluée sur ADN tumoral circulant), avec un hazard ratio à 0,55 dans ce sous-groupe qui représentait quasiment 50 % de la population. En revanche, l’étude ne permet pas de montrer un gain en survie globale.
Tolérance – Le profil de tolérance de l’élacestrant est similaire à celui des hormonothérapies standard avec des arthromyalgies, des dyslipidémies, une asthénie et des troubles digestifs, peut-être un peu plus marqués pour ces derniers avec près de 20 % de nausées.
L’élacestrant est disponible en AAP dans le traitement du cancer du sein localement avancé ou métastatique, RH+/HER2-, chez les femmes ménopausées et les hommes ayant progressé après au moins une ligne d’hormonothérapie en association avec un inhibiteur des CDK4/6, ainsi qu’un traitement par inhibiteur de PARP pour les patients porteurs d’une mutation BRCA.
Sacituzumab govitécan / Cancer du sein RH+/HER2- non résécable ou métastatique
Le sacituzumab govitécan est un anticorps drogue conjugué (ADC) combinant un anticorps dirigé contre Trop-2 (le sacituzumab) et sept ou huit molécules SN38, une chimiothérapie de type anti-topo-isomérase I.
L’étude TROPiCS-02
Schéma – L’étude de phase III randomisée en ouvert TROPiCS-02 comparait l’administration de sacituzumab govitécan à l’administration d’une chimiothérapie au choix de l’investigateur (parmi éribuline, vinorelbine, gemcitabine et capécitabine) chez 543 patients atteints de cancer du sein RH+/HER2- (défini comme IHC ≤ 2 ou FISH négative) localement avancé non résécable ou métastatique, ayant reçu au moins deux lignes de chimiothérapie antérieures pour une maladie métastatique (5).
Résultats – L’étude est statistiquement significative sur son critère de jugement principal de survie sans progression avec une médiane passant de 4,0 à 5,5 mois (p = 0,0003). La survie globale est elle aussi augmentée à 14,4 versus 11,2 mois (HR = 0,79 ; IC 95 % = 0,65-0,96 ; p = 0,020) et le taux de réponse objective passe de 38 à 57 %.
Par ailleurs, le remplissage systématique par les patients des questionnaires de qualité de vie QLQ-C30 a pu mettre en évidence un délai significativement plus long avant la première détérioration de l’état de santé global chez les patients recevant le sacituzumab govitécan.
Tolérance – Le profil de toxicité du traitement est semblable aux toxicités attendues avec une chimiothérapie classique (toxicité hématologique, diarrhée, nausée, vomissement, alopécie). À noter que le SN38 (molécule libérée après la liaison d’ADC sur sa cible) est métabolisé par l’UGT1A1 (enzyme uridine diphosphate glucuronosyl transférase). Certains variants du gène de l’UGT1A1 tels que l’UGT1A1*28 sont associés à une activité réduite de cette enzyme. Les sujets homozygotes pour l’allèle UGT1A1*28 ont un risque accru d’effet indésirable (10 % de la population caucasienne). Il n’est pas nécessaire cependant de rechercher cette variante allélique, mais si elle est connue chez un patient, une surveillance accrue de la survenue d’effets indésirables doit être pratiquée.
Ce traitement était déjà disponible en AAP depuis 2021, il bénéficie désormais d’une AAP post-AMM en monothérapie pour le traitement des patients adultes atteints d’un cancer du sein RH+/HER2- non résécable ou métastatique, ayant reçu au moins deux lignes de chimiothérapie au stade métastatique.
Trastuzumab déruxtécan / Cancer du sein HER2-faible non résécable ou métastatique
Le trastuzumab déruxtécan (TDXd) est un anticorps conjugué contenant un anticorps monoclonal anti-HER2 (le trastuzumab) lié de façon covalente au déruxtécan, un inhibiteur de la topoisomérase I. Environ huit molécules de déruxtécan sont liées à chaque molécule d’anticorps. Le TDXd avait déjà obtenu l’AMM pour le traitement en monothérapie des cancers du sein HER2+ métastatiques en 2022, puis a été développé dans les cancers du sein HER2 faibles (IHC 1+ ou IHC 2+/ISH-).
L’étude DESTINY-Breast 04
Schéma – L’étude DESTINY-Breast 04 est un essai randomisé multicentrique de phase III comparant l’administration de trastuzumab déruxtécan à une chimiothérapie laissée au choix de l’investigateur (capécitabine, éribuline, gemcitabine, paclitaxel ou nab-paclitaxel) chez 557 adultes atteints d’un cancer du sein HER2-faible non résécable ou métastatique qui ont reçu au moins une ligne de chimiothérapie au stade métastatique ou qui ont développé une récidive de la maladie pendant ou dans les 6 mois suivant la fin d’une chimiothérapie adjuvante (6, 7). Les patients atteints d’un cancer du sein avec des récepteurs hormonaux positifs (494 patients, soit 88,7 % des patients de l’étude) devaient aussi avoir reçu au moins une ligne d’hormonothérapie et être non éligibles à une nouvelle ligne d’hormonothérapie.
Résultats – L’étude est positive sur la survie sans progression, critère de jugement principal, avec une survie sans progression médiane de 8,8 versus 4,2 mois dans le groupe chimiothérapie (HR = 0,36 ; IC 95 % = 0,29-0,45 ; p < 0,001). La survie globale était elle aussi augmentée, passant de 16,8 à 22,9 mois dans le groupe TDXd (HR = 0,69 ; IC 95 % = 0,55-0,86 ; p = 0,001).
Tolérance – On observe une moindre toxicité du TDXd avec des effets indésirables de grade ≥ 3 chez 52,6 % des patients versus 67,4 % des patients dans le groupe chimiothérapie.
Ce traitement était déjà disponible en AAP depuis 2022, il bénéficie désormais d’une AAP post-AMM en monothérapie pour le traitement des patients adultes atteints d’un cancer du sein HER2-faible (IHC 1+ ou IHC 2+/ISH-) non résécable ou métastatique après une première ligne de chimiothérapie.
Cémiplimab / Cancer du col de l’utérus récidivant ou métastatique
La première ligne thérapeutique des stades avancés et métastatiques des cancers du col utérin qui reposait sur une chimiothérapie par cisplatine et paclitaxel ± associée au bévacizumab s’est enrichie à partir de 2022 de l’association au pembrolizumab dans les cancers exprimant le PD-L1 (CPS ≥ 1).
Le cémiplimab, un autre inhibiteur de PD-1, précédemment développé dans les carcinomes cutanés ainsi que dans les CBNPC a été évalué en deuxième ligne dans les cancers du col utérin.
L’étude EMPOWER-Cervical1
Schéma – L’étude de phase III, randomisée en ouvert, EMPOWER-Cervical1, comparait le cémiplimab à une chimiothérapie laissée au choix de l’investigateur (gemcitabine, pémétrexed, vinorelbine, topotécan ou irinotécan), dans le traitement du cancer du col de l’utérus récidivant, persistant ou métastatique, ayant progressé ou récidivé après un traitement par sels de platine ± bévacizumab (8). 608 patientes ont été incluses dans l’étude, indépendamment de leur statut PD-L1.
Résultats – Le critère de jugement principal était la survie globale avec une médiane de 12,0 versus 8,5 mois (HR = 0,69 ; IC 95 % = 0,56-0,84 ; p = 0,0001) en faveur du cémiplimab.
Tolérance – Les données de tolérance concernant le cémiplimab confirment les effets indésirables d’origine immunologique déjà connus sous ce traitement.
À noter que le pembrolizumab, qui a obtenu une AMM en 2022 en première ligne, n’était pas disponible à la date de réalisation de cette étude. De ce fait, l’évolution de la stratégie thérapeutique avec l’intégration de l’immunothérapie dès la première ligne, en cas d’expression tumorale de PD-L1, génère un décalage entre le profil des patientes de l’étude non exposées au pembrolizumab et celui en pratique clinique en France.
Le cémiplimab est désormais indiqué en monothérapie dans le traitement des patientes adultes atteintes d’un cancer du col de l’utérus récidivant ou métastatique et présentant une progression pendant ou après une chimiothérapie à base de platine. Il n’est remboursé que s’il n’y a pas eu au préalable de traitement par pembrolizumab. On peut donc s’attendre à ce qu’il soit utilisé principalement chez les patientes présentant une tumeur PD-L1-, alors que ce sous-groupe ne semblait pas tirer de bénéfice du cémiplimab dans cette étude.
Dabrafénib + tramétinib / Gliome pédiatrique avec mutation BRAF V600E
Les mutations oncogéniques de BRAF conduisent à une activation constitutive de la voie de signalisation RAS/RAF/MEK/ERK dans de nombreux modèles tumoraux, et notamment 15-20 % des gliomes pédiatriques. Dans cette pathologie, les mutations BRAF V600E sont associées à une moins bonne réponse à la chimiothérapie qui est le traitement de référence en complément de la chirurgie (association vincristine + carboplatine pour les gliomes de bas grade, association radiothérapie + témozolomide dans les gliomes de haut grade).
L’association entre le dabrafénib (inhibiteur de RAF kinases) et le tramétinib (inhibiteur hautement sélectif de MEK) permet d’inhiber la cascade de signalisation activée dans les mutations oncogéniques de BRAF. Cette association a été évaluée dans les gliomes pédiatriques dans une étude de phase II (CDRB436A2201), comportant plusieurs cohortes.
La cohorte comparative
Schéma – Une cohorte comparative incluait 110 enfants et adolescents atteints d’un gliome de bas grade muté BRAF V600E nécessitant un traitement systémique, avec randomisation 2:1 entre l’association dabrafénib + tramétinib et une chimiothérapie par vincristine + carboplatine (9).
Résultats – Le traitement ciblé a montré une amélioration significative du taux de réponse objective (47 versus 11 % ; p < 0,001) qui était le critère de jugement principal, mais également de la survie sans progression avec une médiane de 20,1 versus 7,4 mois (HR = 0,31 ; IC 95 % = 0,17-0,55 ; p < 0,001).
La cohorte non comparative
Schéma – Une cohorte non comparative évaluait quant à elle l’association dabrafénib + tramétinib chez 41 enfants et adolescents atteints d’un gliome de haut grade muté BRAF V600 réfractaire ou en rechute (10).
Résultats – Le taux de réponse (critère de jugement principal) était de 56,1 % et la médiane de survie globale de 32,8 mois.
Tolérance – Le profil de tolérance de l’association dabrafénib + tramétinib était similaire à celui déjà connu chez l’adulte, marqué notamment par la survenue fréquente de fièvre avec risque de déshydratation, d’éruptions cutanées, mais également d’événements hémorragiques.
L’association dabrafénib + tramétinib bénéficie d’un AAP dans le traitement des patients pédiatriques âgés de 1 an et plus atteints d’un gliome avec mutation BRAF V600E. Les patients présentant un gliome de haut grade doivent avoir reçu au moins une ligne de traitement antérieur par radiothérapie et/ou chimiothérapie.
Adagrasib / Cancer colorectal métastatique avec mutation KRAS G12C
Le gène KRAS est impliqué dans la carcinogenèse de la plupart des cancers colorectaux et confère une résistance aux thérapies ciblant les récepteurs EGFR. Parmi l’ensemble des mutations de KRAS, 15 à 20 % concernent la mutation KRAS G12C, dont l’effet pronostique défavorable est encore plus marqué que les autres mutations.
L’étude KRYSTAL-1
Schéma – Au sein de l’étude de phase I/II KRYSTAL-1, évoquée ci-dessus dans les CBNPC, deux cohortes visaient à évaluer l’efficacité et la tolérance d’un traitement par adagrasib seul (n = 44) ou associé au cétuximab (n = 32) chez des patients présentant un cancer colorectal KRAS G12C métastatique prétraité par chimiothérapie (11).
Résultats – Le taux de réponse objectif (critères de jugement principal) était de 23 % en monothérapie et de 46 % avec le cétuximab, tandis que les médianes de survie sans progression étaient de 5,6 et 6,9 mois, respectivement.
Tolérance – Les principales toxicités sont d’ordre digestif et hématologique, avec nécessité de réductions de doses chez près de 40 % des patients.
L’adagrasib est disponible en association au cétuximab en accès compassionnel depuis le 20 avril 2023 pour le traitement du cancer colorectal métastatique avec mutation KRAS G12C, ayant reçu l’ensemble des traitements disponibles (notamment chimiothérapie, anti-VEGF, immunothérapie si tumeur dMMR/MSI-H).
Durvalumab / Cancer des voies biliaires non résécable ou métastatique
Le traitement de première ligne des cancers avancés des voies biliaires reposait jusqu’à récemment sur une chimiothérapie par cisplatine gemcitabine.
L’étude TOPAZ-1
L’étude de phase III TOPAZ-1 avait démontré le bénéfice de l’association d’une immunothérapie par durvalumab à la chimiothérapie, avec un gain en survie globale qui avait conduit à un accès précoce (12).
Résultats actualisés – Les résultats actualisés de l’étude, avec une durée médiane de suivi de près de 2 ans, confirment ce bénéfice en survie globale avec une médiane passant de 11,3 à 12,9 mois avec l’ajout du durvalumab (HR = 0,76 ; IC 95 % = 0,64-0,91) (13). De façon intéressante, on note un plateau avec près de 35 % de patients vivant à 18 mois avec le durvalumab, mais aucun marqueur prédictif n’a pu être identifié jusqu’à présent (14).
Après avoir été disponible en accès précoce, le durvalumab dispose désormais d’une AMM et est disponible dans le cadre d’une AAP “post-AMM” dans l’attente de son remboursement. L’indication reste la même, à savoir le traitement de première ligne des cancers des voies biliaires non résécables ou métastatiques, en association à la chimiothérapie à base de cisplatine et gemcitabine.
Ivosidénib / Cholangiocarcinome avancé non résécable ou métastatique avec une mutation IDH1
Le testing moléculaire revêt une importance majeure chez les patients atteints de cholangiocarcinomes avancés puisque 30 % d’entre eux présentent des anomalies moléculaires actionnables (15). Des mutations dans l’enzyme IDH1 sont notamment retrouvées dans 13 % des cholangiocarcinomes intra-hépatiques et dans 1 % des cholangiocarcinomes extra-hépatiques.
L’étude ClarlDHy
Schéma – L’étude de phase III ClarlDHy est une étude multicentrique, randomisée, double aveugle, qui a comparé l’administration d’un placebo versus ivosidénib chez 187 patients atteints d’un cancer des voies biliaires IDH1 muté non résécable ou métastatique, précédemment traités par au moins une ligne de traitement systémique.
Résultats intermédiaires – L’analyse initiale avait mis en évidence un gain en survie sans progression (critère de jugement principal), passant de 1,4 mois dans le groupe placebo à 2,7 mois dans le groupe ivosidénib (HR = 0,37 ; IC 95 % = 0,25-0,54 ; p < 0,0001) (16). Malgré ce faible gain, du fait de la gravité de la pathologie et de l’absence d’alternative thérapeutique, le traitement avait obtenu une AAC.
Résultats finaux – L’analyse finale de l’étude a mis en évidence une tendance favorable en survie globale, passant de 7,5 à 10,3 mois (HR = 0,79 ; IC 95 % = 0,56-1,12 ; p = 0,09), avec un taux important (70 %) de cross-over dans le bras placebo (17). Ce gain en survie globale apparaissait d’ailleurs statistiquement significatif après ajustement sur les cross-overs (HR = 0,49 ; IC 95 % = 0,34-0,70 ; p < 0,001).
Après avoir été disponible en AAC, l’ivosidénib dispose désormais d’une AMM et est disponible dans le cadre d’une APP “post-AMM” dans l’attente de son remboursement. L’indication reste la même, à savoir le traitement des patients adultes atteints de cholangiocarcinome avancé non résécable ou métastatique avec une mutation IDH1, ayant un score ECOG 0 ou 1, et en progression après deux lignes de traitement pour la maladie avancée non résécable et/ou métastatique.
Durvalumab + trémélimumab / Carcinome hépatocellulaire avancé ou non résécable
L’étude IMBRAVE150 avait installé l’association atézolizumab et bévacizumab comme le nouveau traitement systémique de première ligne pour les carcinomes hépatocellulaires (CHC) non résécables, avec, dans l’analyse mise à jour, une médiane de survie sans progression à 6,9 mois et une médiane de survie globale à 19,2 mois (18).
L’étude HIMALAYA
Schéma – L’étude de phase III HIMALAYA comparait quant à elle une double immunothérapie par durvalumab et trémélimumab et une simple immunothérapie par durvalumab au sorafénib qui était l’ancien traitement de référence (19).
Résultats – L’objectif principal est atteint puisque l’association durvalumab et trémélimumab a montré sa supériorité face au sorafénib avec une médiane de survie globale passant de 13,8 à 16,4 mois (HR = 0,78 ; IC 96 % = 0,65-0,93 ; p = 0,0035). L’objectif secondaire de non-infériorité du durvalumab seul face au sorafénib est également atteint avec une médiane de survie globale de 16,6 mois.
La double immunothérapie par durvalumab et trémélimumab apparaît donc comme une alternative à l’association atézolizumab et bévacizumab, en particulier chez les patients présentant une contre-indication aux anti-angiogéniques.
L’association durvalumab et trémélimumab est disponible dans le cadre d’une AAP “post-AMM” dans le traitement de première ligne des patients adultes atteints d’un CHC avancé ou non résécable, avec une fonction hépatique préservée (stade Child-Pugh A), avec un score ECOG 0 ou 1, non éligibles aux traitements locorégionaux ou en échec à l’un de ces traitements, et non éligibles à un traitement par l’association atézolizumab bévacizumab.
Trastuzumab déruxtécan / Adénocarcinome gastrique ou de la jonction œsogastrique HER2 positif localement avancé ou métastatique
Environ 15 à 20 % des adénocarcinomes gastriques présentent une surexpression de la protéine HER2. Pour ces patients, le traitement de première ligne fait appel à une chimiothérapie associée au trastuzumab. Cependant, contrairement au cancer du sein, il n’existait pas de thérapie ciblée pour les lignes ultérieures jusqu’à récemment.
Le trastuzumab déruxtécan, un anticorps drogue conjugué ciblant HER2, a été évalué dans les adénocarcinomes gastriques et de la jonction œsogastrique dans les études DESTINY-Gastric01 et DESTINY-Gastric02.
L’étude DESTINY-Gastric01
Schéma – L’étude DESTINY-Gastric01 est une étude de phase II randomisée qui a comparé le trastuzumab déruxtécan par rapport à une chimiothérapie laissée au choix de l’investigateur (irinotécan ou paclitaxel) chez 188 patients asiatiques ayant reçu au moins deux lignes de chimiothérapie.
Résultats – Cette étude était positive sur son critère de jugement principal de taux de réponse objective (42 versus 12,5 % ; p = 0,0001) et également en survie globale (12,5 versus 8,9 mois ; HR = 0,60 ; IC 95 % = 0,42-0,86) (20, 21).
L’étude DESTINY-Gastric02
Schéma – L’étude DESTINY-Gastric02 est quant à elle une étude monobras de phase II évaluant le trastuzumab déruxtécan chez 89 patients nord-américains et européens ayant reçu au moins une ligne à base de trastuzumab.
Résultats – L’analyse intermédiaire confirme l’activité du trastuzumab déruxtécan chez les patients caucasiens, avec un taux de réponse objective de 38 % (22).
Après avoir été disponible en accès précoce, le trastuzumab déruxtécan dispose désormais d’une AMM et reste disponible dans le cadre d’une AAP “post-AMM” dans l’attente de son remboursement. L’indication reste la même, à savoir le traitement des patients adultes présentant un adénocarcinome de l’estomac ou de la jonction œsogastrique HER2 positif localement avancé ou métastatique ayant reçu préalablement au moins deux lignes de traitement incluant le trastuzumab.
Nous attendons avec impatience les résultats de l’étude de phase III DESTINY-Gastric04 qui compare le trastuzumab déruxtécan à l’association paclitaxel et ramucirumab dès la deuxième ligne.
Niraparib / Cancer de prostate métastatique résistant à la castration avec altération de BRCA1/2
Le traitement de première ligne du cancer de prostate métastatique résistant à la castration repose actuellement sur deux options thérapeutiques : les hormonothérapies de nouvelle génération (acétate d’abiratérone et enzalutamide) ou la chimiothérapie par un taxane. La suppression androgénique est maintenue tout le long de ces traitements.
La présence d’altérations des gènes BRCA1 ou 2 est estimée à 15 % environ des cancers de prostate métastatiques et est associée à une maladie plus agressive. Les inhibiteurs de PARP sont déjà disponibles dans le traitement des cancers de l’ovaire, du sein et du pancréas présentant des altérations de BRCA, il était donc logique de les évaluer également dans le cancer de prostate.
L’étude MAGNITUDE
Schéma – L’étude MAGNITUDE est un essai randomisé de phase III en double aveugle qui a évalué l’efficacité et la tolérance de l’adjonction du niraparib en association avec l’acétate d’abiratérone et la prednisone, chez des patients atteints de cancer de prostate métastatique résistant à la castration (23, 24).
Résultats cohorte HRR- – Une première cohorte (HRR-) comportait 233 patients sans altérations des gènes de la recombinaison homologue. La première analyse intermédiaire menée sur un critère composite de temps jusqu’à progression du PSA et/ou progression radiologique (HR = 1,09 ; IC 95 % = 0,75-1,57 ; p = 0,66) n’a pas atteint l’objectif pré-spécifié et la cohorte a donc été interrompue pour futilité.
Résultats cohorte HRR+ – Une deuxième cohorte (HRR+) comportait 423 patients présentant des altérations des gènes du système HRR (dont 53 % de mutations BRCA1/2). La survie sans progression radiologique (rSSP) était significativement augmentée, passant de 13,7 à 16,7 mois (HR = 0,76 ; IC 95 % = 0,60-0,97 ; p = 0,028). Le bénéfice semblait principalement drivé par les mutations de BRCA1/2, avec dans ce sous-groupe une rSSP passant de 10,9 à 19,5 mois (HR = 0,55 ; IC 95 % = 0,39-0,78 ; p = 0,0007). On retrouvait par ailleurs dans ce sous-groupe un bénéfice en survie globale après prise en compte des traitements ultérieurs (HR = 0,54 ; IC 95 % = 0,33-0,90 ; p = 0,0181).
Tolérance – L’ajout du niraparib à l’acétate d’abiratérone a principalement provoqué une hausse des toxicités hématologiques.
Le niraparib a donc obtenu un AAP “pré-AMM” en association à l’acétate d’abiratérone pour le traitement de première ligne du cancer de prostate métastatique résistant à la castration avec altération somatique et/ou germinale des gènes BRCA1/2. Le testing moléculaire devient donc nécessaire pour ces patients.
Répotrectinib / Tumeur solide avec fusion du gène NTRK1-3, non résécable métastatique ou localement avancée
Nous évoquions plus haut, dans la section oncologie thoracique, la mise à disposition du répotrectinib dans les CBNPC avec réarrangement de ROS1, en deuxième ligne après crizotinib. Ce TKI cible également les réarrangements de NTRK et a été développé de façon tissu-agnostique dans cette indication.
L’étude TRIDENT-1
Schéma – L’étude de phase I/II TRIDENT-1 comportait en effet deux cohortes évaluant son efficacité chez des patients présentant un cancer solide avancé avec réarrangement de NTRK, naïfs de TKI (40 patients) ou prétraités par TKI (48 patients, avec une moitié prétraités par larotrectinib et l’autre par entrectinib) (3). Les cancers inclus étaient principalement des CBNPC, suivis par des cancers de glandes salivaires, de la thyroïde et des sarcomes.
Résultats – Le taux de réponse objective était de 58 % parmi les patients naïfs et de 50 % chez les patients prétraités, tandis que le taux de survie sans progression à 12 mois était de 56 % chez les naïfs et 22 % chez les prétraités.
Le répotrectinib est disponible en AAC dans les tumeurs solides exprimant une fusion du gène NTRK1-3, non résécables métastatiques ou localement avancées, chez des patients ayant déjà reçu une première ligne de traitement.
On rappelle que la larotrectinib dispose d’une AMM dans les tumeurs solides avec fusion de NTRK1-3, mais qu’il n’est malheureusement pas remboursé en dehors des indications pédiatriques.
Conclusion
Avec ces nouvelles indications disponibles en 2023, l’arsenal thérapeutique de l’oncologue continue de s’étoffer. De façon rassurante, de nombreuses indications auparavant disponibles en accès dérogatoire ont rejoint le droit commun, assurant un accès pérenne pour nos patients. Ces succès ne doivent cependant pas faire oublier les contraintes financières qui risquent de remettre en cause la soutenabilité du modèle français auquel nous sommes attachés.
Les auteurs déclarent ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Forde PM, Spicer J, Lu S et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022 ; 386 : 1973-85.
2. Jänne PA, Riely GJ, Gadgeel SM et al. Adagrasib in non-small-cell lung cancer harboring a KRASG12C mutation. N Engl J Med 2022 ; 387 : 120-31.
3. Solomon BJ, Drilon A, Lin JJ et al. 1372P Repotrectinib in patients (pts) with NTRK fusion-positive (NTRK+) advanced solid tumors, including NSCLC: Update from the phase I/II TRIDENT-1 trial. Ann Oncol 2023 ; 34 : S787-8.
4. Bidard FC, Kaklamani VG, Neven P et al. Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor-positive, human epidermal growth factor receptor 2–negative advanced breast cancer: results from the randomized phase III EMERALD trial. J Clin Oncol 2022 ; 40 : 3246-56.
5. Rugo HS, Bardia A, Marmé F et al. Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomised, open-label, multicentre, phase 3 trial. Lancet 2023 ; 402 : 1423-33.
6. Modi S, Jacot W, Yamashita T et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022 ; 387 : 9-20.
7. Modi S, Jacot W, Iwata H et al. 376O Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): Updated survival results of the randomized, phase III DESTINY-Breast04 study. Ann Oncol 2023 ; 34 : S334-5.
8. Tewari KS, Monk BJ, Vergote I et al. Survival with cemiplimab in recurrent cervical cancer. N Engl J Med 2022 ; 386 : 544-55.
9. Bouffet E, Hansford JR, Garrè ML et al. Dabrafenib plus trametinib in pediatric glioma with BRAF V600 mutations. N Engl J Med 2023 ; 389 : 1108-20.
10. Hargrave DR, Terashima K, Hara J et al. Phase II trial of dabrafenib plus trametinib in relapsed/refractory BRAF V600-mutant pediatric high-grade glioma. J Clin Oncol 2023 ; 41 : 5174-83.
11. Yaeger R, Weiss J, Pelster MS et al. Adagrasib with or without cetuximab in colorectal cancer with mutated KRAS G12C. N Engl J Med 2023 ; 388 : 44-54.
12. Oh DY, Ruth He A, Qin S et al. Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer. N Engl J Med Evid 2022 ; 1.
13. Oh DY, He AR, Qin S et al. 78P Updated overall survival (OS) from the phase III TOPAZ-1 study of durvalumab (D) or placebo (PBO) plus gemcitabine and cisplatin (+ GC) in patients (pts) with advanced biliary tract cancer (BTC). Ann Oncol 2022 ; 33 : S1462-3.
14. Bouattour M, Valle JW, Vogel A et al. Characterization of long-term survivors in the TOPAZ-1 study of durvalumab or placebo plus gemcitabine and cisplatin in advanced biliary tract cancer. J Clin Oncol 2023 ; 41 : 531.
15. Mody K, Jain P, El-Refai SM et al. Clinical, genomic, and transcriptomic data profiling of biliary tract cancer reveals subtype-specific immune signatures. J Clin Oncol Precis Oncol 2022 ; 6 : e2100510.
16. Abou-Alfa GK, Macarulla T, Javle MM et al. Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2020 ; 21 : 796-807.
17. Zhu AX, Macarulla T, Javle MM et al. Final overall survival efficacy results of ivosidenib for patients with advanced cholangiocarcinoma with IDH1 mutation: the phase 3 randomized clinical ClarIDHy trial. JAMA Oncol 2021 ; 7 : 1669-77.
18. Cheng AL, Qin S, Ikeda M et al. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 2022 ; 76 : 862-73.
19. Abou-Alfa GK, Lau G, Kudo M et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. N Engl J Med Evid 2022 ; 1.
20. Shitara K, Bang YJ, Iwasa S et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer. N Engl J Med 2020 ; 382 : 2419-30.
21. Yamaguchi K, Bang YJ, Iwasa S et al. Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01). J Clin Oncol 2022 ; 40 : 242.
22. Van Cutsem E, di Bartolomeo M, Smyth E et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol 2023 ; 24 : 744-56.
23. Chi KN, Sandhu S, Smith MR et al. Niraparib plus abiraterone acetate with prednisone in patients with metastatic castration-resistant prostate cancer and homologous recombination repair gene alterations: second interim analysis of the randomized phase III MAGNITUDE trial. Ann Oncol 2023 ; 34 : 772-82.
24. Chi KN, Rathkopf D, Smith MR et al. Niraparib and abiraterone acetate for metastatic castration-resistant prostate cancer. J Clin Oncol 2023 ; 41 : 3339-51.