Quelles sont les indications validées en 2022 ?
Ce dossier, concernant les nouvelles molécules disponibles en accès précoce en 2022, est conçu pour vous venir en aide dans votre pratique quotidienne. Il intègre les accès précoces du premier trimestre qui avaient été publiés dans Onko+ N°117 par les Drs Thibault Gauduchon et Romain Varnier.
Évaluation des molécules mises à disposition des praticiens en 2022
Pour rappel, le nouveau dispositif d’accès précoce vient remplacer les anciennes autorisations temporaires d’utilisation de cohortes (ATUc), les ATU d’extension d’indication, les post-ATU et les prises en charge temporaires. L’objectif est de permettre la prise en charge de médicaments en cours de développement répondant à un besoin thérapeutique non couvert et pour lesquels le laboratoire s’engage à déposer une demande d’AMM ou de remboursement.
La HAS met à jour régulièrement un référentiel des molécules pour lesquelles une autorisation d’accès précoce est accordée qui est consultable sur leur site avec le lien suivant : www.has-sante.fr/jcms/p_3281266/fr/avis-et-decisions-sur-les-medicaments.
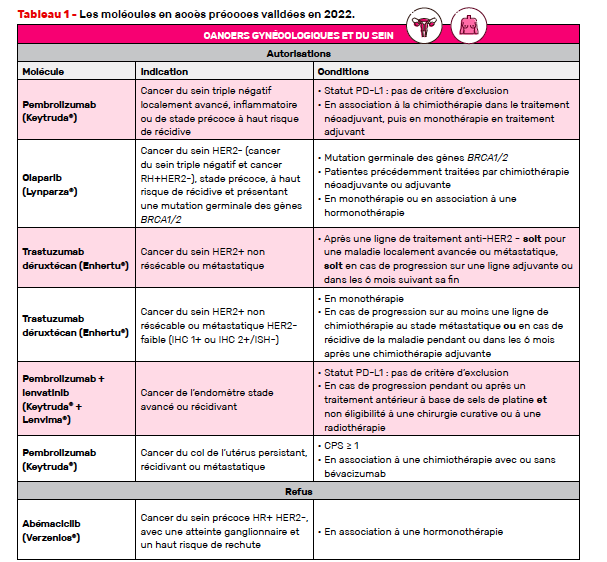
Pembrolizumab / Cancer du sein triple négatif localisé
Nous avions déjà parlé du pembrolizumab en association avec la chimiothérapie dans le traitement du cancer du sein triple négatif non résécable ou métastatique dans un numéro antérieur. Mais, avec KEYNOTE-522, l’immunothérapie peut désormais être utilisée dans les formes localisées.
L’étude KEYNOTE-522 (1)
Schéma – Dans cet essai de phase III, 1 174 patientes ont été randomisées pour recevoir le pembrolizumab ou le placebo associé à la chimiothérapie néoadjuvante par quatre cures de carboplatine-paclitaxel suivies de quatre cures d’AC dans des cancers du sein triple négatifs de stade II-III. Ce traitement était poursuivi par le pembrolizumab ou le placebo en adjuvant pendant neuf cures.
Résultats – Une première analyse publiée en 2020 avait montré une amélioration significative du taux de réponse complète histologique (pCR) dans le groupe pembrolizumab (64,8 versus 51,2 %).
Les nouveaux résultats publiés en début d’année montraient une survie sans événement (EFS) significativement améliorée avec une EFS à 3 ans de 84,5 versus 76,8 %. On retrouvait une diminution du risque d’événement (progression, récidive locale ou à distance, second cancer) de 37 % avec un HR à 0,63 (IC 95 % = 0,48-0,82), quel que soit le statut ganglionnaire ou PD-L1. Les données de survie globale ne sont pas encore matures.
Tolérance – À noter qu’il n’y avait pas plus d’effets secondaires de grade 3
avec l’immunothérapie (77 versus 73 %), mais qu’on retrouvait un arrêt du schéma thérapeutique en raison d’événements indésirables liés au traitement chez 27,7 % des patients du groupe pembrolizumab versus 14,1 % dans le groupe placebo.
Ces résultats ont permis un accès précoce du pembrolizumab « en association à la chimiothérapie dans le traitement néoadjuvant, puis en monothérapie en adjuvant dans le traitement des cancers du sein triple négatifs localement avancés, inflammatoires ou de stade précoce à haut risque de récidive (T1c N1–2 ou T2–4 N0–2) ».
Olaparib / Cancer du sein HER2- précoce, à haut risque de récidive, BRCA1/2 muté
Les cancers du sein d’origine génétique sont retrouvés chez 5 à 10 % des patients. La mutation la plus fréquente est celle des gènes BRCA1/2 qui est associée à un âge plus précoce de développement d’un cancer du sein et d’un risque plus élevé́ d’un second cancer dans le sein controlatéral.
Les cancers du sein avec une mutation BRCA1 sont dans 60 % des cas des cancers triple négatifs. Les cancers avec mutation BRCA2 sont le plus souvent positifs pour les récepteurs hormonaux (RH+), la prévalence dans ce sous-groupe des cancers triple négatifs étant de 20 %.
Pour les cancers triple négatifs (RH-/HER2-) qui ont été traités par une chimiothérapie néoadjuvante et à haut risque de récidive, aucun traitement ne dispose d’une AMM dans cette indication. Une option repose sur la capécitabine hors AMM en cas de maladie résiduelle invasive après un traitement optimal par chimiothérapie néoadjuvante et chirurgie.
En cas de cancers du sein RH+/HER2- à haut risque de récidive et qui ont reçu un traitement complet (chimiothérapie adjuvante et/ou néoadjuvante ; radiothérapie), le traitement reposait sur le maintien de l’hormonothérapie seule, indépendamment du statut BRCA.
L’étude OlympiA (2)
L’étude qui a consacré l’olaparib dans les cancers du sein précoces HER2- BRCA1/2 mutés, à haut risque de récidive est l’étude de phase III OlympiA, contrôlée, randomisée en double aveugle. L’objectif était de démontrer la supériorité́ d’un traitement adjuvant par olaparib par rapport à un placebo après un traitement local complet et une chimiothérapie néoadjuvante ou adjuvante.
Schéma – Tous les patients inclus dans l’essai présentaient des mutations germinales BRCA1/2. Pour les cancers du sein triple négatifs, les patients éligibles avaient soit reçu une chimio néoadjuvante avec présence d’une maladie résiduelle (non-pCR), soit une chimiothérapie adjuvante pour des tumeurs T2-T4 ou avec présence d’un envahissement ganglionnaire. En cas de cancers RH+, les critères incluaient des patients avec plus de quatre ganglions positifs avant une chimiothérapie adjuvante ou après une chimiothérapie néoadjuvante, la présence d’une maladie résiduelle (non-pCR) et un score CPS + EG ≥ 3.
Le critère de jugement principal était la survie sans maladie invasive (SSMI) et les critères secondaires étaient la survie sans maladie à distance (DDFS), la survie globale (SG) et la sécurité d’emploi incluant les événements d’intérêt spécial (syndrome myélodysplasique/leucémie aiguë myéloïde, nouveau cancer, pneumopathie).
Résultats – L’analyse intermédiaire primaire après un suivi médian de 2,5 ans a montré un bénéfice significatif dans le bras olaparib versus placebo en termes de SSMI (HR = 0,58 ; IC 99,5 % = 0,41-0,82 ; p < 0,0001). L’olaparib a été supérieur par rapport au placebo en termes de DDFS. 10 % des patients ont présenté des événements de DDFS dans le groupe olaparib versus 17 % dans le groupe placebo (HR = 0,57 ; IC 99,5 % = 0,39-0,83 ; p = 0,0000257).
De plus, selon la deuxième analyse intermédiaire de la survie globale après un suivi médian d’environ 3,5 ans, le traitement adjuvant par olaparib a montré sa supériorité́ par rapport au placebo : 8,1 % des patients étaient décédés dans le groupe olaparib versus 11,9 % dans le groupe placebo (HR = 0,68 ; IC 98,5 % = 0,47-0,97 ; p = 0,009), soit une différence absolue de 3,8 points.
Tolérance – Un total de 10,6 % des patients du groupe olaparib versus 4,6 % du groupe placebo ont présenté un événement indésirable (EI) ayant entraîné l’arrêt définitif du traitement. Les plus fréquents ont été les nausées (2,1 versus 0,3 %), l’anémie (1,8 versus 0 %), la fatigue (1,5 versus 0,4 %) et la neutropénie (1,0 versus 0,1 %). Des EI de grades ≥ 3 ont été rapportés chez 24,5 % des patients du groupe olaparib versus 11,3 % du groupe placebo. L’anémie (8,7 versus 0,3 %) et la diminution des polynucléaires neutrophiles (4,9 versus 0,8 %) étant les plus rapportés.
Ces résultats ont donc permis un accès précoce de l’olaparib « dans le traitement adjuvant des patients adultes atteints d’un cancer du sein précoce à haut risque de récidive, HER2 négatifs et présentant une mutation germinale des gènes BRCA1/2 précédemment traités par chimiothérapie néoadjuvante ou adjuvante et radiothérapie ».
Trastuzumab déruxtécan / Cancer du sein HER2+ non résécable ou métastatique
La surexpression d’HER2 dans les cancers du sein est associée à une agressivité plus importante de la tumeur, avec des taux de récidive plus élevés, et à une augmentation de la mortalité́. Cette altération moléculaire est en conséquence reconnue comme un facteur de mauvais pronostic et constitue un critère décisionnel indépendant pour le choix du traitement.
Le traitement des cancers HER2 positif repose sur les anticorps monoclonaux ou des inhibiteurs de tyrosine kinase qui ont amélioré la prise en charge de ces patients. Après les études CLEOPATRA5 et EMILIA3 (les deux publiées en 2012), la séquence de traitement recommandée pour les cancers du sein HER2+ métastatiques était en première ligne l’association de taxanes à deux thérapies anti-HER2, trastuzumab et pertuzumab, suivie du trastuzumab-emtansine ou T-DM1. Le choix de la troisième ligne et au-delà était plus flexible, avec la possibilité d’utiliser trastuzumab/chimiothérapie ou le lapatinib en association avec une autre molécule.
L’étude DESTINY-Breast03 (3)
Trastuzumab déruxtécan est un conjugué anticorps-médicament (le trastuzumab qui cible le récepteur HER2, couplé à un agent cytotoxique, le déruxtécan (DXd) dérivé de l’irinotécan). Le trastuzumab déruxtécan a été évalué versus trastuzumab emtansine/T-DM1 dans l’essai de phase III DESTINY-Breast03.
Schéma – Parmi 524 patientes incluses, 261 recevaient le trastuzumab déruxtécan et 263 le trastuzumab emtansine. Toutes avaient reçu antérieurement un traitement par trastuzumab avec un taxane dans un contexte de maladie avancée et/ou métastatique ou avaient progressé dans les 6 premiers mois après un traitement (néo)adjuvant par trastuzumab/taxane. À noter que la présence de métastases cérébrales stables, antérieurement traitées, n’était pas un critère d’exclusion.
Résultats – Les événements de progression de la maladie ou décès étaient significativement plus fréquents dans le groupe T-DM1 versus T-DXd, 158 (60,1 %) versus 87 (33,3 %). L’analyse de la survie globale était encore immature à la date de l’analyse. Cependant, il existe une supériorité dans le bras T-DXd, avec 33 patientes décédées (12,6 %) versus 53 (20,2 %) dans le groupe T-DM1 (HR = 0,55 (IC 95 % = 0,36-0,86).
Tolérance – La toxicité du T-DXd est plus importante, mais acceptable par rapport à son efficacité. Les effets secondaires principaux ont été représentés pas des toxicités gastro-intestinales et hématologiques. À noter le risque de développer une pneumopathie interstitielle diffuse qui était accru dans le groupe T-DXd, 27 patients (10,5 %) versus 5 (1,9 %) dans le groupe trastuzumab emtansine.
Reposant sur ces données, le trastuzumab déruxtécan est donc désormais accessible en accès précoce « en monothérapie dans le traitement des patients adultes atteints d’un cancer du sein HER2-positif non résécable ou métastatique ayant reçu au préalable une ligne de traitement anti-HER2 ».
Trastuzumab déruxtécan / Cancer du sein HER2 faible non résécable ou métastatique
Certains cancers du sein expriment de faibles taux de HER2 avec une inefficacité des thérapies anti-HER2 existantes.
L’étude DESTINY-Breast04 (4)
Schéma – L’étude de phase III DESTINY-Breast04 a analysé cette catégorie de patients en évolution métastatique ayant reçu une ou deux lignes de chimiothérapie ou ayant récidivé pendant ou dans les 6 mois suivant la fin d’une chimiothérapie adjuvante. Les patients RH+ devaient avoir reçu ou être inéligibles à une nouvelle ligne d’hormonothérapie. Le statut HER2 faible correspond à un score 1+ ou 2+ en IHC, avec un résultat négatif en hybridation in situ (ISH). L’objectif de l’étude était de montrer la supériorité́ du trastuzumab déruxtécan (T-DXd) par rapport à̀ un traitement laissé au choix de l’investigateur (capécitabine, éribuline, gemcitabine, paclitaxel ou nab-paclitaxel) dans la population RH+.
Résultats – Parmi les 557 patients inclus, 494 (88,7 %) présentaient des RH+. Dans ce groupe, la médiane de SSP a été de 10,1 mois avec le trastuzumab déruxtécan et de 5,4 mois avec la chimiothérapie au choix de l’investigateur, soit un gain absolu de +4,7 mois en faveur du T-DXd (HR = 0,51 ; IC 95 % = 0,40-0,64 ; p < 0,001). La médiane de SG a été de 23,9 mois dans le groupe T-DXd versus 17,5 mois dans le groupe chimiothérapie, soit un gain absolu de +6,4 mois avec T-DXd (HR = 0,64 ; IC 95 % =0,48-0,86.
Tolérance – Les EI de grade ≥ 3 ont été rapportés chez 52,6 % des patients dans le groupe T-DXd versus 67,4 % dans le groupe chimiothérapie.
Au regard de ces résultats, le trastuzumab déruxtécan est actuellement disponible en accès précoce « en monothérapie pour le traitement des patients adultes atteints d’un cancer du sein HER2- faible (IHC 1+ ou IHC 2+/ISH-) non résécable ou métastatique qui ont reçu au moins une ligne de chimiothérapie au stade métastatique ou qui ont développé une récidive de la maladie pendant ou dans les 6 mois suivant la fin d’une chimiothérapie adjuvante. Les patients atteints d’un cancer du sein avec des récepteurs hormonaux positifs doivent aussi avoir reçu au moins une hormonothérapie et être non éligibles à une nouvelle ligne d’hormonothérapie ».
Pembrolizumab + lenvatinib / Cancer de l’endomètre
Il n’existe actuellement aucun traitement standard pour le cancer de l’endomètre avancé ou récurrent après échec d’une chimiothérapie à base de platine.
Le lenvatinib est un inhibiteur de tyrosine kinase multicible (VEGFR 1 à 3, FGFR 1 à 4, PDGFRα, RET et KIT) qui avait déjà montré une efficacité prometteuse en association avec le pembrolizumab chez les patientes atteintes d’un carcinome de l’endomètre avancé en progression après un traitement systémique antérieur, quel que soit le statut MSI (phase Ib/II).
L’étude KEYNOTE-775 (5)
Schéma – L’efficacité de cette association a été confirmée dans l’étude de phase III KEYNOTE-775 menée chez 827 patientes présentant un cancer de l’endomètre avancé (sarcome et carcinosarcomes exclus) déjà traitées avec au moins une ligne de chimiothérapie antérieure à base de platine (possiblement néoadjuvant ou adjuvant) et quel que soit le statut MMR (mismatch repair). Les patientes étaient randomisées en 1:1, pour recevoir le pembrolizumab associé au lenvatinib versus une mono-
chimiothérapie (doxorubicine toutes les 3 semaines ou paclitaxel hebdomadaire 3 semaines sur 4).
Résultats – On retrouvait dans le groupe pembrolizumab-lenvatinib une survie globale (SG) significativement améliorée avec un HR à 0,62 (IC 95 % = 0,51-0,75 ; p < 0,0001) de même que pour la survie sans progression (SSP) avec un HR à 0,56 (IC 95 % = 0,47-0,66 ; p < 0,0001). La SG médiane était de 18,3 versus 11,4 mois et la SSP médiane de 7,2 versus 3,8 mois. On notait également des taux de réponse objective supérieurs avec l’association : 32 % (IC 95 % = 27-37) versus 15 % (IC 95 % = 11-18) avec p < 0,0001.
Tolérance – Des EI de grade ≥ 3 sont survenus chez 88,9 % des patientes avec l’association versus 72,7 % pour les patients sous chimiothérapie. Les effets indésirables les plus fréquents avec l’association étaient l’hypertension (63 %), la diarrhée (57 %), l’hypothyroïdie (56 %), les nausées (51 %) et la diminution de l’appétit (47 %).
Ces résultats ont donc permis un accès précoce du pembrolizumab « en association avec le lenvatinib dans le traitement des cancers de l’endomètre avancés ou récidivants, progressant pendant ou après un traitement antérieur à base de sels de platine reçu quel que soit le stade et non éligibles à une chirurgie curative ou à une radiothérapie ».
Pembrolizumab / Cancer du col de l’utérus persistant, récidivant ou métastatique
Le traitement standard des rechutes ou des évolutions métastatiques d’emblée des cancers du col de l’utérus réside sur l’association de sels de platine (cisplatine/carboplatine) et taxanes, ± bévacizumab.
L’étude KEYNOTE-826 (6)
Schéma – L’efficacité du pembrolizumab dans les tumeurs PD-L1 positives de col de l’utérus a été évaluée dans plusieurs études dont KEYNOTE-826, étude pivotale de phase III qui a comparé l’association pembrolizumab/chimiothérapie à base de platine ± bévacizumab en première ligne pour des tumeurs du col en poursuite évolutive, récidivantes ou métastatiques d’emblée. Le suivi médian a été de 18,2 mois (0,5-29,4 mois) dans le groupe pembrolizumab + chimiothérapie ± bévacizumab et de 16,3 mois (0,3-29,2 mois) dans le groupe placebo + chimiothérapie ± bévacizumab (jusqu’au 3/05/2021).
Résultats – Parmi les critères de jugement principaux, la survie sans progression (SSP) dans la population avec un score CPS ≥ 1 a été de 10,4 mois dans le groupe pembrolizumab (IC 95 % = 9,7-12,3) et de 8,2 mois dans le groupe placebo (IC 95 % = 6,3-8,5), soit un gain de 2,2 mois (HR = 0,62 ; IC 95 % = 0,50-0,77). La médiane de survie globale (SG) n’était pas atteinte dans le groupe pembrolizumab, et était de 16,3 mois dans le groupe placebo (HR = 0,64 ; 0,50-0,81 ; IC 95 % = 14,5-19,4).
Tolérance – La fréquence des EI de grades ≥ 3 a été de 81,8 % dans le groupe pembrolizumab et de 75,1 % dans le groupe placebo. Des EI potentiellement immuno-induits ont été observés dans 33,9 % des cas dans le groupe pembrolizumab et dans 15,2 % dans le groupe placebo.
Conclusion – L’étude a conclu que l’association du pembrolizumab au traitement standard à base de sels de platine ± bévacizumab améliore la survie sans progression et la survie globale de manière significative. Le profil de sécurité est en conformité avec les profils individuels de toxicité connus pour les produits utilisés.
Ces résultats ont permis un accès précoce du pembrolizumab « en association à la chimiothérapie à base de sels de platine et ± bévacizumab dans le traitement du cancer du col de l’utérus persistant, récidivant ou métastatique ».
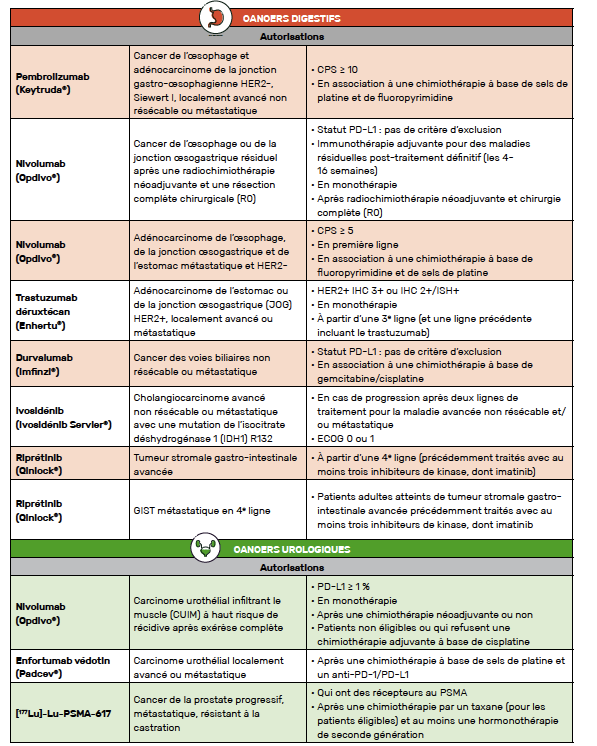
Pembrolizumab / Cancer de l’œsophage localement avancé ou métastatique
Le traitement des adénocarcinomes de l’œsophage au stade métastatique avait connu peu d’avancées ces dernières années. La stratégie de première ligne reposait sur des bichimiothérapies à base de sels de platine et 5-FU (FOLFOX, 5-FU-cisplatine).
L’étude KEYNOTE-590 (7)
Le bénéfice de l’adjonction du pembrolizumab à une chimiothérapie par 5-FU-cisplatine en première ligne a été évalué dans l’essai KEYNOTE-590, étude randomisée en double aveugle de phase III.
Schéma – Cette étude a inclus 749 patients atteints de cancers de l’œsophage (dont œsophage distal, Siewert I), avec environ 75 % de type épidermoïde et 25 % de type adénocarcinome. Le plan d’analyse prévoyait de multiples analyses hiérarchisées, fondées sur l’histologie et/ou le statut PD-L1 avec un cut-off de CPS à 10 %.
Résultats – L’étude est positive dans la population globale (toutes histologies et peu importe le niveau de PD-L1) avec une médiane de survie sans progression passant de 5,8 à 6,3 mois (HR = 0,65 ; IC 95 % = 0,55-0,76 ; p < 0,0001) et une médiane de survie globale passant de 9,8 à 12,4 mois (HR = 0,73 ; IC 95 % = 0,62-0,86 ; p < 0,0001).
Néanmoins, la HAS n’a retenu l’indication que dans le sous-groupe exprimant PD-L1 avec un CPS ≥ 10, chez qui le bénéfice semblait plus important avec une SSP passant de 5,5 à 7,5 mois (HR = 0,51 ; IC 95 % = 0,41-0,65 ; p < 0,0001) et une SG passant de 9,4 à 13,5 mois (HR = 0,62 ; IC 95 % = 0,49-0,78 ; p < 0,0001).
Le pembrolizumab bénéficie d’un accès précoce « en association à une chimiothérapie à base de sels de platine et de fluoropyrimidine, dans le traitement de première ligne des patients adultes atteints d’un cancer de l’œsophage ou d’un adénocarcinome de la jonction gastro-œsophagienne HER-2 négatif uniquement de type I (classification Siewert), localement avancés non résécables ou métastatiques, dont les tumeurs expriment PD-L1 avec un CPS ≥ 10 ».
Nivolumab / Cancer de l’œsophage (après radiochimiothérapie)
Malgré des stratégies thérapeutiques multimodales (radiochimiothérapie puis généralement chirurgie), le pronostic des cancers de l’œsophage et de la jonction œsogastrique restait sombre. Les patients présentant une maladie résiduelle après radiochimiothérapie étaient particulièrement à risque d’évolution métastatique, posant donc la question d’une intensification du traitement péri-opératoire.
L’étude CheckMate 577 (8)
Schéma – L’étude CheckMate 577 était un essai randomisé de phase III, comparant le nivolumab à un placebo dans le traitement adjuvant des patients de stades II ou III traités par radiochimiothérapie puis chirurgie et présentant une maladie résiduelle sur la pièce opératoire. Près de 800 patients ont été inclus, avec une randomisation 2:1 en faveur de l’immunothérapie adjuvante (nivolumab 240 mg toutes les 2 semaines pendant 4 mois, puis nivolumab 480 mg toutes les 4 semaines pour une durée totale de 12 mois). La population comportait 60 % de localisations œsophagiennes et 70 % étaient des carcinomes épidermoïdes. La chimiothérapie de potentialisation était du carboplatine-paclitaxel dans 75 % des cas.
Résultats – Le critère de jugement principal a été atteint dès l’analyse intermédiaire avec une médiane de survie sans progression de 22,4 mois dans le groupe nivolumab contre 11,0 mois pour le placebo (HR = 0,69 ; IC 95 % = 0,56-0,86 ; p < 0,0003).
Tolérance – Le profil de tolérance était attendu pour un anti-PD-1 en monothérapie.
Le nivolumab est disponible en accès précoce « en monothérapie dans le traitement adjuvant des patients adultes atteints d’un cancer de l’œsophage ou de la jonction œsogastrique et qui présentent une maladie résiduelle après une radiochimiothérapie néoadjuvante antérieure ».
Nivolumab / Cancer de l’œsophage et de l’estomac métastatique
Le nivolumab a également été développé au stade métastatique pour les adénocarcinomes de l’œsophage, de la jonction œsogastrique, mais aussi gastriques.
Jusqu’à présent le traitement de première ligne reposait sur une chimiothérapie à base de 5-FU et platine (bithérapie, voire trithérapie type docétaxel-cisplatine-5-FU dans le cancer gastrique chez des patients sélectionnés).
L’étude CheckMate 649 (9, 10)
Schéma – L’étude CheckMate 649 était un essai randomisé de phase III évaluant la supériorité de l’association nivolumab + chimiothérapie par rapport à la chimiothérapie seule (FOLFOX ou CAPOX). Le protocole a été amendé en cours d’étude pour restreindre l’analyse aux patients exprimant PD-L1 avec un CPS ≥ 5 (955 des 1 581 patients randomisés, soit 60 % de la population). On note une large majorité de localisations gastriques (70 %, versus 18 % de jonctions œsogastriques et 12 % d’œsophages) et environ 20 % des patients avaient précédemment été opérés.
Résultats – Les deux critères principaux de survie sans progression et de survie globale ont été atteints, avec une SSP médiane passant de 6,1 à 7,7 mois (HR = 0,68 ; IC 95 % = 0,56-0,81 ; p < 0,0001) et une SG médiane passant de 11,1 à 14,4 mois (HR = 0,71 ; IC 95 % = 0,59-0,86 ; p < 0,0001).
À noter que les résultats d’un troisième groupe évaluant la combinaison nivolumab + ipilimumab versus chimiothérapie étaient négatifs.
Tolérance – On note une proportion importante de toxicités de grade ≥ 3 (47,4 % pour la chimio-immunothérapie et 43,7 % pour la chimiothérapie seule), nécessitant un suivi rapproché pour ces patients fragiles.
Un accès précoce du nivolumab est disponible « en association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne de traitement, dans le traitement des patients adultes atteints d’un adénocarcinome gastrique, de la jonction œsogastrique ou de l’œsophage avancé ou métastatique, HER-2 négatif, dont les tumeurs expriment PD-L1 avec un score positif combiné (CPS) ≥ 5 ».
Trastuzumab déruxtécan / Cancer gastrique et de la jonction œsogastrique HER2+ localement avancé ou métastatique
Le trastuzumab déruxtécan a également été développé au stade avancé ou métastatique pour les adénocarcinomes de la jonction œsogastrique et gastriques qui présentent une surexpression du HER2. La surexpression de la protéine HER2 concernerait entre 12 à 23 % des adénocarcinomes gastriques, et sa valeur pronostique n’est pas établie à ce jour.
Jusqu’au présent, le traitement de première ligne reposait sur une chimiothérapie à base de cisplatine et de 5-FU ou de capécitabine, associée à une thérapie ciblée anti-HER2.
En deuxième ligne, la prise en charge ne diffère pas entre les sous-groupes HER2 positifs et négatifs : une monothérapie à base de docétaxel ou d’irinotécan est recommandée. Une option reste l’association du ramucirumab et du paclitaxel, les associations à base de 5-FU comme FOLFOX et FOLFIRI.
À partir de la troisième ligne, le traitement comporte un agent de chimiothérapie non précédemment utilisé ou le trifluridine/tipiracil.
Contrairement au traitement du cancer du sein métastatique, il n’y a pas d’autres molécules anti-HER2, sauf le trastuzumab, ayant démontré une efficacité dans les cancers gastriques HER2+. La résistance acquise au trastuzumab après son utilisation est un phénomène bien observé impliquant, en autres, des mutations PI3K et la voie de signalisation PI3K–AKT. La réduction de l’expression de HER2 (hétérogène dans le cancer gastrique) après l’utilisation de trastuzumab a été également décrite.
Le trastuzumab déruxtécan présente un rapport médicament/anticorps élevé et l’agent cytotoxique liposoluble diffuse facilement autravers de la membrane cellulaire, le rendant moins dépendant de l’expression de HER2.
L’étude DESTINY-Gastric01 (11)
Schéma – L’étude DESTINY-Gastric01 est une étude de phase II randomisée qui a comparé l’efficacité et la tolérance du trastuzumab déruxtécan (T-DXd) par rapport à un traitement laissé au choix de l’investigateur (irinotécan/paclitaxel). L’étude a été effectuée en Asie (Japon et Corée du Sud) et a inclus 188 patients, ayant reçu au moins deux lignes de chimiothérapie, randomisés 2:1 en faveur du T-DXd.
Résultats – Le critère de jugement principal, qui était le taux de réponse objective (TRO), a été statistiquement plus élevé dans le groupe T-DXd que dans le groupe TPC : 51,3 versus 14,3 % (p < 0,0001). La survie globale (SG) était un critère de jugement secondaire. L’analyse intermédiaire, à la date du 8 novembre 2019, a montré une médiane de SG de 12,5 mois dans le groupe T-DXd versus 8,4 mois dans le groupe TPC, soit un gain absolu de 4,1 mois en faveur du groupe T-DXd (HR = 0,59 ; IC 95 % = 0,39-0,88 ; p = 0,009713).
L’étude DESTINY-Gastric02 (12)
L’étude DESTINY-Gastric02 poursuit la démonstration de l’efficacité du trastuzumab déruxtécan, avec un profil de toxicité acceptable.
Schéma – Il s’agit d’une étude de phase II, mono-bras, incluant une population occidentale, prétraitée en préalable avec du trastuzumab. Les données ont été extraites à la date du 9 avril 2021 (à noter que l’étude est toujours en cours).
Résultats – La SG médiane était de 12,1 mois (IC 95 % = 9,4-15,4) et le taux de réponse objective de 41,8 % (33/79 ; 4 réponses complètes et 29 réponses partielles). La survie médiane sans progression était de 5,6 mois.
Tolérance – Tous les patients ont présenté au moins un effet secondaire, avec pour plus de la moitié d’entre eux un EI de grade égal ou supérieur à 3. Les plus souvent décrits ont été les nausées (67,1 %), les vomissements (44,3 %) et la fatigue (57 %). 10,1 % des patients ont présenté une pneumopathie interstitielle diffuse, majoritairement de grade 1-2. Neuf patients sont décédés suite à un EI.
L’étude DESTINY-Gastric04
Une étude de phase III (DESTINY-Gastric04) est en cours. Elle compare le T-DXd au ramucirumab + paclitaxel, en deuxième ligne de traitement, chez des patients atteints d’un cancer de l’estomac ou de la jonction œsogastrique HER2+ ayant reçu au préalable un traitement à base de trastuzumab. L’objectif principal est d’évaluer l’efficacité et la tolérance du trastuzumab déruxtécan en deuxième ligne.
Ces résultats ont donc permis un accès précoce du trastuzumab déruxtécan (T-DXd) « dans le traitement des adénocarcinomes de la jonction œsogastrique et gastriques qui présentent une sur-expression du HER2, progressant pendant ou après un traitement antérieur à base de trastuzumab ».
Durvalumab / Cancer des voies biliaires non résécable ou métastatique
L’unique traitement curatif pour les cancers des voies biliaires reste la chirurgie. Toutefois, le diagnostic de cholangiocarcinome reste tardif et seulement 10-40 % des patients pourront bénéficier d’un geste chirurgical. Le taux de récidive reste élevé́ chez ces patients, avec 60 % ou plus qui rechuteront dans les 12 mois.
Pour les cancers avancés ou métastatiques, une chimiothérapie palliative peut être proposée aux patients éligibles. Le traitement repose principalement sur l’association de gemcitabine/cisplatine en phase métastatique chez les patients avec un PS 0-1, comme montré dans l’étude de phase III ABC-02. Il existe une amélioration de la survie globale avec l’association cisplatine/gemcitabine par rapport à la gemcitabine seule, avec une médiane de survie globale de 11,7 versus 8,1 mois (HR = 0,64 ; IC 95 % = 0,52-0,80 ; p < 0,0010) (13).
L’étude TOPAZ-1 (14)
Schéma et résultats – Le bénéfice de l’association du durvalumab à la chimiothérapie par gemcitabine/cisplatine a été démontré dans l’étude de phase III TOPAZ-1 randomisée, double aveugle, pour la survie globale (HR = 0,80 ; IC 97 % = 0,64 ; 0,99 ; p = 0,021), et la survie sans progression (HR = 0,75 ; IC 95,19 % = 0,63-0,89 ; p < 0,001).
Ces résultats ont permis un accès précoce du durvalumab « en association à la chimiothérapie à base de gemcitabine/cisplatine dans le traitement des cancers de voies biliaires non résécables ou métastatiques ».
Ivosidénib / Cholangiocarcinome avancé non résécable ou métastatique avec une mutation de IDH1 R132
Les mutations dans l’enzyme IDH1 sont retrouvées dans 13 % des cas des cholangiocarcinomes intra-hépatiques et dans 1 % des cholangiocarcinomes extra-hépatiques.
L’étudeClarlDHy (15)
Schéma – L’étude de phase III ClarlDHy est une étude multicentrique, randomisée, double aveugle, qui a comparé l’administration d’un placebo versus ivosidénib chez les patients atteints d’un cancer des voies biliaires non résécable ou métastatique, qui ont été précédemment traités par au moins une ligne de traitement systémique.
Résultats – Le critère de jugement principal, la survie sans progression (SSP) a été de 2,7 mois dans le groupe ivosidénib et de 1,4 mois dans le groupe placebo, soit un gain de 1,2 mois (HR = 0,37 ; IC 95 % = 0,25-0,54 ; p < 0,0001). Parmi les critères de jugement secondaires, il n’y avait pas de différence significative de la SG entre les deux groupes : 10,3 mois dans le groupe ivosidénib versus 7,5 mois pour le groupe placebo (HR = 0,79 ; IC 95 % = 0,56-1,12 ; NS).
Malgré un gain faible en médiane de survie sans progression, l’ivosidénib a été approuvé en accès précoce chez les patients « en progression après deux lignes de traitement pour la maladie avancée non résécable et/ou métastatique, du fait de la pénurie des ressources thérapeutiques pour ce groupe de patients et de la gravité de cette maladie ».
Riprétinib / GIST métastatique en 4e ligne (16)
Les tumeurs stromales gastro-intestinales (GIST) sont des tumeurs mésenchymateuses rares du tube digestif. Ces tumeurs présentent une addiction oncogénique forte à KIT (85 % des cas) et PDGFRA. Le traitement des formes métastatiques repose sur l’imatinib en première ligne, le sunitinib en deuxième ligne et le régorafénib en troisième ligne.
L’étude INVICTUS
Schéma – Le riprétinib, inhibiteur de KIT et PDGFRA, a été évalué versus placebo dans l’essai de phase III INVICTUS. Parmi 139 patients inclus, 85 recevaient le riprétinib. Les deux tiers d’entre eux avaient reçu antérieurement au moins trois traitements et la plupart présentaient une mutation de l’exon 11 de KIT.
Résultats – La médiane de survie sans progression était significativement meilleure avec le riprétinib à 6,3 versus 1 mois (HR = 0,15 ; IC 95 % = 0,09-0,25 ; p < 0,0001). La survie globale, bien que non validée statistiquement du fait du plan d’analyse, était de 15,1 contre 6,6 mois.
Tolérance – Les toxicités rapportées les plus fréquentes étaient l’alopécie (49 %), les myalgies (27 %), les nausées (25 %) et la fatigue (24 %).
Le riprétinib est donc actuellement disponible en accès précoce dans l’indication « traitement des patients adultes atteints de tumeur stromale gastro-intestinale avancée qui ont été précédemment traités avec au moins trois inhibiteurs de kinase, dont imatinib ».
Nivolumab / CUIM à haut risque de récidive après une exérèse complète
Le traitement standard pour les carcinomes urothéliaux infiltrant le muscle (CUIM) comporte une chimiothérapie néoadjuvante à base de cisplatine, suivie d’une chirurgie complète. Néanmoins, la moitié des patients n’est pas éligible au traitement de référence du fait d’une altération de l’état général ou d’une insuffisance rénale. Même si le traitement initial est mené de façon optimale, on constate un taux de récidive élevé, 50 % des patients seront métastatiques dans les 2 premières années, d’où l’intérêt de développer des stratégies adjuvantes.
L’étude CheckMate 27414 (17)
Schéma – L’essai de phase III CA209274 (CheckMate 27414), randomisé en double aveugle, a proposé d’évaluer l’efficacité́ et la tolérance d’une monothérapie par nivolumab versus placebo dans le traitement adjuvant du carcinome urothélial. Parmi 709 patients inclus, 353 ont reçu le nivolumab.
Résultats – La médiane de survie sans maladie (SSM) était significativement meilleure avec le nivolumab à 20,8 versus 10,8 mois avec le placebo, soit un gain de 9,9 mois en faveur du nivolumab (HR = 0,70 ; IC 98,22 % : 0,55-0,90 ; p = 0,0008). Dans le sous-groupe de patients avec une tumeur dont PD-L1 était ≥ 1 %, la médiane de SSM n’était pas atteinte dans le bras nivolumab versus 8,41 mois (HR = 0,55 ; IC 98,72 % = 0,35-0,85 ; p = 0,0005). Les données de survie globale (SG) étaient immatures lors de la première analyse intermédiaire.
Tolérance – On note des arrêts de traitement pour EI chez 18,2 % des patients du groupe nivolumab et 9,2 % des patients du groupe placebo.
À noter qu’environ 60 % des tumeurs présentaient une expression PD-L1 inférieure à 1. L’indication a été restreinte par l’EMA au sous-groupe avec expression du PD-L1 ≥ 1 %.
À partir de ces résultats, le nivolumab a reçu un avis favorable et est désormais disponible en accès précoce pour le traitement adjuvant « des patients adultes atteints de carcinome urothélial infiltrant le muscle (CUIM) à haut risque de récidive après exérèse complète, dont les cellules tumorales expriment PD-L1 au seuil ≥ 1 %, ayant reçu une chimiothérapie néoadjuvante, ou n’ayant pas reçu de chimiothérapie néoadjuvante et non éligibles/ou ayant refusé une chimiothérapie adjuvante à base de cisplatine ».
Enfortumab védotin / Carcinome urothélial localement avancé ou métastatique
Le traitement standard des tumeurs de la vessie localement avancées ou métastatiques repose en première ligne sur une polychimiothérapie à base de sels de platine. En cas de stabilité de la maladie en post-sel de platine, un entretien avec de l’avélumab est recommandé.
En deuxième ligne, une immunothérapie (pembrolizumab, atézolizumab et nivolumab) est recommandée (seul le pembrolizumab est pris en charge en France dans cette indication). En cas de récidive post-immunothérapie, les alternatives disponibles sont l’enfortumab védotin, les chimiothérapies à base de taxanes (docétaxel, paclitaxel) et la vinflunine.
L’enfortumab védotin est un conjugué anticorps-médicament (CAM) qui cible la nectine-4, une protéine d’adhésion située à la surface des cellules urothéliales cancéreuses. Il comprend un anticorps de type IgG1 kappa humain, conjugué à l’agent de perturbation des microtubules MMAE. Ce médicament entraîne une libération de la MMAE qui déstabilise le réseau de microtubules au sein de la cellule engendrant ainsi la mort cellulaire par apoptose.
L’étude EV-301 (18)
Schéma – L’enfortumab védotin a été évalué versus une chimiothérapie (docétaxel, paclitaxel, ou vinflunine) dans l’essai de phase III EV-301. Parmi 608 patients inclus, 301 recevaient l’enfortumab védotin.
Résultats – La médiane de survie sans progression était meilleure avec l’enfortumab védotin 5,55 versus 3,71 mois (HR = 0,62 ; IC 95 % = 0,51-0,75 ; p < 0,001). La survie globale était plus longue avec une médiane de 12,88 versus 8,97 mois (HR= 0,70 ; IC 95 % = 0,56-0,89 ; p = 0,001).
Tolérance – L’incidence des EI était similaire dans les deux groupes (93,9 % pour l’enfortumab védotin versus 91,8 % dans le bras de chimiothérapie).
L’enfortumab védotin est actuellement disponible en accès précoce dans l’indication en monothérapie pour le traitement « des patients adultes atteints d’un carcinome urothélial localement avancé ou métastatique, ayant reçu précédemment une chimiothérapie à base de sels de platine et un inhibiteur du récepteur de mort programmée-1 ou un inhibiteur du ligand du récepteur de mort programmée ».
[177Lu]-Lu-PSMA-617 / Cancer de la prostate résistant à la castration et métastatique
Pour les cancers de la prostate métastatique, la première ligne de traitement systémique repose sur la suppression androgénique (ADT), en association soit à une chimiothérapie par docétaxel soit à une hormonothérapie de nouvelle génération (apalutamide/abiratérone/enzalutamide). En cas de progression, une alternance entre les deux options est envisageable, sans qu’il existe un consensus sur la séquence thérapeutique optimale. En cas d’échec de ces traitements, le cabazitaxel représente une autre possibilité de traitement.
Le Lu-PSMA-617 est une thérapie ciblée par radio-ligand qui délivre le rayonnement d’une particule bêta aux cellules exprimant le PSMA et au microenvironnement.
L’étude VISION (19)
Schéma – L’essai VISION de phase III international et randomisé, mené en essai ouvert, a eu comme objectif d’évaluer le 177Lu-PSMA-617 chez des hommes atteints d’un CPRCm exprimant le PSMA, résistants à la castration et préalablement traités par une hormonothérapie de nouvelle génération et une chimiothérapie à base de taxane. Les patients ont été randomisés 2:1 dans le groupe 177Lu-PSMA-617 associé au meilleur traitement standard (TS) versus meilleur TS seul.
Résultats – Le 177Lu-PSMA-617 associé au TS a entraîné une amélioration significative de la survie sans progression radiologique (SSPr), comparativement au TS seul (SSPr médiane de 8,7 contre 3,4 mois, soit une différence de 5,3 mois entre les deux groupes) (HR = 0,4 ; IC 99,2 % = 0,29-0,57 ; p < 0,001). Une amélioration significative de la SG a également été observée, comparativement au TS seul (SG médiane : 15,3 contre 11,3 mois, soit une différence de 4 mois en faveur du groupe expérimental) (HR = 0,62 ; IC 95 % = 0,52-0,74 ; p < 0,001).
Le 177Lu-PSMA-617 est donc désormais accessible en accès précoce pour « le traitement des adultes atteints d’un cancer de la prostate progressif, métastatique, résistant à la castration, exprimant des récepteurs au PSMA et qui ont été traités par une chimiothérapie par taxane (pour les patients éligibles) et au moins une hormonothérapie dite de seconde génération ».
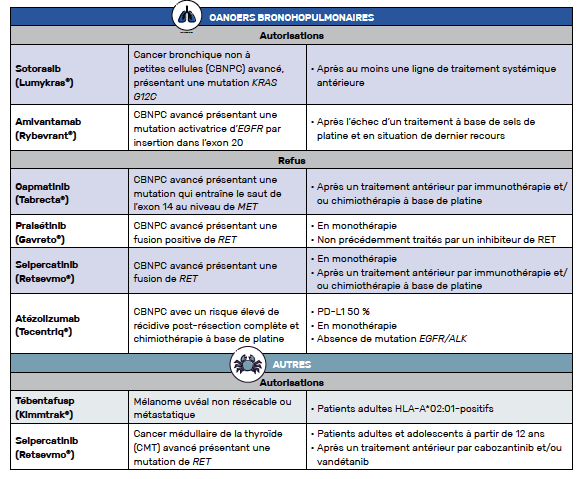
Sotorasib / CBNPC avec une mutation activatrice p.G12C
La mutation KRAS G12C est la plus fréquemment rencontrée dans les cancers bronchiques non à petites cellules (CBNPC) avec une prévalence de 14 %.
L’étude CodeBreak 100 (20)
Schéma – La phase d’expansion de l’étude de phase I/II CodeBreak 100, de type basket, en ouvert, simple bras, a concerné 224 patients adultes atteints d’un cancer solide avancé, dont 126 avec un CBNPC, présentant la mutation KRAS G12C. 123 patients ont été inclus dans l’analyse d’efficacité, l’histologie était en majorité non épidermoïde.
Résultats – Le taux de réponse objective (objectif principal) a été de 37,4 % (IC 95% = 28,8-46,6), en majorité des réponses partielles (36 %), 43 % de stabilité et 16 % de progression. La durée médiane de réponse a été de 8,4 mois (IC 95 % = 6,9-8,4), le délai médian avant réponse était de 1,35 mois (min-max : 1,2-6,1), la médiane de survie sans progression de 6,7 mois (IC 95 % : 4,9-8,1) et la médiane de survie globale de 12,0 mois (IC 95 % : 9,5-NE).
Tolérance – Le profil de toxicité du sotorasib reste important, avec 99 % des patients qui ont rapporté un EI, dont 61 % de grades ≥ 3. À noter une proportion pas négligeable d’EI évoluant vers le décès (16 %). Les principaux effets secondaires rapportés ont été : diarrhée, nausées et vomissements, fatigue, arthralgies, cytolyse hépatique, dyspnée, toux – généralement réversibles.
L’étude CodeBreak 200
Une étude de phase III (CodeBreak 200) a été menée en ouvert, randomisée versus docétaxel chez des patients atteints d’un CBNPC localement avancé non résécable ou métastatique ayant progressé ou rechuté après au moins une ligne antérieure. Le recrutement est terminé, les résultats sont en attente.
Il y aura également des données de l’ATU de cohorte entre le 04/08/2021 et le 29/10/2021 avec plus de 800 patients traités par sotorasib.
Le sotorasib est maintenant accessible en accès précoce « en monothérapie dans le traitement des patients adultes atteints d’un cancer bronchique non à petites cellules (CBNPC) avancé, présentant la mutation KRAS G12C, dont la maladie a progressé après au moins une ligne de traitement systémique antérieur ».
Amivantamab / CBNPC avancé, avec mutations activatrices de l’EGFR par insertion dans l’exon 20
Les mutations activatrices d’EGFR sont les plus fréquentes mutations dans les CBNPC, entre 15-20 % des adénocarcinomes bronchiques chez les patients d’origine caucasienne et jusqu’à 50 % des cas chez les patients d’origine asiatique. Toutes ces mutations ne sont pas sensibles aux inhibiteurs de tyrosine kinase anti-EGFR.
Par exemple, les insertions dans l’exon 20 (environ 2 % des CBNPC) entraînent une activation constitutive de l’EGFR et sont associées à une résistance de novo aux inhibiteurs de tyrosine kinase anti-EGFR.
L’amivantamab (JNJ-61186372) est un anticorps monoclonal IgG1 bispécifique qui cible EGFR et MET, récepteurs transmembranaires activant des voies de signalisation intracellulaire qui vont stimuler la croissance cellulaire. De plus, l’activation de la voie MET a été souvent décrite comme un mécanisme de résistance aux inhibiteurs de tyrosine kinase anti-EGFR.
L’étude CHRYSALIS10 (21)
Schéma – L’étude de phase I/II CHRYSALIS10 est une étude non comparative, multicentrique, d’escalade et d’expansion de dose étudiant l’amivantamab en monothérapie chez 114 patients présentant un CBNPC avancé avec une mutation EGFR par insertion dans l’exon 20 et précédemment traités par chimiothérapie à base de sels de platine. Le critère d’évaluation principal de l’efficacité était le taux de réponse globale (ORR). Les critères d’évaluation secondaires incluaient la durée de réponse, la survie sans progression et la survie globale.
Résultats – Après un suivi médian de 12,5 mois, l’ORR a été de 36,8 % (IC 95% = 28,0-46,4), essentiellement des réponses partielles.
Les résultats préliminaires sur les critères de jugement secondaires ont été : une durée médiane de réponse de 12,5 mois (IC 95 % = 6,5-16,1), une médiane de survie sans progression de 6,9 mois (IC 95 % = 5,6-8,6) et une médiane de survie globale de 22,8 mois (IC 95 % = 17,5-NE).
Ces résultats ont donc permis un accès précoce de l’amivantamab « dans le traitement du cancer bronchique non à petites cellules (CBNPC) avancé avec mutations activatrices du récepteur du facteur de croissance épidermique (EGFR) par insertion dans l’exon 20, après l’échec d’un traitement à base de sels de platine et en situation de dernier recours ».
Tébentafusp / Mélanome uvéal métastatique
Le tébentafusp est une protéine de fusion bispécifique ciblant gp100 (un antigène associé au mélanome) via un domaine de liaison au récepteur des lymphocytes T (TCR) et un anti-CD3 redirigeant les lymphocytes T contre les cellules tumorales exprimant gp100. Cette classe thérapeutique est connue sous le nom de T cell engager, car elle permet de créer une synapse immunologique entre les lymphocytes T effecteurs et les cellules tumorales.
L’étude (22)
Schéma – Cette indication repose sur l’essai ouvert de phase III évaluant le tébentafusp versus un traitement au choix de l’investigateur (pembrolizumab, ipilimumab ou dacarbazine) chez des patients HLA-A*02:01 positif présentant un mélanome uvéal métastatique en première ligne.
Résultats – La survie globale à 1 an était de 73 % dans le groupe tébentafusp versus 59 % dans le groupe témoin avec une RR de 0,51 (IC 95 % = 0,37-0,71 ; p < 0,001).
Le tébentafusp est donc désormais accessible en accès précoce pour le traitement « en monothérapie des patients adultes HLA-A*02:01-positif atteints de mélanome uvéal non résécable ou métastatique ».
Selpercatinib / Cancer médullaire de la thyroïde RET mutés
Le cancer médullaire de la thyroïde (CMT) est un cancer rare qui représente 5 à 10 % des cancers de la thyroïde, le plus souvent sporadique. Dans 30 % des cas, une origine familiale ou héréditaire est incriminée, étant lié à une mutation du gène RET. Il y a plusieurs variants phénotypiques des mutations germinales de RET. La présence d’un CMT RET muté s’intègre dans le cadre d’une néoplasie endocrinienne multiple de type 2 (NEM 2).
Le traitement du CMT au stade localisé repose sur une résection chirurgicale (thyroïdectomie totale). Au stade métastatique et en cas de maladie agressive et symptomatique, le traitement repose sur deux inhibiteurs de tyrosine kinase, le vandétanib et le cabozantinib ; en cas de progression, il n’y a pas d’alternatives disposant d’une AMM.
Le selpercatinib est un inhibiteur de tyrosine kinase qui cible spécifiquement les transcrits issus de réarrangement de RET.
L’étude LIBRETTO-001 (23)
Schéma – L’étude LIBRETTO-001 est un essai de phase I/II non comparatif, multicentrique, qui a évalué la sécurité et la tolérance du selpercatinib chez des patients ayant une tumeur solide avancée, ou un cancer médullaire de la thyroïde ou d’autres tumeurs avec une mutation activatrice de RET.
Résultats – À la première analyse intermédiaire (après un suivi de 12 mois), le taux de réponse objective lors du traitement par selpercatinib a été́ de 67,7 % (IC 95 % = 58,8-75,9). Parmi les critères de jugement secondaires, la durée médiane de la réponse, la médiane de survie sans progression et la médiane de survie globale n’ont pas été atteintes. La survie sans progression à 1 an a été de 82 % (IC 95 % = 69-90).
Ces résultats ont permis un accès précoce du selpercatinib en monothérapie « pour le traitement des patients atteints d’un cancer médullaire de la thyroïde (CMT) avancé, présentant une mutation du gène RET, qui nécessitent un traitement systémique après un traitement antérieur par cabozantinib et/ou vandétanib ».
Ce dispositif dérogatoire exceptionnel permet l’accès rapide aux molécules innovantes, avant l’obtention d’un remboursement par l’Assurance maladie. On peut néanmoins regretter le refus de prise en charge de certaines molécules, dont des inhibiteurs de RET (selpercatinib et pralsétinib) dans les cancers bronchiques non à petites cellules, malgré des bénéfices thérapeutiques très importants pour nos patients. Nous attendons avec impatience les prochaines validations et nous nous engageons à vous tenir informés en publiant régulièrement des articles sur les nouvelles molécules disponibles.
Luiza Purcari déclare ne pas avoir de liens d’intérêt en rapport avec ce dossier. Éve-Marie Neidhardt déclare avoir des liens d’intérêt avec Immunocore.
Bibliographie
1. Schmid P, Cortes J, Dent R et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. New Engl J Med 2022 ; 386 : 556‑67.
2. Tuut ANJ, Garber JE, Kaufman B et al. Adjuvant olaparib for patients with BRCA1- or BRCA2-mutated breast cancer. N Engl J Med 2021 ; 384 : 2394-405.
3. Cortes J, Kim SB, Chung WP et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med 2022 ; 386 : 1143-54.
4. Modi S, Jacot W, Yamashita T et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022 ; 387 : 9-20.
5. Makker V, Colombo N, Casado Herraez A et al. Lenvatinib plus pembrolizumab for advanced endometrial cancer. N Engl J Med 2022 ; 386 : 437-48.
6. Colombo N, Dubot C, Lorusso D et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med 2021 ; 385 : 1856-67.
7. Sun JM, Shen L, Shah MA et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 2021 ; 398 : 759-71.
8. Kelly RJ, Ajani JA, Kuzdzal J et al. Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer. N Engl J Med 2021 ; 384 : 1191-203.
9. Janjigian YY, Shitara K, Moehler M et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021 ; 398 : 27-40.
10. Shitara K, Ajani JA, Moehler M et al. Nivolumab plus chemotherapy or ipilimumab in gastro-oesophageal cancer. Nature 2022 ; 603 : 942-8.
11. Shitara K, Bang YJ, Iwasa S et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer. N Engl J Med 2020 ; 382 : 2419-30.
12. Ku GY, Di Bartolomeo M, Smyth E et al. 1205MO – Updated analysis of DESTINY-Gastric02: A phase II single-arm trial of trastuzumab deruxtecan (T-DXd) in western patients (Pts) with HER2-positive (HER2+) unresectable/metastatic gastric/gastroesophageal junction (GEJ) cancer who progressed on or after trastuzumab-containing regiment. Ann Oncol 2022 ; 33 : S555-80.
13. Valle J, Wasan H, Palmer DH et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010 : 362 : 1273-81.
14. Oh DY, Lee KH, Yoon J et al. Durvalumab plus gemcitabine and cisplatin in advanced biliary tract cancer. Lancet Gastroenterol Hepatol 2022 ; 7 : 522-32.
15. Zhu AX, Macarulla T, Javle MM et al. Final overall survival efficacy results of ivosidenib for patients with advanced cholangiocarcinoma with IDH1 mutation the phase 3 randomized clinical ClarIDHy trial. JAMA Oncol 2021 ; 7 : 1669-77.
16. Blay JY, Serrano C, Heinrich MC et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebocontrolled, phase 3 trial. Lancet Oncol 2020 ; 21 : 923-34.
17. Bajorin DF, Witjes JA, Gschwend JE et al. Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl J Med 2021 ; 384 : 2102-14.
18. Powels T, Rosenberg JE, Sonpavde GP et al. Enfortumab vedotin in previously treated advanced urothelial carcinoma. N Engl J Med 2021 ; 384 : 1125-35.
19. Sartor O, de Bono J, Chi KN et al. Lutetium-177–PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021 ; 385 : 1091-103.
20. Skoulidis F, Li BT, Dy GK et al. Sotorasib for lung cancers with KRAS p.G12C mutation. N Engl J Med 2021 ; 1384 : 2371-81.
21. Park K, Haura EB, Leighl NB et al. Amivantamab in EGFR exon 20 insertion-mutated non-small-cell lung cancer progressing on platinum chemotherapy: initial results from the CHRYSALIS phase I study. J Clin Oncol 2021 ; 39 : 3391-340.
22. Wirth LJ, Sherman E, Robinson B et al. Efficacy of selpercatinib in RET-altered thyroid cancers. N Engl J Med 2020 ; 383 : 825-35.
23. Nathan P, Hassel JC, Rutkowski P et al. Overall survival benefit with tebentafusp in metastatic uveal melanoma. New Engl J Med 2021 ; 385 : 1196‑206.