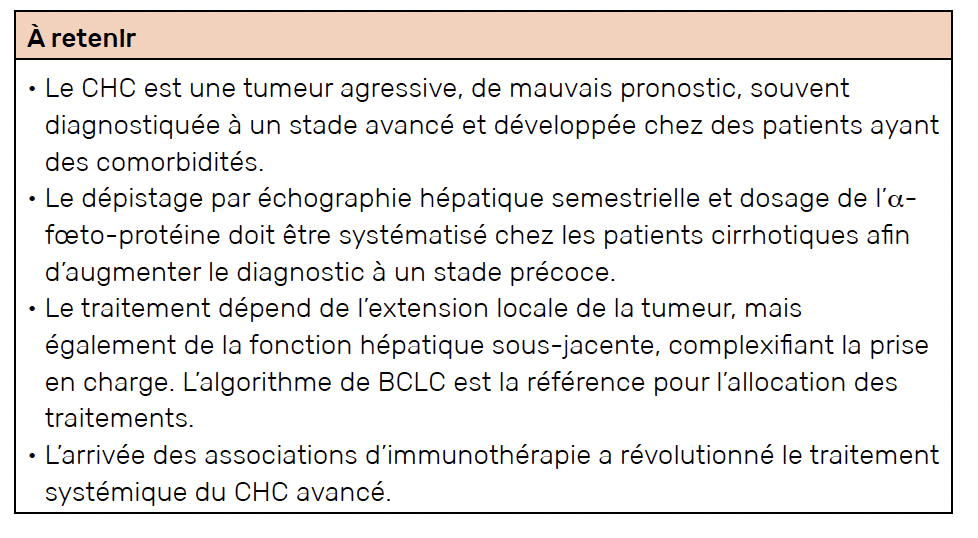
Résumé
Le carcinome hépatocellulaire (CHC) est la tumeur primitive du foie la plus fréquente. Il se développe en Occident sur foie de cirrhose dans plus de 80 % des cas. Le dépistage est recommandé par échographie abdominale semestrielle et dosage de l’α-fœto-protéine lorsque la cirrhose est connue. En dehors du dépistage, le diagnostic est souvent fait à un stade tumoral avancé (tumeur multinodulaire avec invasion vasculaire, maladie extra-hépatique) ou devant des signes de cirrhose évoluée (insuffisance hépatique, hypertension portale). En cas de cirrhose avérée, l’histologie tumorale n’est pas forcément nécessaire au diagnostic si le(s) nodule(s) présente(nt) des caractéristiques spécifiques à l’imagerie (hypervascularisation artérielle avec lavage au temps portal).
La prise en charge de cette tumeur dépend de son extension, de l’état général et de la fonction hépatique du patient. Le choix de la stratégie thérapeutique est décidé en RCP « tumeurs primitives du foie » et s’appuie sur un algorithme thérapeutique relativement consensuel (classification BCLC). La transplantation hépatique est un traitement radical permettant de traiter la tumeur et la cirrhose. Elle n’est cependant pas souvent possible en raison de la pénurie de greffons, des comorbidités des patients et de la progression tumorale pendant l’attente de greffe. Les autres traitements dits curatifs sont la résection chirurgicale et les ablations percutanées, pour lesquelles plusieurs techniques sont maintenant disponibles. Ces approches curatives ne sont possibles que pour les tumeurs limitées en taille et avec fonction hépatique préservée. Les traitements dits palliatifs comprennent l’embolisation ou chimio-embolisation intra-artérielle, la radiothérapie interne sélective. L’apport récent des thérapies systémiques incluant des immunothérapies ont changé la prise en charge des patients avec CHC avancé.
Introduction
Physiopathologie
Le carcinome hépatocellulaire (CHC) se développe à partir d’hépatocytes mutés. Il s’agit d’une tumeur richement vascularisée grâce à une importante néoangiogenèse. Il a un fort potentiel d’invasion macro-vasculaire notamment des branches portales et d’extension métastatique, dont les localisations les plus fréquentes sont le poumon, l’os et le péritoine (1).
De multiples étiologies
L’infection chronique par le virus de l’hépatite B (VHB) est la première cause de CHC tous pays confondus. Dans les pays occidentaux, les étiologies les plus fréquentes sont la consommation chronique excessive d’alcool et l’infection par le virus de l’hépatite C (VHC) (2). L’hépatopathie dysmétabolique ou metabolic dysfunction-associated liver disease (MASLD), en lien avec les éléments du syndrome métabolique (surpoids, hypertension artérielle, dyslipidémie, diabète), devient un facteur de risque prépondérant. Chez la plupart des patients, plusieurs étiologies coexistent du fait de leur fréquence en population générale et influencent de façon synergique le processus de carcino-
genèse hépatique.
La cirrhose sous-jacente
Dans 80 à 90 % des cas, le CHC se développe en France sur un foie cirrhotique, quelle que soit la cause. C’est particulièrement le cas chez les patients ayant une consommation excessive d’alcool ou une infection chronique par le VHC, chez qui les éléments du syndrome métabolique sont souvent présents. Néanmoins, il existe des CHC sur foie parfaitement sain ou plus fréquemment sur foie d’hépatopathie chronique non cirrhotique, notamment chez les patients infectés par le VHB ou ayant une MASLD (1).
Épidémiologie et prévention
Une incidence en hausse
Le CHC représente 90 % des cancers primitifs du foie. Son incidence est en constante et globale augmentation, il est devenu le sixième cancer le plus fréquent avec plus de 850 000 nouveaux cas par an et la troisième cause de mortalité par cancer dans le monde après le cancer du poumon et le cancer colorectal (3). La répartition géographique est inégale, avec 85 % des CHC survenant en Afrique subsaharienne et en Asie du Sud-Est du fait de l’endémie liée à l’infection par le virus de l’hépatite B (VHB). En Europe, le CHC est plus fréquent dans les pays du sud et du pourtour méditerranéen (2). En France, l’incidence était de 11 658 nouveaux cas en 2023, chez des patients dont l’âge médian est de 70 ans. La prépondérance masculine est nette avec un sex-
ratio de plus de trois hommes atteints pour une femme (4).
Prévenir le CHC
Prévenir l’apparition ou l’aggravation d’une hépatopathie chronique préexistante permet de diminuer l’incidence du CHC :
• sensibilisation sur les risques addictologiques : consommation d’alcool chronique et usage de drogues par voie veineuse ;
• éducation diététique : alimentation équilibrée, prévention du surpoids et du diabète ;
• vaccination contre le VHB ;
• éradication du VHC par traitement universel ;
• traitement du VHB selon les recommandations de sociétés savantes.
Dépistage
Objectif
Le dépistage du CHC a pour objectif d’en faire diminuer la mortalité associée. Il permet la détection de nodule hépatique à un stade précoce offrant la possibilité de proposer plus souvent un traitement à visée curative et d’augmenter la survie sans récidive (5). Le dépistage est fondé sur un examen non invasif simple : l’échographie hépatique semestrielle (2).
Le dosage sérique d’α-fœto-protéine est sujet à discussion pour le dépistage. Il est actuellement recommandé par la Société française d’hépatologie (AFEF) dans le dépistage, en association avec l’échographie (6).
Le dépistage du CHC n’est pas recommandé en population générale, mais dans des populations exposées à un risque globalement supérieur à 1 % par an, à savoir les patients cirrhotiques et certains patients non cirrhotiques avec fibrose extensive.
Les patients cirrhotiques
Cet examen doit être systématiquement proposé aux patients cirrhotiques, quelle qu’en soit l’origine. D’une façon générale, la compliance à cette échographie et le respect du délai d’intervalle de 6 mois permettent d’améliorer la survie des patients cirrhotiques avec diagnostic de CHC (2).
Fait important, alors que la plupart des patients infectés par le VHB ou VHC sont respectivement contrôlés ou éradiqués grâce aux progrès récents des traitements antiviraux, ces patients doivent être maintenus dans des programmes de dépistage du CHC du fait de la persistance d’un risque résiduel de CHC (7).
Certains patients non cirrhotiques
Chez les patients non cirrhotiques, le dépistage échographique est indiqué en cas de fibrose extensive :
• patients suivis pour hépatite C en cas de fibrose ≥ F3 selon le score Metavir, même après guérison virologique (8) ;
• patients traités pour hépatite B chronique, quel que soit le stade de fibrose hépatique (9) ;
• patients suivis pour un portage inactif du VHB à risque intermédiaire ou élevé de CHC (score de PAGE-B > 9) (10) ;
Le dépistage des autres patients F3, notamment sur hépatopathie dysmétabolique, est soumis à l’évaluation du risque individuel du patient (selon sexe, âge, antécédents familiaux, origine ethnique et comorbidités) par le médecin, mais sans recommandations claires.
Diagnostic de CHC
Selon les recommandations européennes de l’EASL, le diagnostic de CHC se fait par imagerie typique et/ou par histologie.
Un diagnostic parfois non invasif
L’échographie
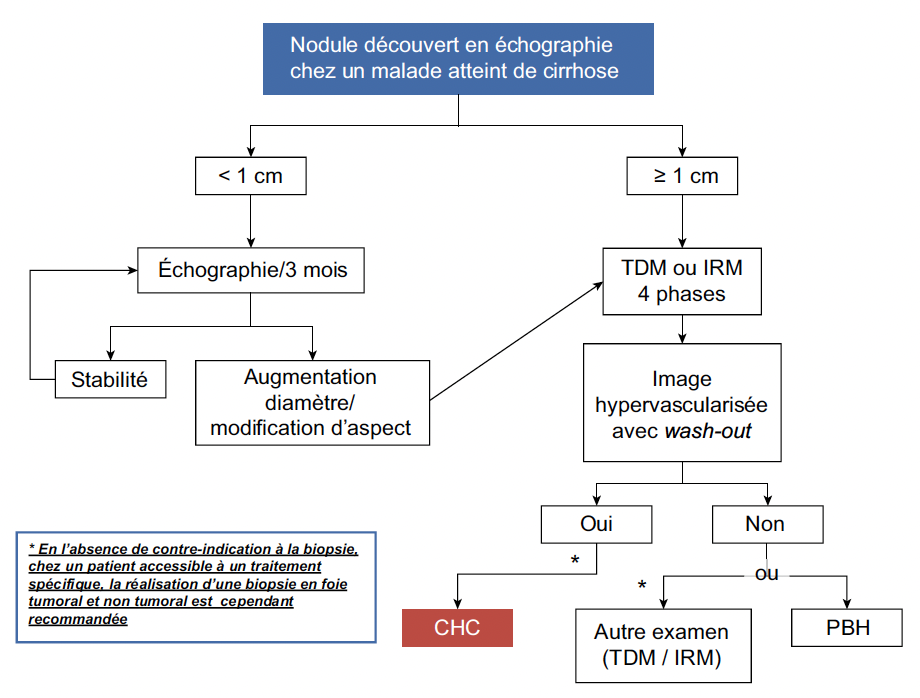
L’échographie est souvent le premier examen réalisé révélant un ou des nodule(s) hépatique(s). Faisant suite à cette découverte, une procédure diagnostique codifiée sera appliquée (Fig. 1).
Figure 1 – Diagnostic non invasif du carcinome hépatocellulaire (TNCD carcinome hépatocellulaire 2023).
Pour un nodule inférieur à 1 cm
Il faut recontrôler précocement par une échographie tous les 3 mois pendant 1 an, afin de repérer une augmentation de taille du nodule. Si le nodule ne se modifie pas après 1 an, le dépistage reprend tous les 6 mois.
Pour un nodule supérieur à 1 cm
Il est nécessaire de compléter par une imagerie en coupe avec injection de produit de contraste : scanner ou IRM, avec séquence au temps artériel, portal et tardif. Le CHC a des caractéristiques radiologiques particulières du fait de sa vascularisation artérielle : une prise de contraste précoce au temps artériel puis un effet de lavage au temps portal et/ou tardif (hypodensité par rapport au foie non tumoral adjacent). Sur un foie de cirrhose, en présence de ces critères radiologiques précis, le diagnostic non invasif de CHC peut être posé.
L’apport de l’histologie
En cas de foie non cirrhotique ou d’aspect atypique en imagerie, l’examen histologique est nécessaire, pour ne pas méconnaître un autre diagnostic (lésions secondaires hépatiques, cholangiocarcinome, tumeur bénigne) (2). Il se fait par ponction-biopsie hépatique écho-guidée. La biopsie n’est donc pas définitivement mise de côté. De plus, elle permet, d’une part, de s’assurer du diagnostic et, d’autre part, d’examiner également le foie non tumoral adjacent.
Par ailleurs, l’examen histologique permet de classer le CHC en fonction des sous-types histologiques décrits associés à différentes valeurs pronostiques et des implications thérapeutiques futures importantes (11). Notons qu’actuellement il n’existe aucun biomarqueur pronostique ou permettant d’orienter le choix de traitement validé en pratique clinique.
Une confirmation histologique est également demandée dans la plupart des essais thérapeutiques.
Prise en charge
Le diagnostic de CHC et la décision de traitement doivent être discutés lors d’une réunion de concertation pluridisciplinaire (RCP) spécialisée, comprenant au moins un hépatologue, un radiologue interventionnel et un chirurgien hépatique/transplanteur.
Les critères de choix du traitement
Le bilan d’extension
Il comprend une imagerie hépatique avec injection de produit de contraste (TDM et/ou IRM) et un scanner thoracique.
Un scanner cérébral et une scintigraphie osseuse ne seront faits que sur point d’appel clinique (12).
Les paramètres à évaluer
Pour discuter le choix de traitement d’un CHC, il faut évaluer plusieurs paramètres indispensables :
• l’état général du patient : statut OMS (performans status ou PS), comorbidités, contre-indication anesthésique ;
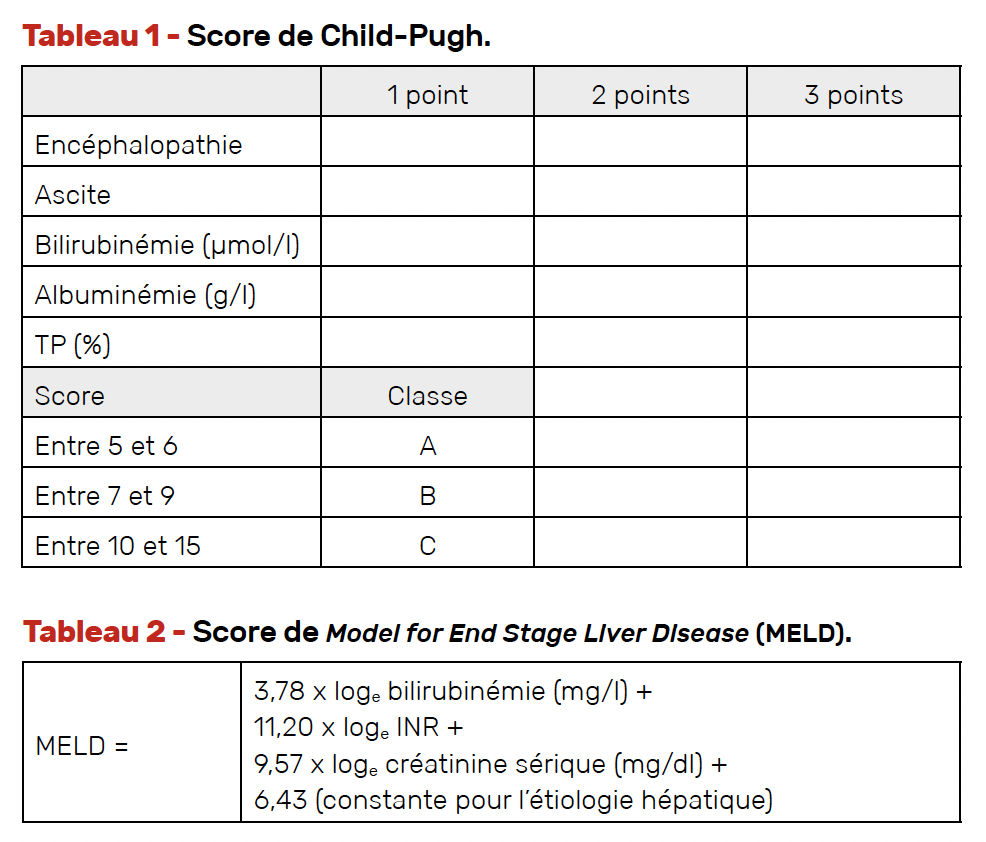
• la fonction hépatique : score de Child-Pugh (Tab. 1), score de MELD (Tab. 2), degré d’hypertension portale (varices œsophagiennes, thrombopénie, circulation collatérale abdominale, mesure du gradient de pression par cathétérisme hépatique et volumétrie du foie en cas de chirurgie hépatique) ;
• les caractéristiques tumorales : nombre et taille des nodules, localisation, caractère infiltrant, envahissement macro-vasculaire, extension extra-hépatique.
Le dosage de l’α-fœto-protéine
Il est intéressant lors de la prise en charge. En effet, il servira comme valeur de référence avant traitement et dans le suivi, sachant qu’une proportion non négligeable de CHC ne sécrète pas d’α-fœto-protéine. Par ailleurs, un taux augmenté a une valeur pronostique péjorative.
La classification Barcelona Clinic Liver Cancer
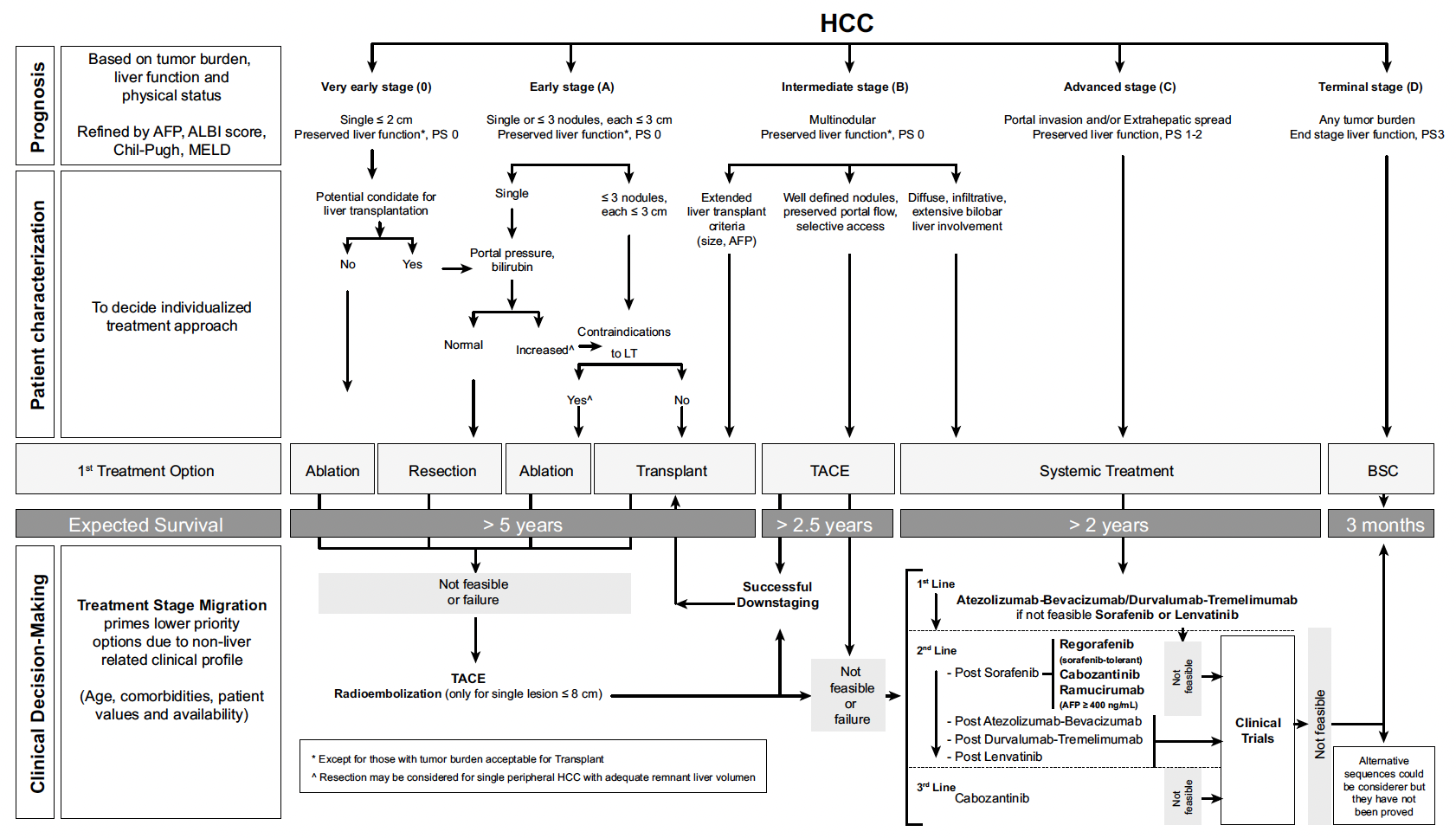
Plusieurs classifications ont été évaluées pour aider la prise en charge du CHC, mais la classification Barcelona Clinic Liver Cancer (BCLC) est la plus largement utilisée, car elle tient compte des trois éléments décrits précédemment : état général, fonction hépatique et paramètres tumoraux (Fig. 2) (13).
Figure 2 – Classification de Barcelone (13).
Cette classification décrit cinq stades de CHC :
• BCLC 0 = très précoce,
• BCLC A = précoce,
• BCLC B = intermédiaire,
• BCLC C = avancé,
• BCLC D = terminal.
Cette classification sert également d’algorithme de traitements en fonction des stades (14) :
• pour les stades BCLC 0 et A, un traitement à visée curative doit être entrepris : transplantation hépatique, résection chirurgicale ou ablation percutanée ;
• au contraire, pour les stades BCLC B et C, un traitement palliatif sera proposé : (chimio-)embolisation intra-artérielle, radio-embolisation, thérapie systémique ou soins de confort ;
• pour le stade D, des soins de confort exclusifs seront proposés.
Les traitements à visée curative
La transplantation hépatique
Depuis 2014, le CHC est devenu le premier motif d’inscription sur liste de greffe hépatique en France. Il s’agit d’un traitement radical traitant le CHC et la maladie causale. Malheureusement, compte tenu de la pénurie de greffons, seuls 399 CHC ont été transplantés par an en France, soit 4 % de l’ensemble des diagnostics annuels (15).
Indications
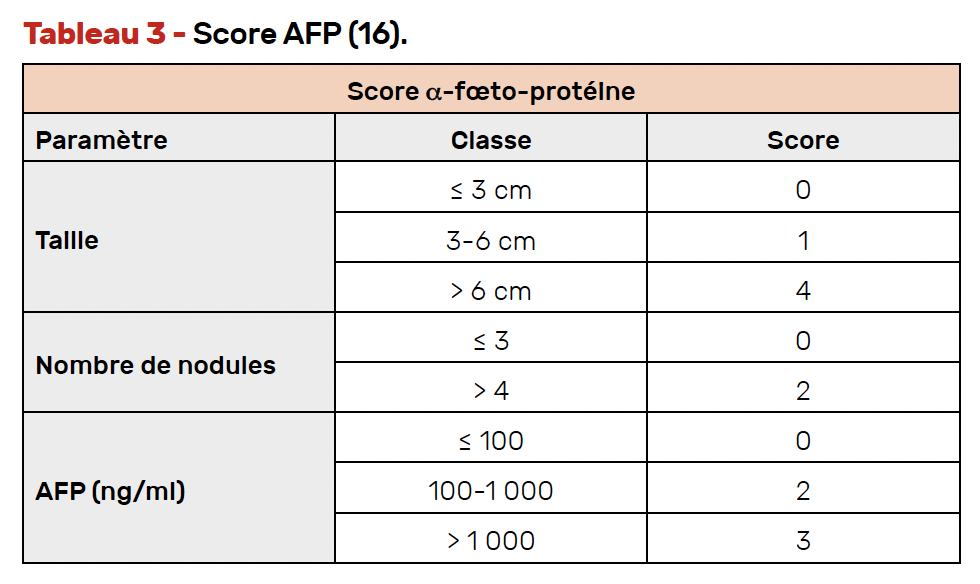
Les indications de transplantation relèvent de critères stricts très spécifiques tenant compte du nombre de nodules, de leur taille et, depuis récemment, du taux d’α-fœto-protéine afin de limiter le risque de récidive tumorale après greffe.
Ces critères sont résumés dans le score AFP qui prédit le taux de récidive après transplantation (Tab. 3) (16).
À noter que certains patients hors critères peuvent être ramenés dans les critères via un down-staging (12).
Résultats
Les résultats de survie post-transplantation pour CHC sont bons, avec 70 % de survie à 5 ans, et de 8 à 12 % de récidive, malgré une mortalité péri-opératoire entre 5 et 10 % (16).
Traitements d’attente
En raison d’un délai moyen d’attente après inscription sur liste de transplantation hépatique de 12 à 18 mois, il est souvent proposé des “traitements d’attente”, pour limiter la progression tumorale et ainsi la sortie de liste. Le traitement de première intention est en général une embolisation intra-artérielle ou une radiothérapie interne vectorisée (12).
La résection chirurgicale
Indications
La résection chirurgicale est à proposer en cas de CHC sur foie non cirrhotique ou cirrhotique, mais sans hypertension portale et avec excellente fonction hépatique. La meilleure indication est typiquement pour une tumeur unique, ou plusieurs lésions dans un seul lobe hépatique (2). Ce traitement est limité chez le patient cirrhotique par le risque post-opératoire d’insuffisance hépatique et notamment d’apparition d’ascite. Avant de décider une résection chirurgicale, il faut s’assurer, par volumétrie, que le foie restant est ≥ 40 % du foie total. Souvent, une embolisation portale homolatérale au CHC est réalisée pour hypertrophier le côté controlatéral et diminuer le risque de décompensation de cirrhose. La voie laparoscopique sera privilégiée dès que techniquement possible.
Résultats
La survie globale à 5 ans est de 50 % et la récidive survient dans 70 % des cas (locale sur la tranche de résection ou à distance) (17).
L’ablation percutanée
Du fait de leur considérable développement ces dernières années et de la possibilité de traitement curateur chez des patients fragiles ou non opérables, les ablations représentent la première indication thérapeutique du CHC en France aujourd’hui (18). Plusieurs techniques de destruction percutanée sont disponibles (19).
La technique de radiofréquence
La technique de radiofréquence est la plus développée. L’ablation tumorale repose sur le principe de destruction thermique de la tumeur. Elle est indiquée classiquement pour les lésions uniques ou multiples (≤ 3) de moins de 3 cm. Les résultats montrent une survie à 5 ans entre 60 et 68 % et des récidives locales et à distance dans 13 et 70 % à 5 ans respectivement (20).
L’avantage certain de l’ablation percutanée est une meilleure tolérance hépatique grâce à l’épargne parenchymateuse par rapport à la résection. La majorité des études montre ainsi un nombre de complications majeures significativement inférieur après la radiofréquence par rapport à la chirurgie (12).
Les thermoablations de type No Touch, reposant sur l’insertion de plusieurs électrodes autour des tumeurs permettant des thermoablations multibipolaires, sont de plus en plus développées (21). Cette technique est pratiquée dans plusieurs centres experts en France, proposant des ablations larges (> 3 cm) avec des résultats intéressants.
L’ablation par micro-ondes
L’ablation par micro-ondes est également une technique de destruction thermique, dont les indications se recoupent avec celles de la radiofréquence (22).
L’électroporation irréversible
L’électroporation irréversible est une technique récente qui utilise l’induction d’un courant électrique pulsé à travers la membrane cellulaire pour entraîner la formation de pores membranaires et l’apoptose des cellules tumorales. Cette dernière technique serait mieux tolérée sur le plan de la fonction hépatique et entraînerait moins de lésions locales thermiques, notamment lorsque le CHC est proche des voies biliaires ou des structures vasculaires (23).
Les traitements palliatifs
L’embolisation intra-artérielle hépatique
Il s’agit du traitement de première intention pour les CHC BCLC B, multinodulaire (12).
Principe et modalités
Le principe d’action repose sur l’arrêt de l’apport sanguin artériel intra-tumoral pour induire une nécrose ischémique.
La présence d’une thrombose porte ou d’une inversion du flux porte est une contre-indication à l’embolisation intra-artérielle, du fait d’un arrêt total d’apport sanguin hépatique.
Les modalités de l’embolisation ne sont pas consensuelles. Il peut s’agir d’une embolisation mécanique simple ou associée à de la chimiothérapie intra-artérielle (en général doxorubicine).
Résultats
Les résultats d’une méta-analyse de 2003 montrent une amélioration de la survie de 20 % à 2 ans (24). L’indication de ce traitement est limitée aux patients avec fonction hépatique conservée.
La radiothérapie interne sélective (RIS)
La place de la RIS dans la stratégie thérapeutique n’est pas formellement définie. Il existe des arguments, sur des études rétrospectives, pour un bénéfice chez les CHC BCLC B/C avec envahissement vasculaire (n’atteignant pas le tronc porte) (25).
Principe et modalités
Ce traitement consiste en l’injection intra-artérielle hépatique de microsphères porteuses d’un radioisotope (Yttrium-90 (90Y) ou Holium-166 (166Ho)), associant une embolisation et une radiothérapie “interne” par rayonnement b-.
Résultats
Dans les études rétrospectives et de cohortes, le taux de réponse était de 40 à 50 %, le temps à progression de 13 mois et la médiane de survie globale de 20 mois (26).
L’immunothérapie
L’association atézolizumab-bévacizumab
L’association atézolizumab-bévacizumab (immunothérapie anti-PD-L1 et anticorps monoclonal ciblant le VEGF) a obtenu une AMM en France en 2021 dans le traitement des patients adultes atteints d’un CHC avancé ou non résécable, n’ayant pas reçu de traitement systémique antérieur uniquement chez ceux avec une fonction hépatique préservée, un score ECOG 0 ou 1, et non éligibles aux traitements loco-régionaux ou en échec à l’un de ces traitements.
Du fait du risque plus élevé de rupture de varices œsophagiennes sous bévacizumab, un bilan endoscopique est donc justifié avant la mise en route de ce traitement et une prévention efficace de la rupture des varices doit être instaurée, dans l’idéal par bêta-bloquants.
L’association durvalumab-trémélimumab
L’association durvalumab-trémélimumab (anti-CTLA4 et anti-PD-L1) est désormais accessible et remboursée depuis septembre 2024 en traitement de première ligne chez des patients avec fonction hépatique préservée non éligibles aux traitements loco-régionaux ou en échec de ces traitements (12). Il s’agit de la première double immunothérapie validée et autorisée dans le CHC.
À ce jour, aucun biomarqueur d’efficacité des immunothérapies n’a été identifié chez les patients atteints de CHC. Le choix du traitement systémique de première ligne dépend du profil de tolérance supposé des patients avec CHC avancé (“vasculaire” pour le bévacizumab, “immunologique” pour la double immunothérapie).
Résultats
• Les résultats de l’étude de phase III IMbrave 150, comparant l’association de l’atézolizumab 1 200 mg toutes les 3 semaines et du bévacizumab 15 mg/kg toutes les 3 semaines au traitement par sorafénib, ont montré un bénéfice significatif en survie globale (19,2 versus 13,4 mois ;
HR = 0,66 ; p < 0,0009) (27).
• Les résultats de l’étude HIMALAYA, comparant en première ligne de traitement le sorafénib à une injection unique initiale de trémélimumab à la dose de 300 mg et des injections de durvalumab à la dose de 1 500 mg toutes les 4 semaines, ont montré un bénéfice significatif de la survie globale (16,4 versus 13,8 mois ; HR = 0,78 (0,65-0,92)) (28).
À noter qu’il n’existe à ce jour aucune indication d’immunothérapie adjuvante, néoadjuvante ou en association avec d’autres traitements “physiques” du CHC.
Tolérance
La tolérance de ces associations s’est améliorée comparativement aux anciens traitements de première ligne qui faisaient appel aux inhibiteurs de tyrosine kinase. Le pourcentage d’effets indésirables de grade 3-4 imputables au traitement est similaire aux inhibiteurs de tyrosine kinase. Néanmoins, l’excellente tolérance et le faible effet sur la qualité de vie des patients ont radicalement changé la prise en charge des patients avec CHC avancé (27).
Les inhibiteurs de tyrosine kinase
Les inhibiteurs de tyrosine kinase, initialement prescrits en première intention comme traitement systémique, ont été relégués en deuxième ligne depuis l’arrivée de l’immunothérapie (12).
Peuvent être cités, le sorafénib, le lenvatinib, le régorafénib, le cabozantinib.
Résultats
Aucune donnée d’essai clinique prospectif post-première ligne avec immunothérapie n’est disponible.
• En 2008, l’essai Sharp comparant le sorafénib à un placebo montrait une augmentation de la survie chez les patients traités, passant de 7,9 à de 10,7 mois sous traitement (29).
• Le lenvatinib a montré une équivalence au sorafénib en première ligne de traitement (30).
• Après progression sous sorafénib, le régorafénib et le cabozantinib peuvent être prescrits, avec une amélioration nette de la survie de l’ordre de 2 mois (31, 32).
Tolérance
La tolérance des inhibiteurs de tyrosine kinase est médiocre chez les patients cirrhotiques. L’asthénie, le syndrome main-pied et la diarrhée sont des motifs fréquents d’arrêt des traitements (29).
Nicolas Laures déclare ne pas avoir de liens d’intérêt. Pierre Nahon déclare en avoir avec AstraZeneca, BMS, EISAI, Ipsen, Roche.
Bibliographie
1. Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet 2018 ; 391 : 1301-14.
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2018 ; 69 : 182-236.
3. Bray F, Laversane M, Sung H et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2024 ; 74 : 229-63.
4. SPF. Incidence des principaux cancers en France métropolitaine en 2023 et tendances depuis 1990. 30 juin 2023. Disponible sur : www.santepubliquefrance.fr/import/incidence-des-principaux-cancers-en-france-metropolitaine-en-2023-et-tendances-depuis-1990.
5. Goutté N, Sogni P, Bendersky N et al. Geographical variations in incidence, management and survival of hepatocellular carcinoma in a Western country. J Hepatol 2017 ; 66 : 537-44.
6. Association française pour l’étude du foie. Recommandations pour le diagnostic et le suivi non invasif des maladies chroniques du foie. Juillet 2020. Disponible sur : afef.asso.fr/recommandation/recommandations-afef-sur-diagnostic-et-suivi-non-invasif-des-maladies-chroniques-du-foie/.
7. Nahon P, Layese R, Bourcier V et al. Incidence of Hepatocellular carcinoma after direct antiviral therapy for hcv in patients with cirrhosis included in surveillance programs. Gastroenterology 2018 ; 155 : 1436-50.e6.
8. Association française pour l’étude du foie. Recommandations AFEF pour l’élimination de l’infection par le virus de l’hépatite C en France. Mars 2018. Disponible sur : afef.asso.fr/recommandation/recommandations-afef-pour-lelimination-de-linfection-par-le-virus-de-lhepatite-c-en-france/.
9. EASL. Hepatitis B EASL Guidelines. Disponible sur : easl.eu/publication/easl-guidelines-management-of-hepatitis-b/.
10. Tourkochristou E, Kalafateli M, Triantos C, Aggeletopoulou I. Evaluation of PAGE-B Score for hepatocellular carcinoma development in chronic hepatitis b patients: reliability, validity, and responsiveness. Biomedicines 2024 ; 12 : 1260.
11. Calderaro J, Ziol M, Paradis V, Zucman-Rossi J. Molecular and histological correlations in liver cancer. J Hepatol 2019 ; 71 : 616-30.
12. Blanc JF, Debaillon-Vesque A, Roth G et al. Hepatocellular carcinoma: French Intergroup Clinical Practice Guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, AFEF, SIAD, SFR/FRI). Clin Res Hepatol Gastroenterol 2021 ; 45 : 101590.
13. Reig M, Forner A, Rimola J et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. J Hepatol 2022 ; 76 : 681-93.
14. Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999 ; 19 : 329-38.
15. Agence de la biomédecine. Le rapport annuel médical et scientifique du prélèvement de greffe en France. 2017. Disponible sur : www.agence-biomedecine.fr/annexes/bilan2017/donnees/organes/05-foie/synthese.htm#t1.
16. Duvoux C, Roudot-Thoraval F, Decaens T et al. Liver transplantation for hepatocellular carcinoma: a model including α-fetoprotein improves the performance of Milan criteria. Gastroenterology 2012 ; 143 : 986-94.e3 ; quiz e14-15.
17. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005 ; 42 : 1208-36.
18. Costentin C, Ganne-Carrié N, Rousseau B et al. Care pathway of patients with hepatocellular carcinoma in France: State of play in 2017. Bull Cancer 2017 ; 104 : 752-61.
19. Nault JC, Sutter O, Nahon P et al. Percutaneous treatment of hepatocellular carcinoma: State of the art and innovations. J Hepatol 2018 ; 68 : 783-97.
20. N’Kontchou G, Mahamoudi A et al. Radiofrequency ablation of hepatocellular carcinoma: long-term results and prognostic factors in 235 Western patients with cirrhosis. Hepatolology 2009 ; 50 : 1475-83.
21. Hocquelet A, Aubé C, Rode A et al. Comparison of no-touch multi-bipolar vs. monopolar radiofrequency ablation for small HCC. J Hepatol 2017 ; 66 : 67-74.
22. Wicks JS, Dale BS, Ruffolo L et al. Comparable and complimentary modalities for treatment of small-sized HCC: Surgical resection, radiofrequency ablation, and microwave ablation. J Clin Med 2023 ; 12 : 5006.
23. Sutter O, Calvo J, N’Kontchou G et al. Safety and efficacy of irreversible electroporation for the treatment of hepatocellular carcinoma not amenable to thermal ablation techniques: a retrospective single-center case series. Radiology 2017 ; 284 : 877-86.
24. Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 2003 ; 37 : 429-42.
25. Edeline J, Crouzet L, Campillo-Gimenez B et al. Selective internal radiation therapy compared with sorafenib for hepatocellular carcinoma with portal vein thrombosis. Eur J Nucl Med Mol Imaging 2016 ; 43 : 635-43.
26. Salem R, Gordon AC, Mouli S et al. Y90 radioembolization significantly prolongs time to progression compared with chemoembolization in patients with hepatocellular carcinoma. Gastroenterology 2016 ; 151 : 1155-63.e2.
27. Cheng AL, Qin S, Ikeda M et al. Updated efficacy and safety data from IMbrave150: Atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 2022 ; 76 : 862-73.
28. Abou-Alfa GK, Lau G, Kudo M et al. Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evid 2022 ; 1 : EVIDoa2100070.
29. Llovet JM, Ricci S, Mazzaferro V et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008 ; 359 : 378-90.
30. Kudo M, Finn RS, Qin S et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet 2018 ; 391 : 1163-73.
31. Bruix J, Qin S, Merle P et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017 ; 389 : 56-66.
32. Abou-Alfa GK, Meyer T, Cheng AL et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma. N Engl J Med 2018 ; 379 : 54-63.