Une réflexion sur la séquence thérapeutique des adénocarcinomes ALK réarrangés de stade avancé en 2024, en partant des premières grandes études avec les inhibiteurs de ALK jusqu’aux données disponibles concernant les mécanismes de résistance pouvant avoir une incidence sur les choix de lignes successives et une ouverture sur les perspectives thérapeutiques dans les années à venir.
Résumé
Les adénocarcinomes bronchiques ALK réarrangés (ALK+) constituent une entité à part entière de cancer du poumon. Des années de recherche ont permis de mieux comprendre cette maladie et de développer des traitements ciblés, des inhibiteurs de tyrosine kinase (ITK) pour bloquer spécifiquement la protéine chimérique secondaire à ce réarrangement de gène et responsable de l’addiction oncogénique. Trois générations successives d’ITK ont permis d’atteindre des survies globales jamais observées dans le cancer du poumon. Plusieurs molécules performantes sont arrivées de manière rapprochée sur le marché sans comparaison directe. Nous allons discuter des données scientifiques entrant dans la balance pour le choix de la première ligne parmi les thérapies disponibles aujourd’hui : l’alectinib, le brigatinib et le lorlatinib. Nous détaillerons ensuite la stratégie à progression en fonction des traitements déjà reçus.
Abstract
Therapeutic sequence for ALK+ NSCLC
ALK+ lung adenocarcinoma is a specific subtype of lung cancer. Years of research have led to a better understanding of this disease and the development of targeted therapies, . Tyrosine kinase inhibitors (TKIs) specifically block the chimeric protein secondary to this gene rearrangement responsible for oncogenic addiction. Successive generations of TKIs have made it possible to achieve impressive overall survival in lung cancer. Several potent molecules have arrived on the market with no direct comparison. We will discuss the scientific data involved in the choice of first-line treatment from among the therapies available today: alectinib, brigatinib and lorlatinib. Then, we detail the strategy to be followed, based on the treatments already received.
Introduction
Le gène ALK
Le gène ALK (Anaplasic Lymphoma Kinase) est situé sur le bras court du chromosome 2, il s’agit d’un récepteur transmembranaire à activité tyrosine kinase. À l’état normal, la fixation d’un ligand au niveau extra-membranaire va permettre la dimérisation de ce récepteur, il y a alors une phosphorylation des domaines tyrosine kinase intracytoplasmiques, ce qui va déclencher des voies de signalisation en aval impliquées dans la survie, la prolifération et la différenciation cellulaire.
Le réarrangement de ALK
Dans certains cas de cancer du poumon, un réarrangement situé sur le chromosome 2 est retrouvé, il s’agit d’une inversion-fusion impliquant le gène ALK et son partenaire de fusion majoritaire, EML4, également situé sur le bras court du chromosome 2 (d’autres partenaires existent tels que KIF5B) (1). Plusieurs variants sont décrits dans la littérature (pour EML4 variants 1, 2, 3a/b, 5a/b, 5’, 7’, et des variants non EML4) en fonction de la localisation du point de cassure.
Ce gène de fusion va produire une protéine chimérique, entraînant, en aval, une hyperactivation des voies de signalisation et donc la cancérogenèse.
Détection
La détection de cette mutation oncogénique peut être faite en immunohistochimie (IHC). Une surexpression en IHC à trois croix est bien corrélée à la présence de la protéine et suffit à donner accès à une thérapie ciblée anti-ALK. Dans les autres situations (1 et 2 croix), le résultat doit être confirmé par une seconde technique, soit une FISH (Fluorescent in situ Hybridation), soit un NGS (Next Generation Sequencing) qui a l’avantage de donner accès à d’autres informations telles que le partenaire de fusion, le variant en cas de fusion EML4-ALK, et les comutations (2).
Épidémiologie
Les réarrangements de ALK sont retrouvés chez environ 5 % des adénocarcinomes bronchiques, allant jusqu’à 14 % chez les non fumeurs (3). Il s’agit souvent de patients jeunes (âge médian 52-54 ans) (4, 5), souvent non ou faiblement tabagiques (2, 4).
Les CBNPC ALK+ ont une propension plus importante à développer des métastases cérébrales : environ 30 % au diagnostic, et cette incidence augmente avec l’évolution de la maladie, jusqu’à 53 % à 3 ans (6). Il s’agit du site le plus fréquent de progression de la maladie (5, 7, 8).
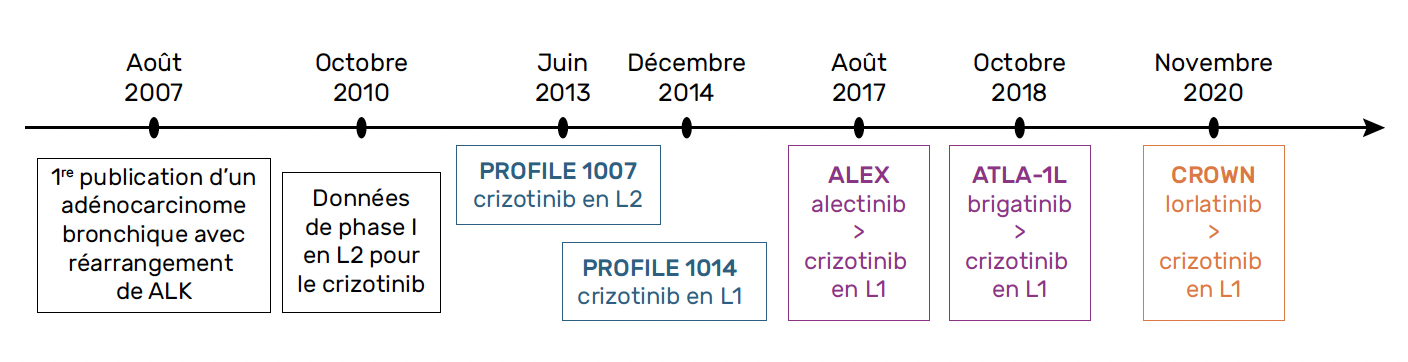
En 17 ans, entre la découverte du réarrangement ALK et aujourd’hui, les avancées thérapeutiques se sont succédé, multipliant les molécules à notre disposition (Fig. 1). Ces patients sont traités par de nombreuses lignes successives et présentent une survie globale des plus importantes parmi les CBNPC. Ainsi, il est légitime de se questionner sur la séquence thérapeutique optimale compte tenu des données disponibles en 2024. Après un rappel des options thérapeutiques validées actuellement en 1re ligne, nous aborderons les critères pouvant influencer notre choix : tolérance, mécanismes de résistance, et les autres pistes de recherche.
Figure 1 – Frise chronologique.
La première ligne repose actuellement sur un inhibiteur dit de “nouvelle” génération
Le standard de traitement : iALK de 2e et 3e générations
Le crizotinib
Le premier iALK à notre disposition a été le crizotinib, d’abord en 2e ligne versus monochimiothérapie (9), puis en 1re ligne (5) : comparé à une chimiothérapie reposant sur un sel de platine, le crizotinib améliorait significativement la médiane de survie sans progression (mSSP), objectif principal (10,9 versus 7,0 mois ; HR = 0,45 [0,35-0,60]), et la réponse tumorale avec, par ailleurs, un profil de tolérance nettement plus favorable et une amélioration de la qualité de vie. Dès lors, la recherche de la translocation ALK chez les CBNPC est devenue indispensable dès la 1re ligne. Malheureusement, l’efficacité du crizotinib restait limitée : une résistance secondaire survenait le plus souvent dans les 1 à 2 ans, avec comme principal site de rechute le cerveau, essentiellement du fait d’une biodisponibilité intra-cérébrale limitée.
La stratégie s’est alors organisée autour du développement de nouvelles thérapies ciblées, dites de 2e génération, caractérisées par une activité anti-ALK plus sélective, une toxicité moindre et un meilleur passage de la BHE expliquant une très bonne efficacité de ces iALK au niveau du système nerveux central (SNC).
Les iALK de nouvelle génération
Entre 2017 et 2020, quatre essais de phase III de 1re ligne ont été publiés avec un design selon un modèle dit ITK head to head, comparant directement un iALK de nouvelle génération au standard de traitement, le crizotinib, avec pour critère de jugement principal la mSSP.
L’ensartinib, à travers l’essai EXALT-3, n’étant pas commercialisé en Europe, nous ne rentrerons pas plus dans le détail de cet essai.
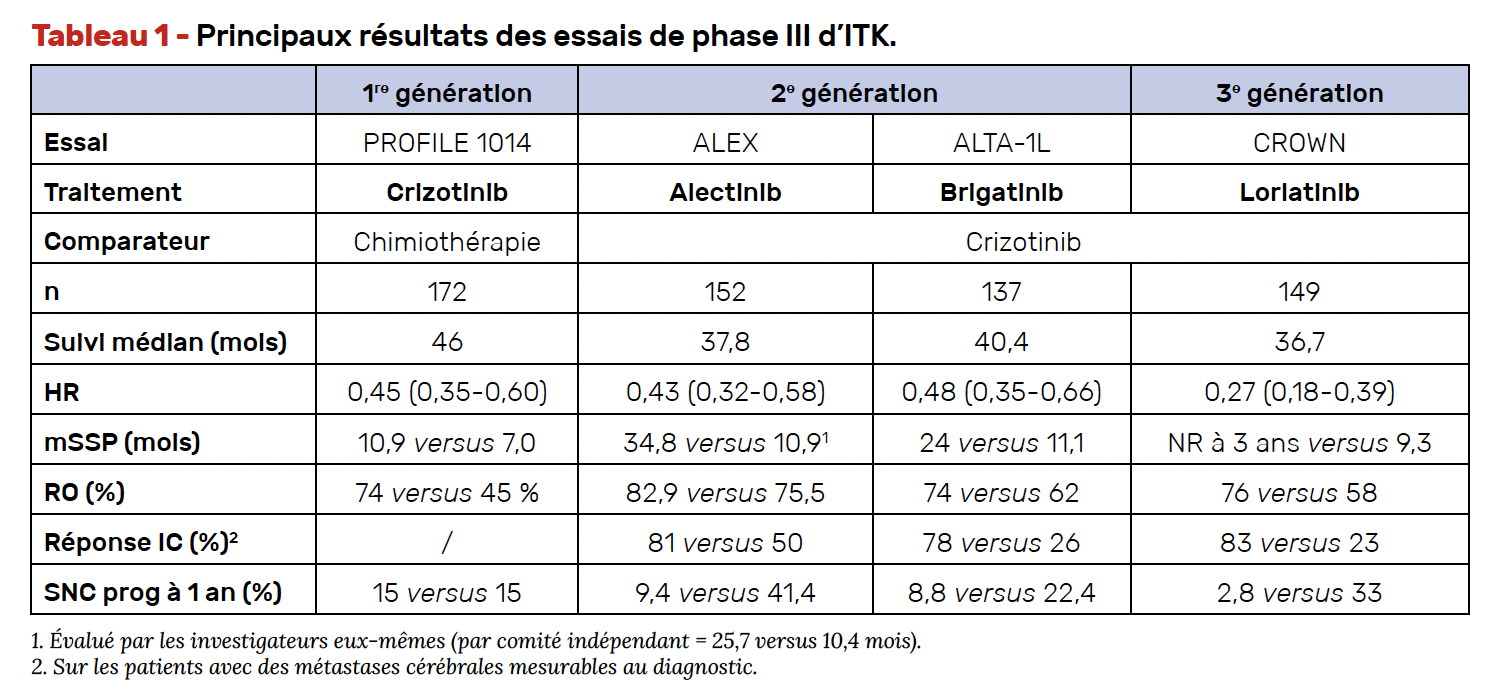
L’alectinib étudié dans l’essai ALEX (10) (J-ALEX et ALESIA dans une population asiatique), et le brigatinib dans l’essai ALTA-1L (7) sont deux molécules dites de 2e génération. Le lorlatinib étudié dans CROWN (8) est, quant à lui, un ITK de 3e génération développé spécifiquement pour passer la BHE avec un spectre d’action plus large sur les mutations de résistance et notamment la mutation de ALK G1202R (Tab. 1).
Design des études
Quelques différences notables dans le design de ces études, susceptibles d’avoir une incidence sur les résultats, sont à signaler :
• ALTA-1L, contrairement à ALEX et CROWN, permettait d’inclure des patients qui avaient reçu précédemment une 1re ligne de traitement systémique hors iALK (26 % dans le bras brigatinib, et 27 % dans le bras crizotinib). Un cross-over per protocole du bras crizotinib vers le bras brigatinib était possible (il a été de 47 %), ce qui n’était pas le cas dans ALEX et CROWN ;
• l’évaluation du critère de jugement principal (la mSSP) était réalisée en aveugle par un comité de revue indépendant dans ALTA-1L et CROWN alors qu’elle était réalisée par les investigateurs dans ALEX ;
• ces trois études permettaient d’inclure des patients avec métastases cérébrales ou leptoméningées asymptomatiques. Une radiothérapie cérébrale préalable était autorisée si terminée depuis plus de 14 jours avant l’inclusion. Les trois essais exigeaient une évaluation cérébrale obligatoire à l’inclusion, mais seul l’essai CROWN imposait une IRM. Également la définition d’une métastase cérébrale mesurable était abaissée à 5 mm contre 10 mm pour les deux autres essais. Le rythme de réalisation des imageries cérébrales était de 8 semaines, sauf dans ALTA-1L où, à partir de 14 cycles de 28 j, la réévaluation était réalisée toutes les 12 semaines.
Populations des études
Les populations des trois essais étaient assez similaires sur le plan démographique (âge médian, sexe ratio, statut tabagique, ethnie). On notait une proportion de patients avec métastases cérébrales au diagnostic plus importante dans ALEX (38 %) versus ALTA-1L (29 %) et CROWN (28 %).
Principaux résultats
• Ces trois études ont démontré la supériorité des iALK de nouvelle génération sur le crizotinib en termes de mSSP, taux de réponse, durée de réponse et de traitement (Tab. 1) sans s’accompagner pour autant d’une dégradation de la tolérance.
• L’efficacité intra-cérébrale de ces molécules est à souligner, tant sur le taux de réponse que sur leur capacité à retarder la progression à cet étage. Le taux de réponse intra-cérébrale chez les patients avec métastases cérébrales mesurables au diagnostic était de 81 % avec l’alectinib, 78 % avec le brigatinib, 82 % avec le lorlatinib. Le taux de réponse complète pour l’ensemble des métastases cérébrales mesurables et non mesurables était respectivement de 45, 45 et 61 %. Le taux de progressions cérébrales à 1 an était de 9,4 % avec l’alectinib, 8,8 % avec le brigatinib. Pour le lorlatinib, l’incidence cumulative de progressions cérébrales à 1 an était de 7,4 % pour les patients porteurs de métastases cérébrales à l’initiation et 1 % pour les patients initialement indemnes de métastases cérébrales.
L’effet protecteur cérébral est particulièrement important pour le lorlatinib. En effet, après un suivi médian de 36,7 mois, seul un patient (1 %) parmi les 112 in-demnes de métastases au diagnostic a présenté une progression cérébrale contre 25 % dans le bras crizotinib (HR = 0,02).
L’impact sur la survie globale
Cross-over
Le bénéfice des iALK de nouvelle génération sur le crizotinib en termes de survie globale (SG) n’est pas démontré pour toutes les molécules, mais cette interprétation doit tenir compte des pourcentages de cross-over dans chaque étude et de la maturité des résultats au moment de l’analyse.
Dans les trois études, la proportion de cross-over effective (per ou hors protocole) était importante :
• ALTA1 : le cross-over per protocole était permis, 47 % des patients sous crizotinib en ont bénéficié (mais 82 %, si on inclut les patients ayant eu un iALK en dehors de l’étude) ;
• ALEX : 53,5 % de patients progressant sous crizotinib ont bénéficié d’un iALK de 2e ou 3e génération hors protocole (céritinib (21,1 %), alectinib (21,1 %), brigatinib (9,6 %) et lorlatinib (8,8 %)) ;
• CROWN : le cross-over per protocole était interdit, mais 93 % des patients du groupe crizotinib ont eu un autre iALK en 2e ligne (68 % d’alectinib, 21 % de brigatinib, et seulement 3 % de lorlatinib).
L’étude ALEX
Dans l’étude ALEX, après une durée médiane du suivi de 48,2 mois pour l’alectinib et 23,3 mois pour le crizotinib, les données sur la SG demeuraient immatures (37 % des événements).
La médiane de la SG n’a pas été atteinte avec l’alectinib contre 57,4 mois avec le crizotinib (HR stratifié = 0,67 ; IC 95 % = 0,46-0,98), mais un bénéfice sur la SG est ainsi constaté à 5 ans.
Le taux de SG à 5 ans était de 62,5 % (IC 95 % = 54,3-70,8) avec l’alectinib et de 45,5 % (IC 95 % = 33,6-57,4) avec le crizotinib. Ce bénéfice en survie globale a été observé chez les patients présentant des métastases du système nerveux central au départ (HR = 0,58 ; IC 95 % = 0,34-1,00) et chez ceux qui n’en présentaient pas (HR = 0,76 ; IC 95 % = 0,45-1,26). Ce bénéfice en SG de l’alectinib est possiblement observé du fait de l’interdiction de cross-over durant l’étude et d’une proportion faible de patients sous alectinib après progression sous crizotinib.
Il est intéressant de relever que dans l’étude J-ALEX, chez des patients japonais, il n’est pas retrouvé de bénéfice en SG alors que 78,8 % des patients avaient bénéficié d’un cross-over du bras crizotinib vers le bras alectinib.
L’étude ALTA-1L
Dans l’étude ALTA-1L, après un suivi médian sous brigatinib de 40,4 mois, la médiane de SG n’a été atteinte dans aucun des deux groupes (HR = 0,81 ; IC 95 % = 0,53-1,22). Des analyses post hoc ont suggéré un bénéfice en termes de survie globale pour le brigatinib chez les patients présentant des métastases cérébrales à l’inclusion (HR = 0,43 ; IC 95 % = 0,21-0,89) (7). Avec des ajustements statistiques sur le cross-over, autorisés en per protocole et donc à analyser avec précaution, un bénéfice de SG se dégageait pour le brigatinib avec un HR à 0,54 (IC 95 % = 0,31-0,92 ; MSM méthode) et 0,50 (IC 95 % = 0,28-0,87 ; p ¼ 0,014 ; IPCW cox modèle) (7).
L’étude CROWN
Enfin, les données de SG ne sont pas matures dans l’essai CROWN.
Quel ITK choisir en 1re ligne ? Existe-t-il des critères aidant ce choix ?
Il est actuellement possible d’utiliser en 1re ligne alectinib, brigatinib ou lorlatinib. Le choix entre ces molécules ne peut se faire sur des données comparatives directes faute d’essai à disposition. La comparaison en parallèle des données des essais de phase III versus crizotinib de ces trois iALK peut aider, mais reste d’intérêt limité sur un plan statistique et ne permet pas pour autant de tirer des conclusions fermes et définitives. Il faut garder à l’esprit que le projet thérapeutique est celui de la SG et de la qualité de vie pour ces patients ALK réarrangé qui peuvent avoir une survie très prolongée.
Le choix du traitement est très probablement fondé sur un faisceau d’arguments, incluant les données d’efficacité globale et intra-cérébrale qui ont été détaillées précédemment, mais aussi les toxicités potentielles et le profil du patient avec ses antécédents, afin de privilégier la meilleure qualité de vie possible. Enfin, les mécanismes de résistance décrits jusqu’à présent avec chaque molécule peuvent-ils nous aider à choisir ? Des pistes de recherche sont également en cours sur les caractéristiques biologiques moléculaires tels que les variants et les comutations.
Tolérance du traitement, qualité de vie du patient
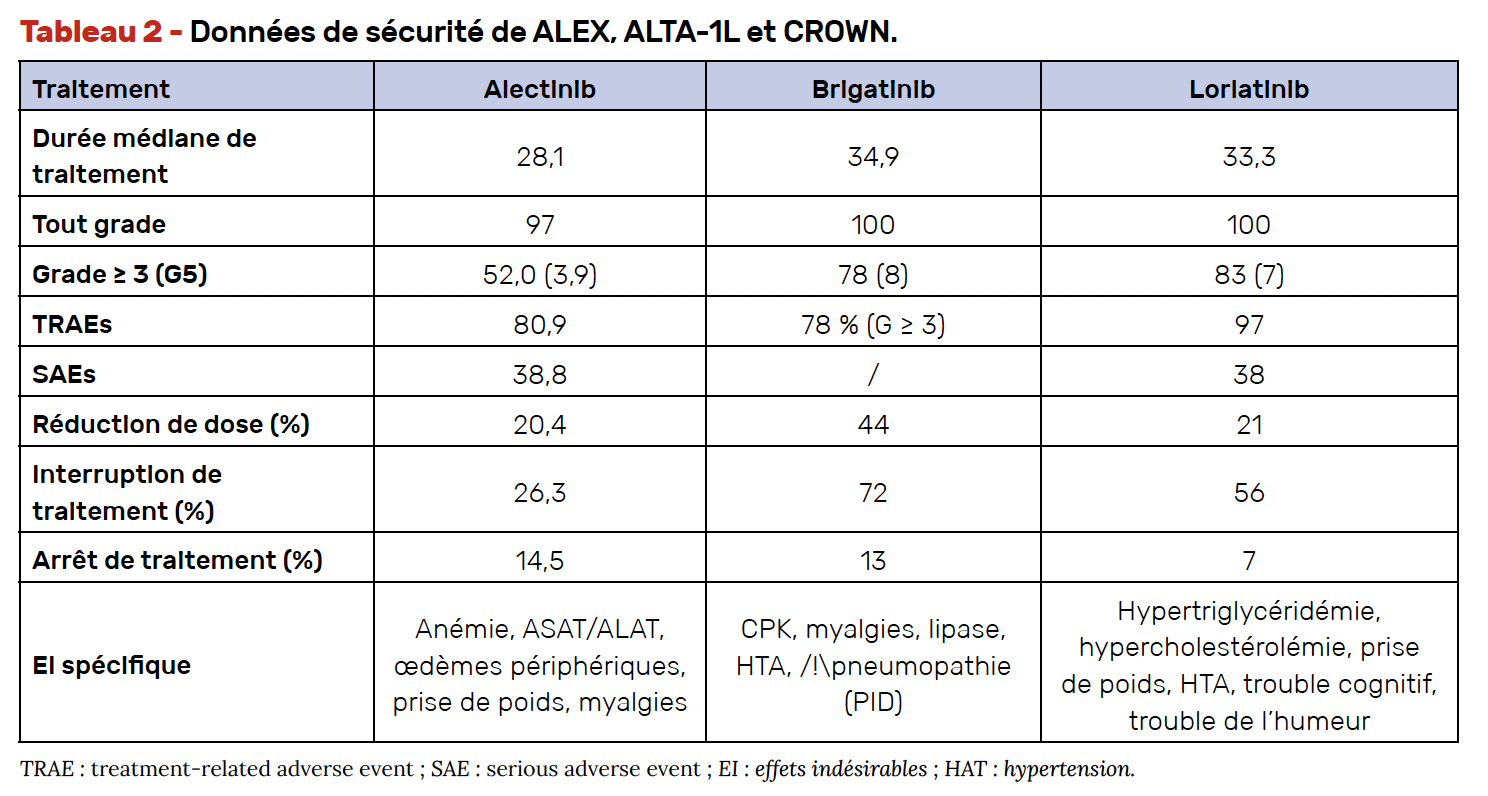
La tolérance du traitement, de surcroît lorsque celui-ci est long, est un élément déterminant. Il est nécessaire de bien connaître les profils de toxicité des différents iALK pour les identifier et les prendre en charge précocément (Tab. 2). Ceci permettrait de favoriser l’observance et d’obtenir la meilleure dose-intensité en limitant les réductions/interruptions et arrêts de traitement.
De façon commune, ces traitements peuvent présenter une toxicité digestive à type de diarrhées, nausées et vomissements. Parallèlement, ils possèdent aussi des toxicités propres. Les iALK de seconde génération sont globalement bien tolérés.
Alectinib
Les effets secondaires de l’alectinib sont essentiellement d’ordre biologique : augmentation de la bilirubinémie, des CPK et des transaminases. Les myalgies (sans grade 3) et l’anémie (5 % grade 3), la prise de poids (10 % tout grade) et le risque (faible) de pneumopathie interstitielle sont des points d’attention.
Brigatinib
Le brigatinib entraîne une élévation des CPK (39 %) et de la lipase (19 %) ainsi que des myalgies (6 %). La toxicité la plus redoutée est le risque de pneumonie interstitielle rapportée dans 3 % des cas durant la première semaine dans l’étude ALTA-1. Afin de limiter la gravité de cet effet indésirable, il est recommandé de prescrire le traitement à demi-dose (90 mg) pendant 1 semaine et d’augmenter ensuite à pleine dose (180 mg).
Lorlatinib
Les effets secondaires du lorlatinib sont différents de ceux habituellement rencontrés avec les autres ITK ; il est nécessaire de les identifier et de les prendre en charge de manière adaptée et rapide. L’hypertriglycéridémie et l’hypercholestérolémie incitent à la prescription de statines et fibrates. Les œdèmes et la prise de poids (respectivement 55 %, dont 3 % de grade 3 et 38 %, dont 17 % de grade 3) sont également fréquents.
Enfin, le lorlatinib présente surtout une toxicité neurologique centrale (39 % tout grade dans CROWN) et périphérique qui peut constituer un frein à son utilisation. Ont été rapportés des troubles cognitifs (tout grade 26 %), de l’humeur (17 %), de la parole ou du langage (5 %), des psychoses hallucinatoires (5 %), ainsi que des neuropathies périphériques (34 %). En cas d’antécédents psychiatriques, il est préférable de privilégier en 1re ligne un autre ITK. En cas d’apparition de symptômes psychiatriques sous lorlatinib, il faut confier le patient à un confrère psychiatre pour un suivi régulier et éventuellement adapter le traitement psychotrope dont la concentration peut être modifiée par le lorlatinib (inducteur de cytochrome 3A4).
Les options thérapeutiques après iALK de G2 et G3, effet du choix en 1re ligne et des mécanismes de résistance dans la séquence de traitement
Quel que soit l’iALK choisi en 1re ligne, la progression est quasi inéluctable.
Comment rechercher et que rechercher ?
On distingue :
• les mécanismes de résistance on-target touchant le récepteur ALK
• et les mécanismes off-target incluant des voies by-pass et des transformations histologiques.
L’existence ou non de mécanismes de résistance ciblables après cette 1re ligne de traitement peut être un élément décisionnel. Il serait logique de penser que la prescription séquentielle d’un traitement ciblant le mécanisme de résistance mis en évidence va permettre un effet sur la SG en s’adaptant étape par étape à l’évolution clonale de la maladie. Il est désormais connu que l’hétérogénéité clonale de la maladie augmente avec la pression thérapeutique au cours du temps et l’exposition successive à plusieurs ITKs.
Il est recommandé en cas de progression de la maladie de refaire des biopsies tissulaires et/ou un génotypage de l’ADN tumoral circulant afin de rechercher ces mécanismes de résistance ciblables par une nouvelle thérapie.
La biopsie tissulaire
La biopsie tissulaire reste la référence et, outre les mutations de résistance liées à la voie ALK et les mécanismes by-pass, cette biopsie tissulaire permet aussi de mettre en évidence les transformations histologiques. Elle reste plus invasive, et ne sera le reflet que du site tumoral biopsié. Cependant, elle ne permet de retrouver un mécanisme de résistance que dans une minorité des cas.
La biopsie liquide
La biopsie liquide avec analyse de l’ADN tumoral circulant est rapide et peu invasive. En revanche, cette méthode est moins sensible en cas de maladie faiblement métastatique et ne permet pas de mettre en évidence les transformations histologiques. Il s’agit d’une technique qui tend de plus en plus à se populariser et qui permettra vraisemblablement avec l’amélioration des techniques biologiques de retrouver des mécanismes de résistance de façon plus rapide et moins invasive.
Pourtant, aujourd’hui, en pratique courante, dans la majorité des cas, la décision de la 2e ligne se fait sans qu’aucun mécanisme de résistance ne soit mis en évidence, malgré les efforts déployés pour les rechercher.
La recherche des mécanismes de résistance permet d’adapter le traitement à progression si un mécanisme spécifique “ciblable” est mis en évidence.
Si vous démarrez par un iALK de 2e génération
Commencer par un iALK de G2 permet de garder en cas de progression diffuse l’option du lorlatinib en 2e ligne et ainsi de repousser le moment de l’utilisation de la chimiothérapie.
Mutation secondaire sur le domaine tyrosine kinase
Le mécanisme de résistance prédominant après ces iALK semble être l’acquisition d’une mutation secondaire sur le domaine codant pour le site tyrosine kinase (11), en sachant que ces constatations sont fondées sur des données issues d’études où les iALK de G2 étaient utilisés en énième ligne. Ces mutations secondaires sont plus fréquentes après iALK de G2 qu’après crizotinib. La mutation la plus fréquente après iALK de G2 serait la G1202R, mutation de sensibilité au lorlatinib (11).
Le lorlatinib a été évalué en phase II au sein de plusieurs cohortes de patients déterminées en fonction des traitements reçus avant lorlatinib. Pour les patients traités seulement par iALK de G2 ± chimiothérapie (n = 28), le taux de réponse du lorlatinib était de 42,9 % avec une durée médiane de réponse de 6,2 mois. Le taux de réponse intra-cérébrale (n = 8/29) était de 66 % avec une médiane de durée de réponse intra-cérébrale de 20,7 mois. Le lorlatinib, avec son excellente biodisponibilité cérébrale, peut alors permettre de récupérer une activité anti-tumorale sur le SNC. Il faut souligner que ces données ont été obtenues indépendamment de la mise en évidence d’un mécanisme de résistance. Cependant, en cas de mutation de résistance identifiée, ce qui représente un quart de ces patients, les taux de réponse au lorlatinib sont alors d’environ 65 % (versus 27 % pour les patients sans mutation retrouvée) (12).
Ainsi, après un iALK de G2 en 1re ligne, les recommandations sont en faveur de l’utilisation du lorlatinib en 2e ligne, même en l’absence de mutation G1202R. Un autre iALK peut être utilisé si le profil moléculaire de résistance retrouvé confère une sensibilité à cet iALK, ceci, sur la base d’études précliniques qui ont mis en évidence une sensibilité de certaines mutations de résistance à certains iALK. Par exemple, après l’alectinib, le céritinib ou le brigatinib peuvent avoir une activité en cas de mutation de résistance I1171N (11).
Amplification de MET
Parmi les mécanismes de by-pass, l’amplification de MET est un mécanisme connu et retrouvé jusqu’à 15 % des patients évoluant sous iALK de nouvelle génération (13). Ce mécanisme de résistance permet parfois d’envisager l’ajout d’une molécule anti-MET, d’envisager un switch vers le crizotinib qui possède également une activité anti-MET ou des associations alectinib/brigatinib-crizotinib ou lorlatinib-crizotinib.
Autres mécanismes de résistance
• Dans un cas un peu similaire, il a été rapporté l’apparition de résistance par réarrangement de RET post-brigatinib (14)
• Il a également été identifié une réactivation de la voie RAS-MAPK (en aval du blocage réalisé sur le récepteur par l’iALK) par divers moyens tels que des fusions de BRAF, des mutations de KRAS, NRAS, MAP (14).
Ainsi, des stratégies de combinaisons de thérapies ciblées sont des possibilités thérapeutiques régulièrement discutées lors de RCP moléculaires pour essayer de contrer le mécanisme de résistance.
Si vous démarrez par un iALK de 3e génération
Les résultats de CROWN font logiquement du lorlatinib un candidat de choix à la 1re ligne, même si, on le rappelle, la comparaison des essais entre eux doit rester prudente. Le gain essentiel avec lorlatinib en 1re ligne est dans le contrôle de la maladie cérébrale, en cas de métastase au diagnostic, mais aussi dans la protection cérébrale en l’absence d’atteinte initiale du SNC.
Mécanisme de by-pass
Les modalités de progression après lorlatinib ne sont pas bien connues pour le moment. En termes de mécanismes de résistance, Felipe et al. ont rapporté des données au sujet de 26 patients en progression dans le bras lorlatinib et pour lesquels il existait une rebiopsie à progression (15). Il n’est retrouvé aucune mutation de résistance, en revanche 35 % des patients présentaient un mécanisme de by-pass. Sous réserve de plus amples données, il semblerait que la progression post-lorlatinib de 1re ligne soit donc majoritairement ALK-indépendante. La stratégie de revenir vers un TKI de génération “inférieure” ne semble pas être pertinente sur le papier, mais, dans CROWN, les données de traitements post-lorlatinib incluant majoritairement d’autres ITK retrouvent curieusement une efficacité assez importante.
Place de la chimiothérapie
La chimiothérapie conventionnelle garde toute sa place en l’absence de mécanisme d’échappement ciblable, ou après épuisement des lignes d’iALK, souvent en 2e ou 3e ligne après usage du lorlatinib. Cependant, les données d’efficacité d’une chimiothérapie à base de platine et pémétrexed restent limitées après échec d’un iALK de G2 avec des taux de réponse d’environ 29 % et une mSSP de 4,3 mois (16).
Place de l’immunothérapie
L’immunothérapie en association à la chimiothérapie ou en monothérapie, quant à elle, n’apporte pas de résultats très intéressants. Dans l’étude IMMUNOTARGET, il n’y avait aucune réponse au traitement dans la population ALK sous mono-immunothérapie (17).
Cas particuliers de progression : la transformation histologique et l’oligoprogression
La transformation histologique
Une transformation histologique en carcinome bronchique à petites cellules (CBPC) ou en carcinome épidermoïde est un mécanisme de résistance plus rare. Une transformation en CBPC concerne 1,2 % des patients dans une étude évaluant 168 patients à progression sous iALK nouvelle génération (14).
La transformation épithélio-mésenchymateuse
La transformation épithélio-mésenchymateuse est un autre mécanisme identifié, conférant alors un pouvoir migratoire très important et une capacité d’invasion accrue expliqués par une perte des jonctions intercellulaires et de la polarité cellulaire. Des EMT transcriptional regulators ont été identifiés comme de possibles thérapies ciblées (14).
L’oligoprogression
En cas d’oligoprogression, les recommandations plaident pour des traitements locaux, notamment de la radiothérapie stéréotaxique avec poursuite de la thérapie ciblée. Des réponses parfois prolongées peuvent être observées avec ces stratégies locales. Aucune étude randomisée n’a comparé cette stratégie versus changement de TKI chez les CBNPC ALK réarrangé, mais cela repose sur du “bon sens clinique” d’une part et, d’autre part, sur la notion d’hétérogénéité clonale des CBNPC avec anomalie ciblable, qui peut expliquer ces progressions isolées. Par ailleurs, cette attitude est calquée sur celle des CBNPC EGFR mutés chez qui il existe un niveau de preuve plus étayé.
Pour l’avenir ?
Les variants de fusion ELM4-ALK
Plus de 15 variants de fusion de ELM4-ALK ont été identifiés. Des analyses de sous-groupes viennent suggérer des réponses différentes aux traitements en fonction du type de variant de fusion, le variant 3 de la fusion EML4-ALK est de moins bon pronostic, et entraîne un risque plus important de développer une mutation G1202R. Par ailleurs, une co-altération de TP53 est retrouvée dans plus de 40 % des cas (18) et semble avoir un effet négatif sur la réponse aux iALK (7).
Pour exemple, dans CROWN, la réponse au lorlatinib et au crizotinib est sensiblement la même en cas de présence du variant 3 (v3 ; 72,2 versus 73,9 % respectivement) alors qu’elle est nettement meilleure en cas de variant 1 (v1 ; 80,0 versus 50,0 %) ou de variant 2 (v2 ; 85,7 versus 50,0 %) (18). Cependant, ces données sont à interpréter avec précaution, car tirées d’analyses de sous-groupes sans valeur statistique. La présence de la co-mutation TP53 semble avoir un effet négatif sur la durée de réponse, la SSP et même la SG dans une récente publication de Nakazawa et al. (19).
En 2024, ces éléments relèvent surtout du domaine de la recherche. Néanmoins, si nous disposons de l’information d’un variant 3 qui est à risque important de développement d’une mutation G1202R sous ITK de G2, cela pourrait constituer un argument en faveur du lorlatinib en 1re ligne.
Une quatrième génération d’iALK
Par ailleurs, une quatrième génération d’iALK (TPX 0131, Nuvalent 655) est déjà en phase avancée de développement. Ces molécules présentent l’avantage d’être actives sur les mutations complexes, notamment les doubles mutations du gène ALK qui surviennent essentiellement après l’utilisation séquentielle des iALK. Ils ont également la particularité d’avoir une bonne diffusion cérébrale sans effets secondaires limitants, et constitueraient à l’avenir une option thérapeutique de plus dans notre arsenal.
Thomas Favé déclare ne pas avoir de liens d’intérêt. Chantal Decroisette déclare des liens (boards et congrès) avec MDS, BMS, AstraZeneca, Takeda, Pfizer, Novartis, Sanofi, Amgen, Janssen-Cilag, Roche. Renaud Descourt avec AstraZeneca, Roche, Janssen-Cilag, Lilly, Novartis, Takeda, Pfizer, BMS (boards et congrès).
Bibliographie
1. Soda M, Choi YL, Enomoto M et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007 ; 448 : 561‑6.
2. Blackhall FH, Peters S, Bubendorf L et al. Prevalence and clinical outcomes for patients with ALK-positive resected stage I to III adenocarcinoma: results from the European Thoracic Oncology Platform Lungscape Project. J Clin Oncol 2014 ; 32 : 2780‑7.
3. Barlesi F, Mazieres J, Merlio JP et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016 ; 387 : 1415-26.
4. Shaw AT, Yeap BY, Mino-Kenudson M et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009 ; 27 : 4247‑53.
5. Solomon BJ, Mok T, Kim DW et al. PROFILE 1014: first-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014 ; 371 : 2167‑77.
6. Chowdhury MT, Santayana MGP de, Schmid S et al. 1356P Cumulative incidence and baseline imaging patterns of brain metastases in advanced EGFR and ALK positive non-small cell lung cancer (NSCLC). Ann Oncol 2021 ; 32 : S1028‑9.
7. Camidge DR, Kim HR, Ahn MJ et al. ALTA 1L final results: brigatinib versus crizotinib in ALK inhibitor-naive advanced ALK-positive NSCLC. J Thorac Oncol 2021 ; 16 : 2091‑108.
8. Shaw AT, Bauer TM, de Marinis F et al. CROWN: first-line lorlatinib or crizotinib in advanced ALK-positive lung cancer. N Engl J Med 2020 ; 383 : 2018‑29.
9. Shaw AT, Kim DW, Nakagawa K et al. PROFILE 1007: en 2L crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013 ; 368 : 2385‑94.
10. Peters S, Camidge DR, Shaw AT et al. ALEX: alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017 ; 377 : 829‑38.
11. Gainor JF, Dardaei L, Yoda S et al. Molecular mechanisms of resistance to first- and second-generation ALK inhibitors in ALK-rearranged lung cancer. Cancer Discov 2016 ; 6 : 1118‑33.
12. Shaw AT, Solomon BJ, Besse B et al. ALK resistance mutations and efficacy of lorlatinib in advanced anaplastic lymphoma kinase-positive non-small-cell lung cancer. J Clin Oncol 2019 ; 37 : 1370‑9.
13. Dagogo-Jack I, Yoda S, Lennerz JK et al. MET alterations are a recurring and actionable resistance mechanism in ALK-positive lung cancer. Clin Cancer Res 2020 ; 26 : 2535‑45.
14. Cooper AJ, Sequist LV, Lin JJ. Third-generation EGFR and ALK inhibitors: mechanisms of resistance and management. Nat Rev Clin Oncol 2022 ; 19 : 499‑514.
15. Felip E, Martini JF, Mazieres J et al. 1008P Resistance mechanisms to lorlatinib or crizotinib in treatment-naive patients (pts) with ALK+ advanced non-small cell lung cancer (NSCLC). Ann Oncol 2022 ; 33 : S1014.
16. Lin JJ, Schoenfeld AJ, Zhu VW et al. Efficacy of platinum/pemetrexed combination chemotherapy in ALK-positive NSCLC refractory to second-generation ALK inhibitors. J Thorac Oncol 2020 ; 15 : 258‑65.
17. Mazieres J, Drilon A, Lusque A et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol 2019 ; 30 : 1321‑8.
18. Bearz A, Martini JF, Jassem J et al. Efficacy of lorlatinib in treatment-naive patients with ALK-positive advanced NSCLC in relation to EML4::ALK variant type and ALK with or without TP53 mutations. J Thorac Oncol 2023 ; 18 : 1581‑93.
19. Nakazawa M, Harada G, Ghanem P et al. Impact of tumor-intrinsic molecular features on survival and acquired tyrosine kinase inhibitor resistance in ALK-positive NSCLC. Cancer Res Commun 2024 ; Online ahead of print.
20. Chazan G, Solomon BJ. Optimal first-line treatment for metastatic ALK+ non-small cell lung cancer-a narrative review. Transl Lung Cancer Res 2023 ; 12 : 369‑78.