L’intelligence artificielle (IA) est déjà utilisée en routine pour le contourage et la dosimétrie. Il persiste des enjeux de sécurité et de mise en place de ces outils. Le support décisionnel constitue la nouvelle frontière de l’IA en oncologie radiothérapie.
Résumé
La radiothérapie a radicalement changé avec l’avènement de la tomodensitométrie et de la modulation d’intensité. Cette complexité accrue a permis un traitement plus précis et reproductible. Ces progrès nécessitent une délinéation précise de nombreux volumes, soulevant des questions sur la manière de les délinéer de façon homogène entre les centres. L’intelligence artificielle (IA) offre la possibilité de rendre ce flux de travail plus efficace tout en augmentant l’homogénéité de la pratique. De nombreux outils utilisant l’IA sont mis en œuvre dans la pratique courante pour réduire la charge de travail et améliorer l’homogénéité des traitements. Les données de traitement pourraient être associées à des données cliniques et à des données omiques pour développer des outils prédictifs destinés à soutenir la prise de décision clinique. De tels outils prédictifs en sont au stade de la preuve de concept et doivent être explicables et validés de manière prospective sur de grandes cohortes multicentriques. Ils ouvrent néanmoins une nouvelle voie vers une personnalisation des stratégies oncologiques, des prescriptions de doses pour les volumes cibles et des contraintes de doses pour les organes à risque.
Abstract
Applications of artificial intelligence in radiotherapy
Radiotherapy has radically evolved with the advent of computed tomography and intensity modulation. This increased workflow complexity has allowed for more precise and reproducible treatments. As a result, such advancements have necessitated precise delineation of many additional volumes, raising questions about how to define them consistently across centers. Next, inverse planning became possible thanks to improved computing power, enabling the generation of a three-dimensional dose distribution. Artificial intelligence offers the potential to make this workflow more efficient while increasing practice consistency. Many AI-powered tools are being implemented in routine practice to enhance efficiency, reduce workload, and improve treatment uniformity. Data extracted from this workflow could be combined with clinical and omics data to develop predictive tools designed to support clinical decision-making. Such predictive tools are at the proof-of-concept stage and must be explainable and validated prospectively across large multicenter cohorts. Nevertheless, they could bridge the gap towards personalized radiotherapy oncology, tailoring oncological strategies, dose prescriptions for tumor volumes, and dose constraints for organs at risk.
Introduction
Oncologie radiothérapie : des tâches complexes
En oncologie radiothérapie, la réalisation d’un traitement peut se décomposer en plusieurs tâches complexes.
• Tout d’abord, l’indication de radiothérapie est proposée lors de la réunion de concertation pluridisciplinaire (RCP) et l’oncologue radiothérapeute rencontre le patient pour évaluer cliniquement le bénéfice de la radiothérapie par rapport aux effets secondaires.
• Au départ, un scanner ou une IRM dosimétrique est effectué pour fournir une carte de densité sur laquelle la tumeur et l’organe à risque (OAR) peuvent être délimités (1). La délinéation nécessite parfois une imagerie par résonance magnétique (IRM) fusionnée afin de définir plus précisément les extensions tumorales ou les OAR.
• Ensuite, une planification dosimétrique peut être réalisée pour trouver le meilleur compromis entre la couverture tumorale à la dose prescrite et la préservation des OAR.
• Le traitement est alors administré au patient, le plus souvent avec plusieurs fractions de radiothérapie. Dans certaines situations, comme les cibles intra-abdominales, la radiothérapie adaptative (RTA) peut se révéler bénéfique (2). La RTA permet d’adapter la délivrance de la dose à chaque fraction, pour suivre les changements anatomiques tels que les mouvements internes des organes. Cela implique une nouvelle délinéation et une dosimétrie à chaque fraction, ce qui mobilise un physicien et un médecin.
Intérêt de l’IA
Mettre en œuvre l’IA dans des tâches techniques telles que l’acquisition de scanners dosimétriques, la délinéation, la planification dosimétrique et la RTA peut permettre un flux de travail plus efficace et rendre la RTA moins chronophage et donc plus facilement disponible (2). D’un autre côté, l’IA pourrait fournir des outils prédictifs pour mieux évaluer le rapport bénéfice/risque des traitements. Cela permettrait une meilleure sélection des patients et une personnalisation accrue des stratégies oncologiques.
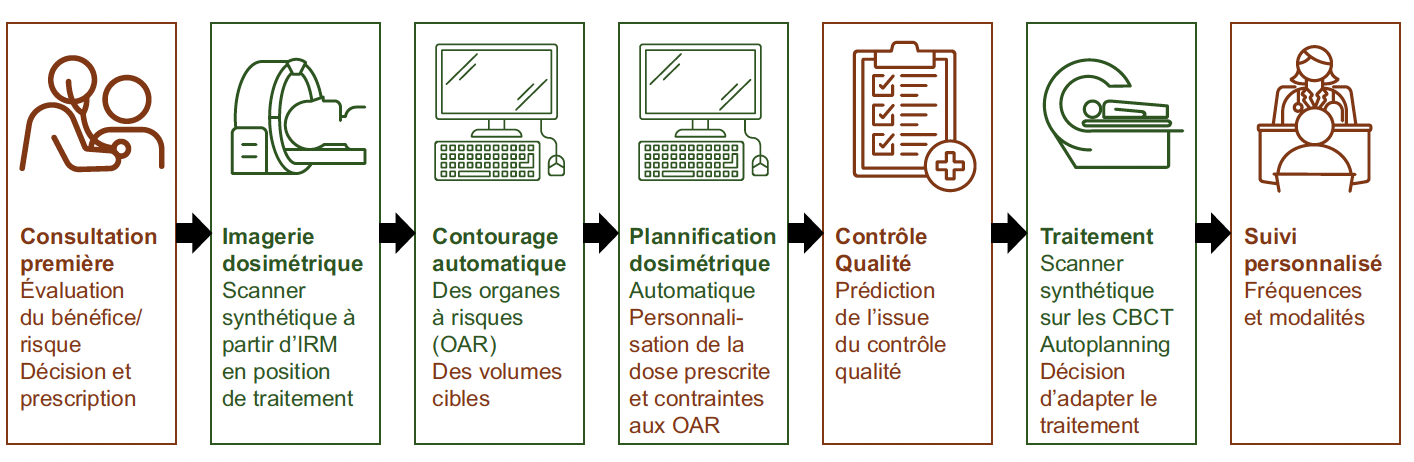
Les rôles de l’IA en oncologie radiothérapie peuvent être dichotomisés en deux objectifs principaux. Le premier objectif est d’améliorer l’efficacité, principalement par l’automatisation, tandis que le second est de fournir des outils prédictifs pour une meilleure personnalisation de la radiothérapie (Fig. 1).
Figure 1 – Rôles potentiels (en marron) et déjà disponibles (en vert) de l’IA en radiothérapie.
Améliorer le flux de travail
La délinéation automatique
Principe
Une fois le scanner de planification réalisé, les oncologues radiothérapeutes contourent les OAR et les volumes cibles. Un volume cible est le volume traité par radiothérapie. Les OAR sont des organes proches du volume cible qui sont susceptibles de recevoir une dose à risque de déclencher des effets secondaires. Le premier objectif du développement de la délinéation automatique était de gagner du temps, notamment dans des régions anatomiques complexes telles que la tête et le cou. La délinéation complètement manuelle d’un scanner de la tête et du cou prenait 2,7 à 3 heures pour l’oncologue radiothérapeute (3). Les modèles de segmentation automatique sont évalués sur les écarts géométriques par rapport aux contours des experts, et l’ampleur des corrections manuelles nécessaires. Une seconde évaluation plus “fonctionnelle” mesure l’effet sur la dosimétrie des corrections et permet de distinguer les corrections significatives.
Bibliothèques d’atlas et algorithmes d’apprentissage profond
Les premiers modèles de segmentation automatique étaient fondés sur des bibliothèques d’atlas avec des performances correctes. Cependant, les algorithmes d’apprentissage profond les ont radicalement améliorés. Parmi ces modèles, les plus largement utilisés sont les U-Net. Leur architecture est composée d’un encodeur et d’un décodeur. L’encodeur est une série de couches convolutionnelles qui sous-échantillonnent les images d’entrée jusqu’à une couche à partir de laquelle le décodeur effectue un suréchantillonnage pour produire une carte de segmentation (4). Chaque étape de sous-échantillonnage est connectée à sa couche de suréchantillonnage symétrique pour prendre en compte les voxels rognés du sous-échantillonnage. Des bases de données de scanner contourés par des experts sont nécessaires pour entraîner les modèles, mais la délinéation est sujette à une grande variabilité inter-observateur, même au sein des experts (5). Cette variabilité peut entraver l’entraînement du modèle et conduire à de mauvais résultats. En conséquence, plutôt qu’un seul contour d’expert comme référence, Nikolov et al. ont développé une marge de tolérance acceptable résultant des contours de plusieurs experts (6). Cette marge de tolérance a été utilisée comme référence pour rendre compte de la précision de segmentation des modèles.
Les volumes cibles
Les solutions disponibles se concentrent principalement sur les volumes cibles anatomiques et les OAR comme les aires ganglionnaires (7). La délinéation automatique de tumeurs de gros volume et les volumes cibles cliniques hautement personnalisés qui en résultent ne sont pas encore fournis par ces solutions. Cependant, de nombreuses preuves de concept ont été publiées. Primakov et al. ont développé un modèle pour délimiter les tumeurs thoraciques (8). Le modèle utilisait la tomographie par émission de positons et le scanner de centrage pour contourer la tumeur. Chaque tumeur était également contourée par des experts qui devaient ensuite choisir à l’aveugle entre la délinéation d’un pair ou celle générée par le modèle. Dans 56 % des délinéations, les experts ont choisi la délinéation générée par l’IA au lieu de celle de leurs pairs. Cela reste un exemple de preuve de concept rétrospectif. Une telle approche a également été décrite par Lacroix et al. pour les ostéosarcomes utilisant l’IRM (9). Leur modèle a donné des performances de délinéation similaires à celles des experts et en un temps plus court.
Il est donc probable de voir sur le marché dans quelques années de telles solutions.
La dosimétrie automatique
Principe
La planification de la dose est un processus itératif où une distribution de dose est simulée informatiquement afin d’obtenir la meilleure couverture du volume cible tout en maintenant la dose sur les OAR en dessous des contraintes de dose (10). Un histogramme dose volume (HDV) est généré à partir de la distribution de dose et comparé aux contraintes de dose. De manière itérative, le dosimétriste peut modifier les contraintes HDV et les pondérations de ces dernières jusqu’à obtenir le meilleur compromis entre la couverture du volume cible et la préservation des OAR.
Bases de données d’HDV et knowledge based planning
Les premiers systèmes de planification automatique ont été créés à partir de bases de données d’HDV. C’est le knowledge based planning (KBP). Les corrélations entre les HDV et les caractéristiques anatomiques des patients sont apprises à partir d’un ensemble de plans de bonne qualité. Ensuite, pour chaque nouveau patient, le meilleur HDV réalisable peut être prédit (11). Cette approche pourrait améliorer la qualité moyenne des plans et leur homogénéité entre un dosimétriste expérimenté et un débutant (12-14). À cette fin, des variables telles que la distance de chaque OAR au PTV, et le volume d’OAR à une certaine distance du volume cible (ou PTV), le chevauchement potentiel entre le PTV et l’OAR sont extraits des contours et utilisés comme données d’entrée du modèle (15). Zhang et al. ont développé un modèle de KBP à partir de 244 cancers de la tête et du cou pour prédire les HDV et afficher tous les compromis possibles pour permettre aux médecins de naviguer parmi les plans cliniquement possibles avec les meilleurs compromis réalisables avant la planification (16).
Apprentissage profond et generative adversarial networks
Des algorithmes plus récents utilisant l’apprentissage profond ou des generative adversarial networks (GAN) ont été publiés, cependant, ils ne sont pas encore validés pour la routine clinique. Jensen et al. ont développé un modèle prédictif pour la distribution de dose 3D pour les radiothérapies de la prostate, utilisant un réseau de visualisation voxel par voxel (17). Il a donné une erreur quadratique moyenne de 2,38 ± 0,47 % de la dose prescrite. Une autre approche a été explorée : prédire des cartes de fluence à partir de faisceaux puis les convertir en distribution de dose. Wang et al. ont développé une carte de fluence pour la radiothérapie conformationnelle du cancer du sein (19). Un modèle de forêt aléatoire a été conçu pour prédire les cartes de fluence, avec une fonction dont l’objectif est d’améliorer la couverture du PTV et réduire la dose pulmonaire. Les cartes de fluence de l’IA étaient plus détaillées dans la variation d’intensité avec moins de zones de surdosage à 105 ou 110 % de la dose prescrite.
Reinforcement learning
Certains modèles se sont concentrés sur l’imitation de la prise de décision des dosimétristes lors des étapes itératives de l’optimisation dosimétrique. Ces modèles traitent des situations dans lesquelles l’anatomie du patient ou du volume cible est complexe ou hors normes. Ainsi, le reinforcement learning (apprentissage par la “récompense”) a été utilisé par Zhang et al. dans la radiothérapie corporelle stéréotaxique du cancer du pancréas (19). Les 24 plans générés avaient une couverture du PTV et une protection des OAR similaires par rapport à la planification manuelle.
Résultats
McIntosh et al. ont rapporté leur expérience pour la mise en œuvre d’un modèle de planification automatique fondé sur l’IA pour les cancers de la prostate. Une dosimétrie automatique a été générée et comparée à une dosimétrie manuelle. L’oncologue radiothérapeute pouvait alors choisir entre les deux plans et ce choix était ensuite évalué par des pairs (20). Lors du déploiement rétrospectif, le taux d’acceptabilité des dosimétries générées par l’IA était de 86 %. Parmi les dosimétries acceptables, 83 % des dosimétries générées par l’IA ont été sélectionnées pour traitement par l’oncologue radiothérapeute et 92 % par les experts. Cependant, lorsque le modèle a été déployé de manière prospective, seules 61 et 71 % des dosimétries générées par l’IA ont été choisies par l’oncologue radiothérapeute et le groupe de revue par les pairs. L’IA a cependant généré des dosimétries acceptables en un temps considérablement plus court par rapport à la planification manuelle. Cette étude montre une divergence entre le taux de plans choisis et l’évaluation prospective et rétrospective.
Cela souligne l’importance de vérifier prospectivement les performances d’un nouvel outil lors de sa mise en place.
Un benchmark de 13 solutions sans intervention humaine a été réalisé sur 10 scanners de la prostate ou de la loge prostatique par Gooding et al. (21). La meilleure solution avait rempli 89 % des critères qualité pour le contourage et 81,8 % des critères pour la dosimétrie. Sur les 10 plans, quatre remplissaient tous les critères. À noter que des solutions certifiées par les autorités étaient utilisées dans 82,5 % des cas pour le contourage, et 77 % pour la dosimétrie automatique.
La radiothérapie adaptative
Pendant la radiothérapie, la génération d’un scanner synthétique à partir de l’imagerie embarquée (cone beam computed tomography ou CBCT) permet de projeter sur la morphologie du jour la balistique calculée sur le scanner de centrage. La distribution de dose qui en résulte permet la comparaison à la distribution de dose planifiée sur le scanner de centrage. En conséquence, il est possible de comparer les HDV entre la planification initiale et la distribution de dose réelle pour décider si une adaptation du plan d’origine est nécessaire afin d’améliorer la couverture ou de mieux protéger un organe critique.
Parchur et al. ont développé un modèle pour évaluer la nécessité de la replanification adaptative pour les cancers du pancréas (22). Ils ont évalué l’indice de mesure de similarité de surface et l’entropie entre le plan de référence sans replanification et une replanification au moment de la séance.
L’utilisation d’un tel modèle pour évaluer la nécessité de la replanification adaptative pourrait ainsi aider à réduire le temps médical nécessaire et la durée des séances de radiothérapie adaptative.
Médecine prédictive et support décisionnel
L’automatisation des flux de travail décrite précédemment grâce à l’IA est progressivement mise en œuvre dans la pratique quotidienne pour le contourage et la réalisation de dosimétrie. En revanche, aucun modèle de support à la décision clinique n’est actuellement disponible pour la routine, car ils sont tous au stade de preuve de concept. Le développement d’algorithmes prédictifs susceptibles d’influencer la décision clinique est associé à plusieurs risques, tels que le manque de compréhension des limites d’un modèle, un manque d’explicabilité des prédictions fournies par le modèle et, en conséquence, des erreurs médicales potentiellement dommageables aux patients. Le modèle doit donc présenter des performances prédictives excellentes sur des données multicentriques et prospectives pour obtenir la meilleure généralisabilité possible, tout en rendant un résultat explicable, c’est-à-dire dont les facteurs sous-jacents et leur importance respective sont accessibles.
Des modèles prédictifs
Bien que non approuvées pour la pratique clinique, des preuves de concept de plus en plus robustes sont publiées. Les modèles pourraient aider à mieux prédire les résultats, qu’il s’agisse de toxicités induites par la radiothérapie ou de la réponse tumorale (23). En conséquence, la prescription de la dose et du volume pourrait être personnalisée à l’aide de ces outils.
Prédiction du contrôle tumoral local
Dans le cas des carcinomes broncho-pulmonaires non à petites cellules, un réseau de neurones a été entraîné en utilisant des données génomiques, radiomiques et de dosimétrie pour prédire conjointement le contrôle tumoral local et la pneumopathie radique. Une validation externe a été réalisée sur des patients de l’essai RTOG 0617 (24). Un C-index de 0,740 a été obtenu pour la prédiction de la pneumopathie radique, et de 0,729 pour le contrôle local.
Prédiction des métastases à distance
De même, Spratt et al. ont entraîné un modèle à partir de lames histologiques numérisées de quatre essais randomisés de phase III (NRG TROG 9202, 9413, 9910, 0126) (25-28). Le modèle a été entraîné pour prédire les métastases à distance, en utilisant des données clinico-pathologiques et d’histopathologie numériques, et la cohorte totale d’entraînement comprenait 3 935 patients. Une validation a été effectuée sur les données de l’essai RTOG 9408 avec 1 719 patients (29). Sur cette cohorte, les patients avec un biomarqueur IA positif bénéficiaient d’une hormonothérapie (HT), tandis que ceux avec un biomarqueur négatif n’en bénéficiaient pas. Ce biomarqueur prédictif IA pourrait aider à mieux évaluer si un patient a besoin d’une HT à court terme. Cette méthodologie a également été utilisée sur des patients atteints d’un cancer de la prostate à haut risque : le modèle a été entraîné sur 2 641 hommes avec un cancer de prostate à haut risque issus des essais RTOG 9408, 9413, 9902, 9910, et 0521 (26-31). Un biomarqueur IA pour prédire les métastases à distance a été entraîné en utilisant des données clinico-pathologiques et histopathologiques. La validation a été effectuée sur les patients à haut risque de l’essai RTOG 9202 (1 192 hommes), et le biomarqueur IA était pronostique pour les métastases à distance et fournissait donc un outil discriminant pour le bénéfice de l’HT. En effet, les patients avec un biomarqueur positif avaient un taux de métastases à distance plus faible lorsqu’ils recevaient une HT prolongée, tandis que les patients avec un biomarqueur négatif n’avaient pas un taux de métastases à distance différent, quelle que soit la durée de l’HT (32).
Des modèles de recommandations de prise en charge
L’IA pourrait également fournir des recommandations de prise en charge. Liu et al. ont développé un Large Language Model (LLM) pour générer une description diagnostique appropriée, et fournir des régimes et des modalités de traitement en radiothérapie (33). Il a été entraîné en utilisant les dossiers médicaux en oncologie radiothérapique de la Mayo Clinic. Le modèle LLAMA2, fourni par Meta AI, est composé de deux modèles, le premier étant optimisé pour l’utilité et le second pour l’exactitude. Il a été utilisé comme modèle de base et a subi un ajustement d’instruction pour réaliser trois tâches en fonction des données cliniques des patients : la génération d’une proposition de traitement en radiothérapie avec ses modalités et la fourniture du code de la Classification internationale des maladies (CIM). Comparé à un modèle non entraîné, le score ROUGE (Recall-Oriented Understudy for Gisting Evaluation) était de 0,4341 pour la génération de plans de radiothérapie, de 0,7903 pour la détermination des modalités de traitement et de 0,7050 pour la fourniture du code CIM (33). Le score ROUGE calcule la similarité entre un document candidat et une collection de documents de référence.
Cela pourrait aider dans la pratique quotidienne en synthétisant plusieurs documents reçus en consultation et en générant une proposition de traitement ainsi que des documents administratifs tels que les demandes de prise en charge auprès des assurances. Cependant, ces modèles sont des boîtes noires et l’explicabilité du résultat n’est pas possible. De plus, ce modèle a été entraîné sur les données de la Mayo Clinic en Arizona, dont les patients et les pratiques de prescription peuvent ne pas être généralisables. Par conséquent, une validation externe est nécessaire.
Mise en place de l’IA : enjeux
La formation
Les seuls outils d’IA actuellement mis en œuvre fournissent une délinéation automatique ou une solution de planification pour un flux de travail plus efficace ou encore une imagerie synthétique à partir d’IRM ou de CBCT. Le résultat de la planification ou de la délinéation automatique est toujours vérifié et corrigé par un opérateur humain avant l’approbation finale, car le résultat délivré par un tel algorithme est compréhensible et modifiable. En conséquence, la mise en œuvre est plus facile, car la responsabilité incombe au radiothérapeute qui peut corriger toute erreur. Pour un patient donné, les ressources nécessaires à la planification du traitement pourraient être réduites grâce à l’automatisation, tandis que la qualité pourrait être améliorée. Cependant, la formation des internes en oncologie radiothérapie et des dosimétristes devient un sujet de préoccupation. Sarrade et al. ont comparé les performances de délinéation des internes de première année qui utilisaient d’emblée la délinéation automatique à ceux qui n’y avaient pas accès (34). Il n’y avait pas de différence de qualité de la délinéation entre les deux groupes.
La base utilisée pour l’entraînement du modèle
La base sur lequel un modèle a été entraîné et validé est un point important à vérifier. Un modèle de délinéation automatique reproduira des pratiques de délinéation qui peuvent être spécifiques à un centre et non acceptables dans d’autres centres ou pays en raison de recommandations ou pratiques divergentes. Par conséquent, la première étape de test rétrospectif, puis de test prospectif du modèle à mettre en œuvre est essentielle pour évaluer l’acceptabilité et la qualité perçue des contours et dosimétries générés dans le contexte spécifique du centre où il doit être mis en place.
La validation prospective et les données disponibles
Les modèles de support à la décision clinique fournissent généralement une probabilité d’un événement, ce qui est plus difficile à vérifier. Cela explique pourquoi aucun des modèles prédictifs publiés en oncologie n’est actuellement utilisé en pratique quotidienne. En raison des conséquences potentielles sur les patients, les modèles de décision clinique nécessitent une évaluation prospective et multicentrique. Une fois leurs performances prédictives vérifiées, le bénéfice clinique de l’utilisation d’un tel modèle doit être évalué par un essai. L’explicabilité de la prédiction est encouragée par les régulateurs. Cependant, il existe des tests en routine qui correspondent à des boîtes noires, tout en présentant d’excellentes performances prédictives comme le test de fibrose hépatique. Le principal obstacle à l’élaboration de tels modèles est la disponibilité de données cliniques sur un échantillon suffisamment large et représentatif, comme l’ont montré Celi et al. : ils révélaient une surreprésentation des ensembles de données américaines et chinoises.
Les initiatives pour l’encodage systématique des données cliniques de vie réelle pourraient améliorer le développement de bases de données adaptées à l’entraînement et la validation de modèles prédictifs. Les populations de vie réelle sont plus variées que celles des essais cliniques et leur utilisation pour l’entraînement ou la validation de ces modèles en améliorerait donc la généralisabilité (35).
Les auteurs déclarent ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Wang C, Zhu X, Hong JC, Zheng D. Artificial intelligence in radiotherapy treatment planning: present and future. Technol Cancer Res Treat 2019 ; 18 : 1533033819873922.
2. Glide-Hurst CK, Lee P, Yock AD et al. Adaptive radiation therapy (ART) strategies and technical considerations: a state of the RTA review from NRG oncology. Int J Radiat Oncol Biol Phys 2021 ; 109 : 1054-75.
3. Kosmin M, Ledsam J, Romera-Paredes B et al. Rapid advances in auto-segmentation of organs at risk and target volumes in head and neck cancer. Radiother Oncol 2019 ; 135 : 130-40.
4. Ronneberger O, Fischer P, Brox T. U-Net: convolutional networks for biomedical image segmentation. Medical image computing and computer-assisted intervention – MICCAI 2015, Springer International Publishing 2015 ; p. 234-41.
5. van der Veen J, Gulyban A, Willems S et al. Interobserver variability in organ at risk delineation in head and neck cancer. Radiat Oncol 2021 ; 16 : 120.
6. Nikolov S, Blackwell S, Mendes R et al. Deep learning to achieve clinically applicable segmentation of head and neck anatomy for radiotherapy. arXiv 2018 :180904430.
7. Bibault JE, Giraud P. Deep learning for automated segmentation in radiotherapy: a narrative review. Br J Radiol 2024 ; 97 : 13-20.
8. Primakov SP, Ibrahim A, van Timmeren JE et al. Automated detection and segmentation of non-small cell lung cancer computed tomography images. Nat Commun 2022 ; 13 : 3423.
9. Lacroix M, Aouad T, Feydy J et al. Artificial intelligence in musculoskeletal oncology imaging: A critical review of current applications. Diagn Interv Imaging 2023 ; 104 : 18-23.
10. Cilla S, Ianiro A, Romano C et al. Template-based automation of treatment planning in advanced radiotherapy: a comprehensive dosimetric and clinical evaluation. Sci Rep 2020 ; 10 : 423.
11. van Gysen K, O’Toole J, Le A et al. Rolling out RapidPlan: What we’ve learnt. J Med Radiat Sci 2020 ; 67 : 310-7.
12. Powis R, Bird A, Brennan M et al. Clinical implementation of a knowledge based planning tool for prostate VMAT. Rad Oncol 2017 ; 12 : 81.
13. Yoo S, Sheng Y, Blitzblau R et al. Clinical experience with machine learning-based automated treatment planning for whole breast radiation therapy. Adv Radiat Oncol 2021 ; 6 : 100656.
14. Baker J, Sharma A, Cao Y et al. Adoption of knowledge-based treatment planning models. Int J Radiat Oncol Biol Phys 2018 ; 102 : e525.
15. Ge Y, Wu QJ. Knowledge-based planning for intensity-modulated radiation therapy: A review of data-driven approaches. Med Phys 2019 ; 46 : 2760-75.
16. Zhang J, Ge Y, Sheng Y et al. Knowledge-based tradeoff hyperplanes for head and neck treatment planning. Int J Radiat Oncol Biol Phys 2020 ; 106 : 1095-103.
17. Jensen PJ, Zhang J, Koontz BF, Wu QJ. A novel machine learning model for dose prediction in prostate volumetric modulated arc therapy using output initialization and optimization priorities. Front Artif Intell 2021 ; 4 : 624038.
18. Wang W, Sheng Y, Yoo S et al. Goal-driven beam setting optimization for whole-breast radiation therapy. Technol Cancer Res Treat 2019 ; 18 : 1533033819858661.
19. Zhang J, Wang C, Sheng Y et al. An interpretable planning bot for pancreas stereotactic body radiation therapy. Int J Radiat Oncol Biol Phys 2021 ; 109 : 1076-85.
20. McIntosh C, Conroy L, Tjong MC et al. Clinical integration of machine learning for curative-intent radiation treatment of patients with prostate cancer. Nat Med 2021; 27 : 999-1005.
21. Gooding MJ, Aluwinic S, Guerrero Urbano T et al. Fully automated radiotherapy treatment planning: a scan to plan challenge. Radiother Oncol 2024 ; 200 ; 110513.
22. Parchur AK, Lim S, Nasief HG et al. Auto-detection of necessity for MRI-guided online adaptive replanning using a machine learning classifier. Med Phys 2023 ; 50 : 440-8.
23. Cui S, Hope A, Dilling TJ et al. Artificial intelligence for outcome modeling in radiotherapy. Semin Radiat Oncol 2022 ; 32 : 351-64.
24. Bradley JD, Paulus R, Komaki R et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 2015 ; 16 : 187-99.
25. Spratt DE, Sun Y, Van der Wal D et al. An IA-derived digital pathology-based biomarker to predict the benefit of androgen deprivation therapy in localized prostate cancer with validation in NRG/RTOG 9408. J Clin Oncol 2022 ; 40 : 223.
26. Pisansky TM, Hunt D, Gomella LG et al. Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 2015 ; 33 : 332-9.
27. Roach M, Moughan J, Lawton CAF et al. Sequence of hormonal therapy and radiotherapy field size in unfavourable, localised prostate cancer (NRG/RTOG 9413): long-term results of a randomised, phase 3 trial. Lancet Oncol 2018 ; 19 : 1504-15.
28. Michalski JM, Moughan J, Purdy J et al. Effect of standard vs dose-escalated radiation therapy for patients with intermediate-risk prostate cancer: the NRG oncology RTOG 0126 randomized clinical trial. JAMA Oncol 2018 ; 4 : e180039.
29. Jones CU, Pugh SL, Sandler HM et al. Adding short-term androgen deprivation therapy to radiation therapy in men with localized prostate cancer: long-term update of the NRG/RTOG 9408 randomized clinical trial. Int J Radiat Oncol Biol Phys 2022 ; 112 : 294-303.
30. Rosenthal SA, Hunt D, Sartor AO et al. A phase 3 trial of 2 years of androgen suppression and radiation therapy with or without adjuvant chemotherapy for high-risk prostate cancer: final results of radiation therapy oncology group phase 3 randomized trial NRG oncology RTOG 9902. Int J Radiat Oncol Biol Phys 2015 ; 93 : 294-302.
31. Sartor O, Karrison TG, Sandler HM et al. Androgen deprivation and radiotherapy with or without docetaxel for localized high-risk prostate cancer: long-term follow-up from the randomized NRG oncology RTOG 0521 trial. Eur Urol 2023 ; 84 : 156-63.
32. Armstrong AJ, Liu VY, Selvaraju RR et al. Development and validation of an IA-derived digital pathology-based biomarker to predict benefit of long-term androgen deprivation therapy with radiotherapy in men with localized high-risk prostate cancer across multiple phase III NRG/RTOG trials. J Clin Oncol 2023 ; 41 : 5001.
33. Liu Z, Wang P, Li Y et al. RadOnc-GPT: a large language model for radiation oncology. arXiv 2023 : 2309.10160.
34. Sarrade T, Gautier M, Schernberg A et al. Educative impact of automatic delineation applied to head and neck cancer patients on radiation oncology residents. J Cancer Educ 2023 ; 38 : 578-89.
35. Abernethy A. Time for real-world health data to become routine. Nat Med 2023 ; 29 : 1317.