L’essentiel en un clin d’œil
Le congrès de l’ESMO 2024 a été l’occasion de la mise à jour de plusieurs essais princeps ayant changé nos pratiques, avec données qui enrichissent nos modes de décision thérapeutique en situation de séquences de traitement multiples.
TOP 1 – Cancers bronchiques non à petites cellules métastatiques avec mutation de l’EGFR : données avec l’amivantamab
L’amivantamab est un anticorps bispécifique EGFR-MET, qui a été associé au lazertinib, un inhibiteur de tyrosine kinase EGFR de troisième génération, en première ligne thérapeutique des cancers bronchiques non à petites cellules (CBNPC) avec mutation commune de l’EGFR, dans le cadre de l’essai MARIPOSA (1).
L’essai MARIPOSA
Au total, 1 074 patients ont été randomisés avec un ratio de 2:2:1 pour recevoir cette association, l’osimertinib, ou le lazertinib seul. Le critère de jugement principal était la survie sans progression de l’association amivantamab et lazertinib par rapport à l’osimertinib, par un comité de revue centralisé.
Résultats
Résultats initiaux
Lors de la présentation initiale des résultats de l’essai, l’association amivantamab-lazertinib avait montré une réduction de 30 % du risque de progression de la maladie ou de décès par rapport à l’osimertinib seul (HR = 0,70 ; IC 95 % : 0,58-0,85 ; p < 0,001), avec une survie sans progression (SSP) médiane de 23,7 mois (IC 95 % : 19,1-27,7) contre 16,6 mois (IC 95 % : 14,8-18,5).
Résultats actualisés
Lors du congrès World Conference on Lung Cancer (WCLC), qui s’est tenu juste avant celui de l’ESMO, les données actualisées de l’étude ont été présentées (2). Après un suivi médian de 31,1 mois, 44 et 34 % des patients recevaient encore un traitement dans les groupes amivantamab-lazertinib et osimertinib. Parmi les patients ayant développé une progression tumorale, 72 et 74 % avaient initié un traitement ultérieur, le plus souvent avec la chimiothérapie selon l’association carboplatine-pémétrexed. La SSP après le premier traitement ultérieur était en faveur du bras amivantamab-lazertinib (HR = 0,73 ; IC 95 % : 0,59-0,91 ; p = 0,004), de même que la SSP intracrânienne (HR = 0,82 ; IC 95 % : 0,62-1,09 ; p = 0,165). La survie globale (SG) était également en faveur de l’association, par rapport à l’osimertinib – médiane de 37,3 mois dans le bras contrôle, et non atteinte dans le bras amivantamab-lazertinib – sans que la significativité statistique soit atteinte (HR = 0,77 ; IC 95 % : 0,61-0,96 ; p = 0,019).
Données moléculaires
Enfin, lors du congrès de l’ESMO, ce sont des données moléculaires qui complètent cette actualisation, avec les résultats des rebiopsies effectuées à la progression sous l’association amivantamab et lazertinib (3). Compte tenu de l’inhibition combinée de l’EGFR et de MET, l’émergence de mutations secondaires de l’EGFR et de l’amplification de MET était réduite de 8 % sous osimertinib à 1 % sous l’association amivantamab et lazertinib, et de 14 à 4 %, respectivement. Il était observé une moindre fréquence des mutations complexes de l’EGFR, et la détection de l’ADN circulant portant la mutation initiale de l’EGFR était plus rare.
À retenir
Ces données suggèrent une inhibition plus puissante de la voie de signalisation de l’EGFR, et seront à intégrer dans les séquences thérapeutiques futures, qui comportent la chimiothérapie, seule ou associée à d’autres agents, les anticorps conjugués à la chimiothérapie et d’autres options (4).
L’essai MARIPOSA-2
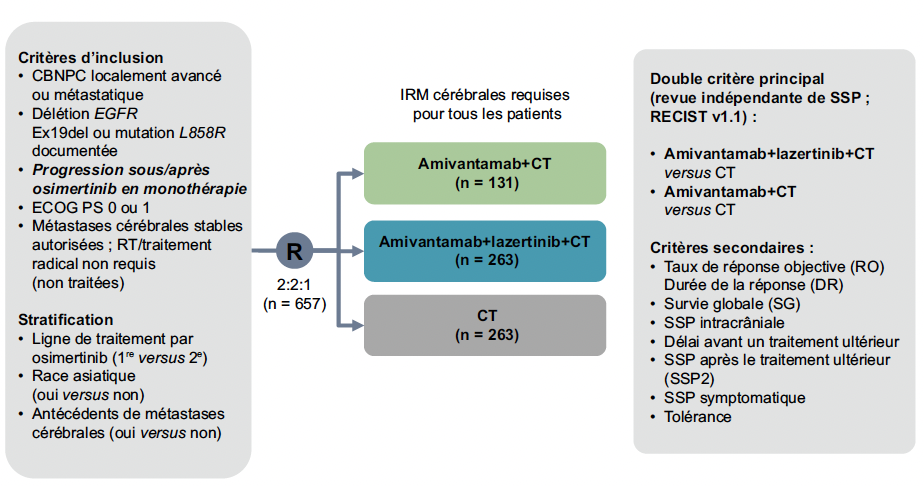
L’amivantamab, associé à la chimiothérapie, a également été évalué en seconde ligne après échec de l’osimertinib, dans l’essai MARIPOSA-2, par rapport à la chimiothérapie seule (5) (Fig. 1).
Résultats
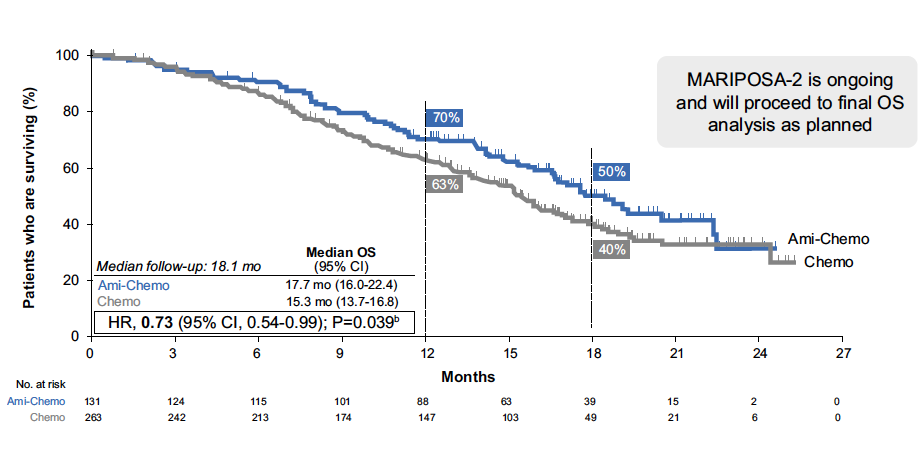
Après un suivi médian de 8,7 mois, la SSP a été significativement améliorée avec l’association amivantamab et chimiothérapie (HR = 0,48 ; IC 95 % : 0,36-0,64) par rapport à la chimiothérapie (SSP médianes respectivement de 6,3 versus 4,2 mois ; p < 0,001). Les données complémentaires présentées lors du congrès de l’ESMO incluaient l’actualisation de la SG, améliorée – de façon non significative lors de cette analyse intermédiaire – avec l’association par rapport à la chimiothérapie seule : médiane de 17,7 versus 15,3 mois (HR = 0,73 ; IC 95 % : 0,54-0,99 ; p = 0,039) (Fig. 2) (6). La SSP médiane après le premier traitement ultérieur était de 16 mois versus 11,6 mois (HR = 0,64 ; IC 95 % : 0,48-0,85 ; p = 0,002).
Figure 2 – MARIPOSA-2 : survie globale.
À retenir
Ces résultats renforcent la valeur de l’association amivantamab et chimiothérapie, actuellement disponible dans le cadre d’un accès précoce depuis septembre 2024.
La prophylaxie renforcée
Un enjeu avec l’utilisation de l’amivantamab est celui de la gestion de ses effets indésirables. L’essai COCOON est en cours, évaluant une prophylaxie renforcée comportant antibiotiques et hydratation cutanée systématique (7). Outre les données présentées précédemment avec l’amivantamab par voie sous-cutanée (8), les résultats de l’essai SKIPPirr (9) montrent une réduction de 67 % sans traitement prophylactique à 23 % avec la prise de dexaméthasone 8 mg matin et soir les 2 jours précédant la perfusion et le matin de l’injection, associée à la prophylaxie habituelle par paracétamol, antihistaminiques et 10 mg de dexaméthasone injectable. Ceci correspond à des doses de 50 mg de prednisone ou prednisolone matin et soir.
À retenir
Ce protocole peut donc être mis en œuvre dès aujourd’hui pour les patients recevant l’amivantamab, en accès précoce également en première ligne de traitement pour les CBNPC avec mutation de l’EGFR de type insertion dans l’exon 20.
1. Cho BC, Lu S, Felip E et al. Amivantamab plus lazertinib in previously untreated EGFR-mutated advanced NSCLC. N Engl J Med 2024 ; 391 : 1486-98.
2. Gadgeel S, Cho BC, Lu S et al. Amivantamab plus lazertinib vs osimertinib in first-line EGFR-mutant advanced NSCLC: longer follow-up of the MARIPOSA study. J Thorac Oncol 2024 ; 19 : OA02.03.
3. Besse B, Lee S, Lu S et al. Mechanisms of acquired resistance to first-line amivantamab plus lazertinib versus osimertinib in patients with EGFR-mutant advanced non-small cell lung cancer: An early analysis from the phase III MARIPOSA study. Ann Oncol 2024 ; 35 : LBA55.
4. Girard N. EGFR-mutated NSCLC: A roadmap to treatment sequences. Med 2024 ; 5 : 1044-7.
5. Passaro A, Wang J, Wang Y et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024 ; 35 : 77-90.
6. Popat S, Reckamp KL, Califano R et al. Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutated, advanced non-small cell lung cancer after disease progression on osimertinib: Second interim overall survival from MARIPOSA-2. Ann Oncol 2024 ; 35 : LBA54.
7. Cho BC, Girard N, Sauder MB et al. Enhanced vs standard dermatologic management with amivantamab-lazertinib in advanced NSCLC: phase 2 COCOON study. J Thorac Oncol 2024 ; 19 : P3.12D.04.
8. Girard N. TOP5 ASCO 2024 : oncologie thoracique. Onko+ 2024 ; 137 :155-61.
9. Paz-Ares L, Spira AI, Han J et al. Preventing infusion-related reactions with intravenous amivantamab: Updated results from SKIPPirr, a phase II study. Ann Oncol 2024 ; 35 : 1269P.
TOP 2 – L’immunothérapie adjuvante, une stratégie au niveau de preuve fragilisé par les résultats de l’essai BR31
En situation adjuvante, après résection d’un CBNPC de stade IIA à IIIB et administration d’une chimiothérapie à base de sels de platine, deux essais ont montré un bénéfice en termes de survie sans récidive (SSR) avec un traitement par immunothérapie pendant 1 an, soit avec l’atézolizumab (essai IMpower010) (10), soit avec le pembrolizumab (essai PEARLS/KEYNOTE-091) (11). Dans l’essai IMpower010, il existait un bénéfice en termes de SSR et de SG en situation d’expression de PD-L1 ≥ 50 %, population dans laquelle l’AMM européenne a été obtenue. Dans l’essai PEARLS/KEYNOTE-091, le bénéfice de SSR était observé uniquement dans le sous-groupe stratifié de patients avec une tumeur exprimant le PD-L1 pour moins de 50 % des cellules tumorales, mais l’AMM européenne a été obtenue sans restriction à cette population. En France, ces stratégies ne font pas l’objet aujourd’hui d’un remboursement.
L’essai CCTG BR.31
Lors du congrès de l’ESMO, les résultats d’un troisième essai adjuvant, avec le durvalumab, ont été présentés (12). Cette étude a recruté 1 415 patients après résection d’un CBNPC de stade IIA à IIIB et possiblement chimiothérapie à base de sels de platine, avec une randomisation entre placebo et durvalumab.
Résultats
Après une médiane de suivi de 60 mois, le durvalumab ne montrait pas de bénéfice de SSR par rapport au placebo, dans le sous-groupe de patients pré-spécifié pour le critère de jugement principal (expression de PD-L1 ≥ 25 %, absence d’altérations de l’EGFR ou de ALK) (HR = 0,935 ; IC 95 % : 0,706-1,247 ; p = 0,642).
À retenir
Ces résultats confortent le fait que les stratégies adjuvantes avec l’immunothérapie ne sont pas optimales, dans un contexte où les stratégies néoadjuvantes et péri-opératoires sont devenues le standard de prise en charge.
10. Felip E, Altorki N, Zhou C et al. Overall survival with adjuvant atezolizumab after chemotherapy in resected stage II-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase III trial. Ann Oncol 2023 ; 34 : 907-19.
11. O’Brien M, Paz-Ares L, Marreaud S et al. Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022 ; 23 : 1274-86.
12. Goss G, Darling GE, Westeel V et al. CCTG BR.31: A global, double-blind placebo-controlled, randomized phase III study of adjuvant durvalumab in completely resected non-small cell lung cancer (NSCLC). Ann Oncol 2024 ; 35 : LBA48.
TOP 3 – Quels patients doivent recevoir l’immunothérapie adjuvante après chimio-immunothérapie néoadjuvante ?
L’essai CheckMate-816
En situation néoadjuvante, l’essai randomisé de phase III CheckMate-816 a en effet démontré l’intérêt de l’adjonction de nivolumab à la chimiothérapie, chez 358 patients atteints de CBNPC résécable de stade IB à IIIA dans la 7e édition de la classification TNM, en termes de réponse pathologique complète (24 % avec l’association versus 2 % avec la chimiothérapie seule) et de survie sans événement (SSE) de 43,8 versus 18,4 mois (HR = 0,66 ; IC 95 % : 0,49-0,90) (13). La réponse pathologique complète était fortement corrélée à la survie, avec moins de 10 % des patients présentant une récidive ou un décès dans cette situation.
À retenir
Le traitement néoadjuvant est donc le standard pour une majorité de patients, avec un accès précoce en cours pour cette stratégie en situation d’expression de PD-L1 ≥ 1 %.
Plusieurs essais cliniques ont évalué des stratégies péri-opératoires comportant, outre une phase de chimio-immunothérapie néoadjuvante, une phase d’immunothérapie adjuvante pendant une année.
L’essai CheckMate-77T
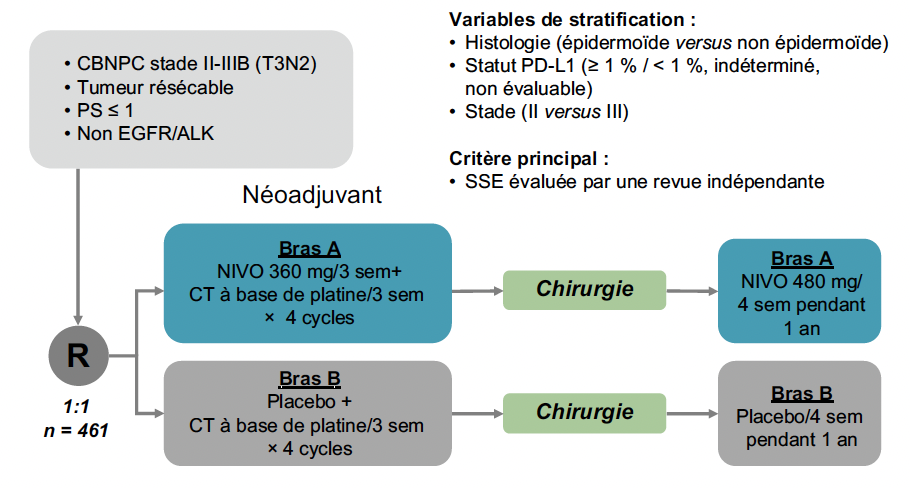
Lors du congrès de l’ESMO, les résultats actualisés de l’essai CheckMate-77T ont été présentés (14). Cette étude a inclus 461 patients atteints de CBNPC de stade IIA-IIIB résécable, avec un traitement péri-opératoire par chimiothérapie et nivolumab pour quatre cycles en néoadjuvant et un traitement adjuvant par nivolumab pendant 12 mois (Fig. 3).
Figure 3 – CheckMate-77T : schéma de l’essai.
Résultats
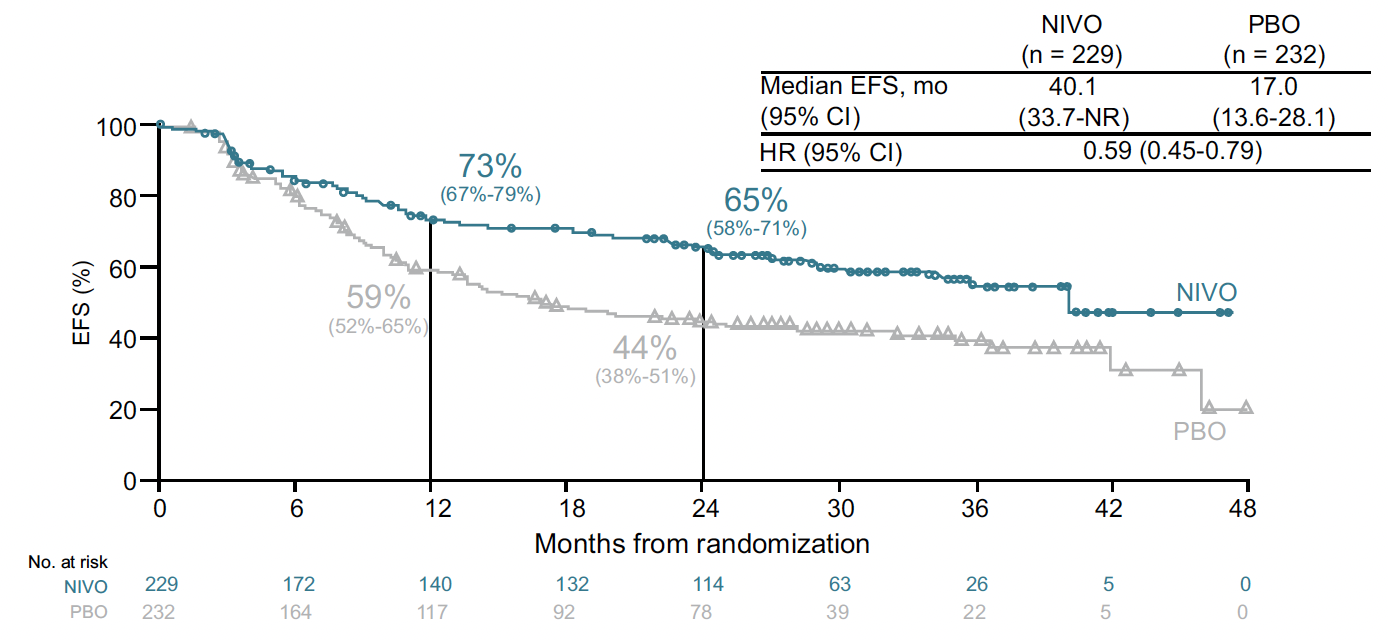
La SSE après un suivi médian de 33 mois indique un bénéfice important en faveur du bras nivolumab : taux de SSE de 65 versus 44 % à 2 ans (HR = 0,59 ; IC 95 % : 0,45-0,79) (Fig. 4). Chez les patients opérés, le principal facteur pronostique était la réponse pathologique complète, mais le bénéfice du nivolumab était retrouvé chez les patients avec et sans réponse pathologique complète.
Figure 4 – CheckMate-77T : survie sans événement.
L’analyse poolée
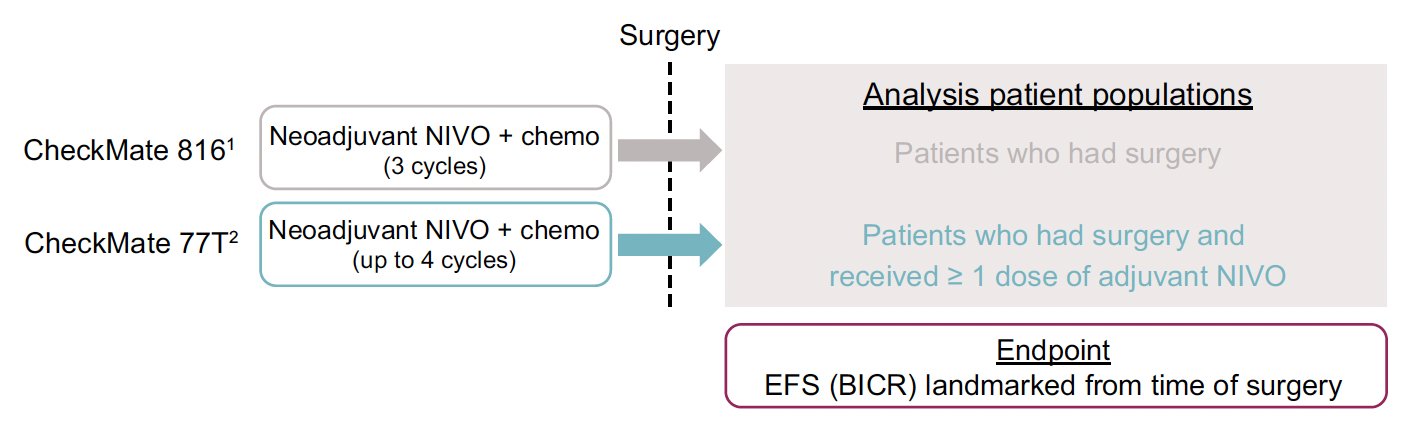
Une analyse poolée des données des patients inclus dans l’essai CheckMate-816 opérés après chimiothérapie et nivolumab, et des patients inclus dans l’essai CheckMate-77T opérés après chimiothérapie et nivolumab et ayant reçu au moins un cycle de nivolumab en adjuvant, a été présentée lors du congrès WCLC (Fig. 5) (15).
Figure 5 – CheckMate-816 et CheckMate-77T : schéma de la comparaison indirecte des deux essais.
Résultats
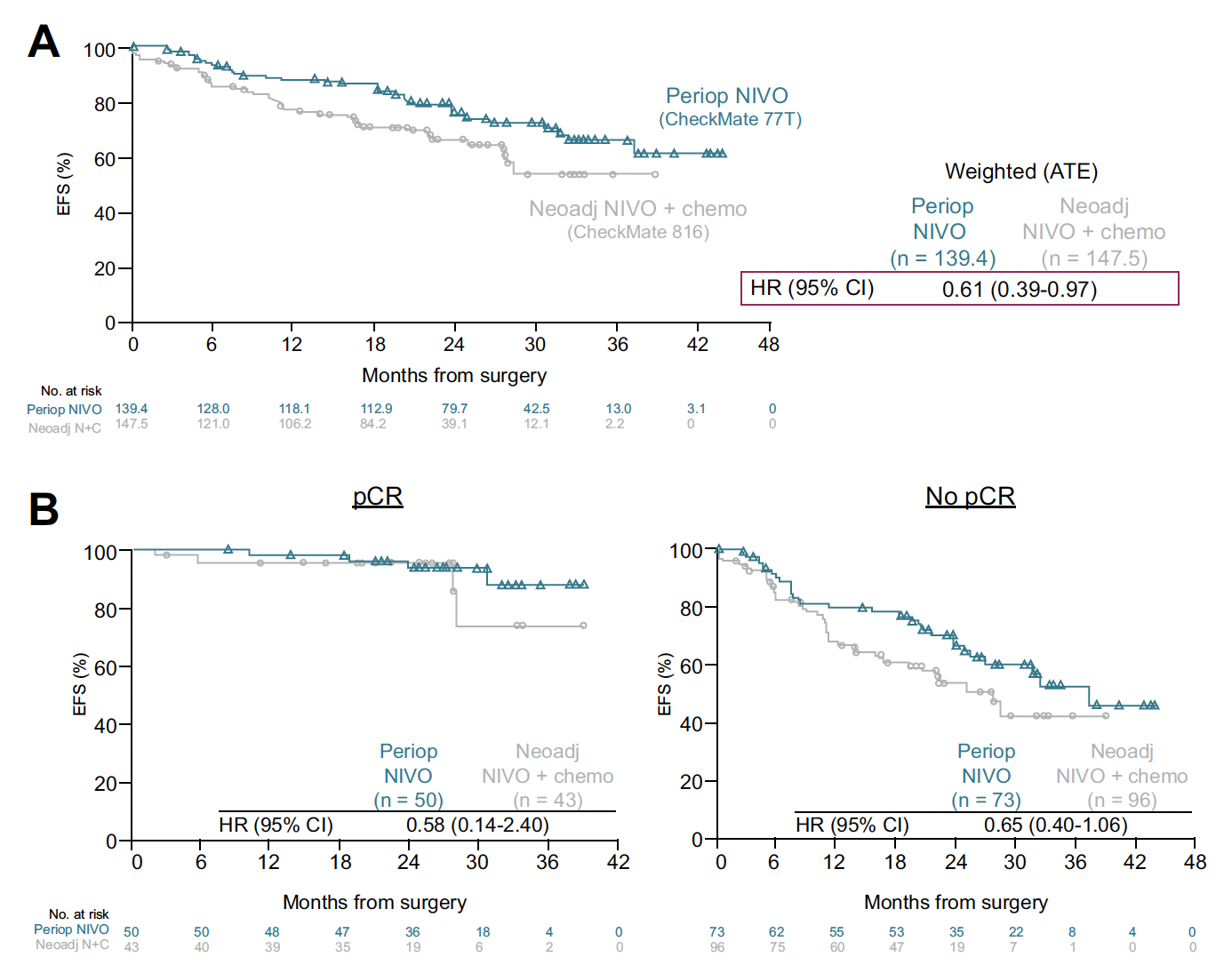
Les résultats suggèrent un bénéfice de la stratégie péri-opératoire, avec le schéma CheckMate-77T, par rapport au néoadjuvant seul de l’essai CheckMate-816 (HR = 0,61 ; IC 95 % : 0,39-0,97), dans ce sous-groupe exploratoire de patients (Fig. 6A). Le bénéfice semblait restreint aux patients sans réponse pathologique complète (Fig. 6B).
Figure 6 – CheckMate-816 et CheckMate-77T : résultats de la comparaison indirecte des essais dans la population totale des patients opérés (A) et en fonction du niveau de réponse pathologique (B).
À retenir
Ces données confortent le concept de réponse pathologique complète comme facteur pronostique majeur, possiblement associé à l’absence de bénéfice d’un traitement adjuvant post-néoadjuvant. Des essais comparant traitement adjuvant et absence de traitement adjuvant en post-néoadjuvant débutent, en particulier l’essai ETOP IBCSG 25-23 ADOPT, fondé sur une immunothérapie par durvalumab et avec une stratification sur la réponse pathologique complète.
13. Forde PM, Spicer j, Lu S et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022 ; 386 : 1973-85.
14. Provendio Pulla M, Awad M, Cascone T et al. Perioperative nivolumab (NIVO) v placebo (PBO) in patients (pts) with resectable NSCLC: Clinical update from the phase III CheckMate 77T study. Ann Oncol 2024 ; 35 : LBA50.
15. Forde PM, Peters S, Donington J et al. Perioperative vs neoadjuvant nivolumab for resectable NSCLC: patient level data analysis of CheckMate 77T vs CheckMate 816. J Thorac Oncol 2024 ; 19 : PL02.08.
TOP 4 – Vers des agents de nouvelle génération en situation de cancer bronchique non à petites cellules avec réarrangement de ALK : résultats de l’essai ALKOVE
Le NVL-655 est un puissant inhibiteur de tyrosine kinase sélectif de ALK, pénétrant dans le système nerveux central, et conçu pour répondre aux principales limitations des inhibiteurs de ALK de génération précédente, y compris le lorlatinib. Cet agent a en effet démontré une activité préclinique contre diverses fusions et mutations de résistance de ALK, y compris des mutations complexes réfractaires au lorlatinib, tout en évitant l’inhibition de la TRK, qui est associée à des toxicités neurologiques.
L’essai ALKOVE-1
Dans l’essai de phase I ALKOVE-1 (16), présenté lors du congrès, ont recrutés 133 patients atteints de tumeurs solides ALK+ avancées prétraitées. Les principaux objectifs étaient la sélection d’une dose recommandée pour la phase II, la sécurité et l’efficacité en termes de taux de réponse.
Au total, 131 patients étaient porteurs de CBNPC. Le NVL-655 a été administré à des doses de 15 à 200 mg par voie orale une fois par jour. Les patients avaient déjà reçu une médiane de trois (intervalle : 1-8) thérapies anticancéreuses antérieures, y compris des inhibiteurs de seconde génération ou du lorlatinib pour 100 % d’entre eux, au moins un inhibiteur de seconde génération et du lorlatinib pour 79 % d’entre eux, au moins trois inhibiteurs de tyrosine kinase pour 46 % d’entre eux, et de la chimiothérapie pour 56 % d’entre eux. 56 % avaient des antécédents de métastases cérébrales.
Résultats
Dose maximale tolérée
La dose maximale tolérée n’a pas été atteinte. Une dose de 150 mg par jour a été choisie comme RP2D, offrant une sécurité favorable, une activité et une exposition dépassant les seuils d’efficacité ciblés pour les mutations de résistance à ALK.
Effets indésirables
Les effets indésirables les plus fréquents étaient l’augmentation des transaminases chez un tiers des patients, la constipation (15 % des patients), les nausées (12 % des patients) et la dysgueusie (11 % des patients).
Taux de réponse
Les taux de réponse étaient de :
• 55 % pour les patients avec une ou des mutations de ALK,
• 71 % en situation de mutation G1202R,
• et 57 % chez les patients naïfs de traitement par lorlatinib.
La médiane de durée de réponse était de 14,4 mois. Le taux de réponse intracrânienne était de
• 50 % chez les patients naïfs de lorlatinib,
• et 15 % chez les patients pré-traités par lorlatinib.
À retenir
Le développement du NVL-655 se poursuit au sein de l’essai de phase II ALKOVE-1 avec plusieurs cohortes en fonction du type de traitement antérieur et en première ligne. L’intérêt de cet agent semble être effectivement en ligne avancée post-lorlatinib compte tenu de son efficacité en situation de mutations complexes de ALK. L’essai est ouvert en France.
16. Drilon AE, Lin JJ, Johnson ML et al. Phase I/II ALKOVE-1 study of NVL-655 in ALK-positive (ALK+) solid tumours. Ann Oncol 2024 ; 35 : 1253O.
TOP 5 – Osimertinib en traitement de consolidation après chimio-radiothérapie pour un cancer bronchique non à petites cellules avec mutation commune de l’EGFR : données actualisées de l’essai LAURA
Pour les patients atteints d’un CBNPC localement avancé non résécable, le standard de prise en charge repose sur la chimio-radiothérapie suivie d’une consolidation par le durvalumab pendant 1 an, selon le schéma PACIFIC. Le bénéfice de l’immunothérapie de consolidation n’était pas spécifiquement retrouvé pour les patients atteints d’un cancer avec mutation commune de l’EGFR, et l’essai LAURA s’est ainsi intéressé à évaluer un traitement de consolidation par osimertinib dans cette population (17).
L’essai LAURA
L’essai était randomisé en double aveugle contre placebo, avec une randomisation après chimio-radiothérapie séquentielle ou concomitante et la poursuite de l’osimertinib ou du placebo jusqu’à progression ou toxicité.
Résultats
Au total, les résultats montrent un bénéfice de l’osimertinib en termes de SSP (HR = 0,16 ; IC 95 % : 0,10-0,24 ; p = 0,001), avec une médiane de respectivement 39,1 versus 5,6 mois. L’analyse intermédiaire de la SG était limitée par la faible maturité des données, mais il existait une tendance en faveur de l’osimertinib (HR = 0,81 ; IC 95 % : 0,42-1,56 ; p = 0,530) (17).
Les données présentées lors du congrès (18) montrent que la SSP était identique chez les patients ayant eu ou non une tomographie par émission de positons au 18-FDG – qui est le standard pour obtenir une stadification optimale de la maladie en pré-thérapeutique, et ne pas méconnaître une maladie métastatique. Les résultats montrent également une réduction du risque de récidives locales et à distance avec l’osimertinib. En particulier, l’incidence des métastases cérébrales était de 11 % à 1 an sous osimertinib versus 37 % sous placebo.
À retenir
Ces résultats renforcent la position de l’osimertinib en consolidation après chimio-radiothérapie pour un cancer bronchique non à petites cellules avec mutation de l’EGFR, comme nouveau standard thérapeutique.
17. Lu S, Kato T, Dong X et al. Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024 ; 391 : 585-97.
18. Ahn M, Baisamut TR, Ozguroglu M et al. Osimertinib (osi) after definitive chemoradiotherapy (CRT) in unresectable (UR) stg III EGFRm NSCLC: Analyses of CNS and distant progression from the phase III LAURA study. Ann Oncol 2024 ; 35 : 1241MO.
En conclusion, l’année 2024 se termine avec de nombreux résultats affectant nos pratiques dès 2025. L’accès aux essais cliniques représente un enjeu avec un bénéfice significatif pour nos patients.
Nicolas Girard déclare avoir des liens d’intérêt avec Abbvie, Amgen, AstraZeneca, BeiGene, Boehringer Ingelheim, BMS, Daiichi Sankyo, Eli Lilly, Gilead, Hoffmann-La Roche, Ipsen, Janssen, Leo Pharma, Metronic, Merck, Merck Sharp & Dohme, Novartis, Pfizer, Sanofi, Sivan et Takeda.