L’essentiel en un clin d’œil
• Carcinomes bronchiques non à petites cellules inopérables : radiothérapie avec boost à 74 Gy fondé sur un TEP-FDG intermédiaire à 42 Gy dans le cadre d’une chimio-radiothérapie (RTEP7-IFCT1401) .
• Cancers bronchiques non à petites cellules inéligibles à la chimiothérapie : quid du durvalumab après radiothérapie (essai DUART) ?
• Cancers du col utérin localement avancés : une étude de phase III randomisée, en double aveugle évaluant le pembrolizumab associé à la chimio-radiothérapie.
• Cancers du pancréas marginalement opérables (borderline) : chimiothérapie néoadjuvante par FOLFIRINOX versus chimio-radiothérapie avec gemcitabine (PREOPANC-2).
• Cancer de la prostate : radiothérapie adjuvante ou différée précoce après prostatectomie radicale (RADICALS RT).
TOP 1 – Carcinome bronchique non à petites cellules inopérable : radiothérapie avec boost à 74 Gy fondé sur un TEP-FDG intermédiaire à 42 Gy dans le cadre d’une chimio-radiothérapie
Le traitement des carcinomes bronchiques non à petites cellules (NSCLC) localement avancés, inopérables repose actuellement sur une chimio-radiothérapie (RCT) concomitante suivie d’une immunothérapie par durvalumab. La dose standard est de 66 Gy : un essai du RTOG avait randomisé 60 versus 74 Gy (1), et avait mis en évidence un effet délétère sur la survie globale dans le bras haute dose. Cependant, l’augmentation de la dose était réalisée sur l’ensemble du volume cible, ce qui peut expliquer en partie le mauvais résultat obtenu, avec, en particulier, une augmentation des complications cardiovasculaires. D’où l’idée de ne booster qu’une partie du volume-cible. Dans cet essai prospectif multicentrique de phase II randomisé, c’est le volume résiduel métaboliquement actif après 42 Gy qui est considéré comme le volume à haut risque de récidive et qui va donc être boosté.
L’étude RTEP7-IFCT1401
Il s’agit d’une phase II randomisée ; tous les patients avaient un NSCLC prouvé histologiquement sans métastase à distance sur un TEP-FDG à l’inclusion et non opérables du fait de l’extension de la maladie (stades IIIA ou B). Ils devaient être en bon état général (PS : 0-1) et pouvaient recevoir une RCT concomitante. Une chimiothérapie d’induction (deux cycles) était faite avant la RCT.
• Dans le bras expérimental (bras A), un TEP-FDG intermédiaire était réalisé à 42 Gy : s’il persistait une fixation, un complément de dose sur la zone métaboliquement active jusqu’à 74 Gy était réalisé, sinon, la dose standard de 66 Gy sur l’ensemble du volume cible initial était appliquée.
• Le bras contrôle (bras B) consistait en une RCT standard à la dose de 66 Gy.
Les critères de jugement
Le critère de jugement principal était le contrôle local, évalué sur des TEP-FDG répétés à 6 mois, 1 an, 2 ans et 3 ans, évalué sur une revue centralisée de l’imagerie. Pour un contrôle local à 1 an estimé à 51 % dans le bras contrôle, et une hypothèse de 66 % dans le bras expérimental, 75 patients par bras devaient être recrutés.
Les autres critères de jugement étaient la survie sans progression, la survie globale et la toxicité.
Résultats
Les patients
Cent cinquante-huit patients ont été inclus, 81 dans le bras A et 77 dans le bras B, mais, en définitive, seuls 67 étaient éligibles dans le bras A et 73 dans le bras B.
Dans le bras A, 48/68 patients ayant reçu la RCT ont eu un boost sur le volume résiduel (70,6 %).
Les principaux facteurs pronostiques étaient identiques dans les deux bras : 70 % d’hommes, âge moyen de 62 ans, 38 % d’épidermoïdes, 50 % de stade IIIA.
Plus de 80 % des patients ont été traités en modulation d’intensité et 48 % des patients dans les deux bras ont reçu du durvalumab après la RCT.
Tolérance
En termes de tolérance, pas de différence entre les deux bras, que ce soit pour la toxicité aiguë ou tardive ; en particulier pas d’augmentation de la toxicité cardiaque ou pulmonaire.
Le contrôle locorégional et les survies
Le contrôle locorégional à 1 an a été de 77,6 % dans le bras A et de 71,2 % dans le bras B, et à 3 ans de 61,2 versus 57,5 %.
Les médianes de survie sans progression étaient de 22,3 contre 12,3 mois et, pour la survie globale, non atteinte dans le bras A et de 43,3 mois dans le bras B, ces différences n’étant pas significatives.
À retenir
La principale conclusion est que ce boost guidé par l’imagerie métabolique est bien toléré, tant en aigu qu’en tardif. Même si une tendance se dessine pour une amélioration du contrôle local, ainsi que des survies sans progression et globale, ces différences ne sont pas significatives. Les contrôles locaux observés sont supérieurs aux hypothèses statistiques et ceci, dans les deux bras.
En bref, pour l’instant, cette approche quoique prometteuse ne peut pas être considérée comme un standard de traitement. Il est nécessaire de réaliser un essai de phase III avec des hypothèses plus optimistes sur le contrôle local et avec, de toute façon, la survie comme objectif principal avant de conclure sur l’intérêt de cette stratégie.
• Vera P et al. Radiotherapy boost to 74 Gy based on FDG-PET at 42 Gy of radio-chemotherapy (RCT) in patients with inoperable stage III Non-Small Cell Lung Cancer (RTEP7 – IFCT 1401). Ann Oncol 2023 ; 34 : 1291O.
1. Bradley JD et al. Long-term results of NRG oncology RTOG 0617: standard- versus high-dose chemoradiotherapy with or without cetuximab for unresectable stage iii non-small-cell lung cancer. J Clin Oncol 2020 ; 38 : 706-14.
TOP 2 – Durvalumab après radiothérapie chez les patients présentant un cancer bronchique non à petites cellules inéligibles pour la chimiothérapie
Très fréquemment, les patients porteurs d’un cancer bronchique non à petites cellules (NSCLC) ont un état général altéré (PS : 2 en particulier) ou bien un âge avancé, interdisant la réalisation de toute chimiothérapie. En cas de tumeur non métastatique, le traitement de référence est la radiothérapie exclusive, parfois réalisée juste à titre palliatif. L’essai PACIFIC a démontré l’intérêt du durvalumab après RCT. Cet essai prospectif de phase II, multicentrique, permet d’évaluer son intérêt dans cette population (essai DUART).
L’étude DUART
Les critères d’inclusion étaient les patients porteurs d’un NSCLC de stade III inopérable et inéligible pour la chimiothérapie, pouvant en revanche recevoir une radiothérapie (ECOG PS : 0-2).
La radiothérapie pouvait être délivrée selon :
• un schéma conventionnel (60 Gy – cohorte A)
• ou bien un schéma palliatif (40 à 54 Gy, ou équivalent biologique – cohorte B).
Tous les patients recevaient du durvalumab 1 500 mg toutes les 4 semaines pendant 1 an. Le durvalumab était administré dans les 6 semaines qui suivaient la RT.
Le principal critère de jugement était le taux de complications dans les 6 mois après l’initiation du durvalumab. Les critères secondaires étaient la survie sans progression et la survie globale.
Résultats
Les patients
Cent deux patients ont été inclus dans cette étude. L’âge médian était de 79 ans et près de 65 % des patients avaient plus de 75 ans. Cependant, la grande majorité d’entre eux (92 %) avaient un PS de 0 ou 1, avec donc une contre-indication à la chimiothérapie essentiellement liée à l’âge. Une expression de PD-L1 (≥ 1 %) était trouvée chez 51,4 % des patients. Tous les patients ont eu au moins une injection de durvalumab.
Tolérance
Une interruption de traitement (donc sans atteindre les 12 mois) a été notée chez 58,8 % des patients, soit pour des effets secondaires (22,5 % des patients), soit pour maladie progressive (17,6 %) essentiellement.
Il est rapporté des effets secondaires de grade 3/4 chez 39,2 % des patients. Et donc ceci a mené à une interruption du traitement, essentiellement pour pneumopathie. Dans une nomenclature alternative (PRAE : effets secondaires possiblement rapportés au traitement), le taux d’événements de grade 3/4 dans les 6 premiers mois n’est que de 9,8 %.
Réponses au traitement
On note une réponse partielle dans 26,5 % des cas et une stabilité de la maladie dans 46,1 % des cas. La survie sans progression à 12 mois est de 34,8 % pour l’ensemble de la population et respectivement de 40,2 et 29,3 % pour les cohortes A et B. De la même manière, les survies globales à 12 mois sont de 62,2, 67 et 56,3 %.
À retenir
La prise en charge des cancers bronchiques chez le patient âgé fait débat ; le bénéfice de la chimiothérapie est discuté et elle doit de toute façon être adaptée à l’âge. Cet essai met en évidence la faisabilité du durvalumab en post-RT chez le patient âgé et pourrait représenter une modalité thérapeutique intéressante. Les données de survie sont relativement satisfaisantes avec, en particulier, une survie sans progression à 1 an de 40,2 % en cas de dose standard (60 Gy). Et donc une nouvelle arme thérapeutique, nécessitant cependant une surveillance rapprochée, du fait de la fréquence des effets secondaires.
• Filipi AR et al. Durvalumab after radiotherapy in patients with unresectable stage III NSCLC ineligible for chemotherapy. Ann Oncol 2023 ; 34 : LBA62.
TOP 3 – Pembrolizumab associé à la chimio-radiothérapie dans les cancers du col utérin localement avancés : une étude de phase III randomisée, en double aveugle (ENGOT-cx11/GOG-3047/KEYNOTE-A18)
Depuis plusieurs années, le traitement standard des cancers du col utérin localement avancés repose sur une chimio-radiothérapie concomitante. Le cisplatine hebdomadaire à la dose de 40 mg/m2 est actuellement le protocole le plus largement utilisé. La curiethérapie utéro-vaginale est indispensable pour obtenir un contrôle local optimal et ne peut pas être remplacée par une technique de radiothérapie externe. La chimiothérapie néoadjuvante ou adjuvante n’a pas démontré de bénéfice.
Il existe un fort rationnel biologique pour associer l’immunothérapie à l’irradiation : synergie sur la mort immunologique, démasquage antigénique via l’irradiation permettant à la radiothérapie de créer un vaccin antitumoral et de favoriser l’action de l’inhibiteur de checkpoint…
Le pembrolizumab a montré son intérêt dans les cancers du col utérin métastatiques, en association avec la chimiothérapie, et apparaît bien toléré avec la chimio-radiothérapie dans un essai de phase II. D’où la réalisation de cet essai randomisé.
L’étude ENGOT-cx11/GOG-3047/KEYNOTE-A18
Les critères d’inclusion étaient les suivants : cancers du col de stade FIGO IB2-IIB et cN1 ou FIGO III-IVA cN0-1.
• Le bras expérimental recevait une chimio-radiothérapie (CRT) avec du cisplatine hebdomadaire (cinq ou six cycles) suivie d’une curiethérapie en association avec du pembrolizumab 200 mg toutes les 3 semaines pour cinq cycles, suivie par une maintenance de 400 mg toutes les 6 semaines pour 15 cycles.
• Le bras contrôle recevait un traitement identique avec un placebo en remplacement du pembrolizumab.
Le critère de jugement principal était la survie sans progression évaluée par l’investigateur et la survie globale.
Le schéma statistique prévoyait une analyse intérimaire après la survenue de 237 événements.
Résultats
Les patientes
Mille soixante patientes ont été randomisées dans 176 centres dans 30 pays : 529 dans le bras expérimental et 531 dans le bras contrôle.
L’âge moyen était de 50 ans, 85 % avaient un carcinome épidermoïde. Le score CPS PD-L1 était ≥ 1 dans 94 % des cas. 44 % des patientes avaient un stade IB2-IIB et 56 % un stade III-IVA. Près de 85 % des patientes avaient une atteinte ganglionnaire et près de 22 % une atteinte lombo-aortique.
La radiothérapie a été réalisée en modulation d’intensité chez 88 % des patientes et 91 % ont reçu une dose ≥ 70 Gy. À noter que la dose médiane au col utérin est de 87 Gy, ce qui démontre que la plupart des patientes ont eu une curiethérapie. La radiothérapie a été réalisée en moins de 56 jours chez 74,5 % des patientes.
Les survies
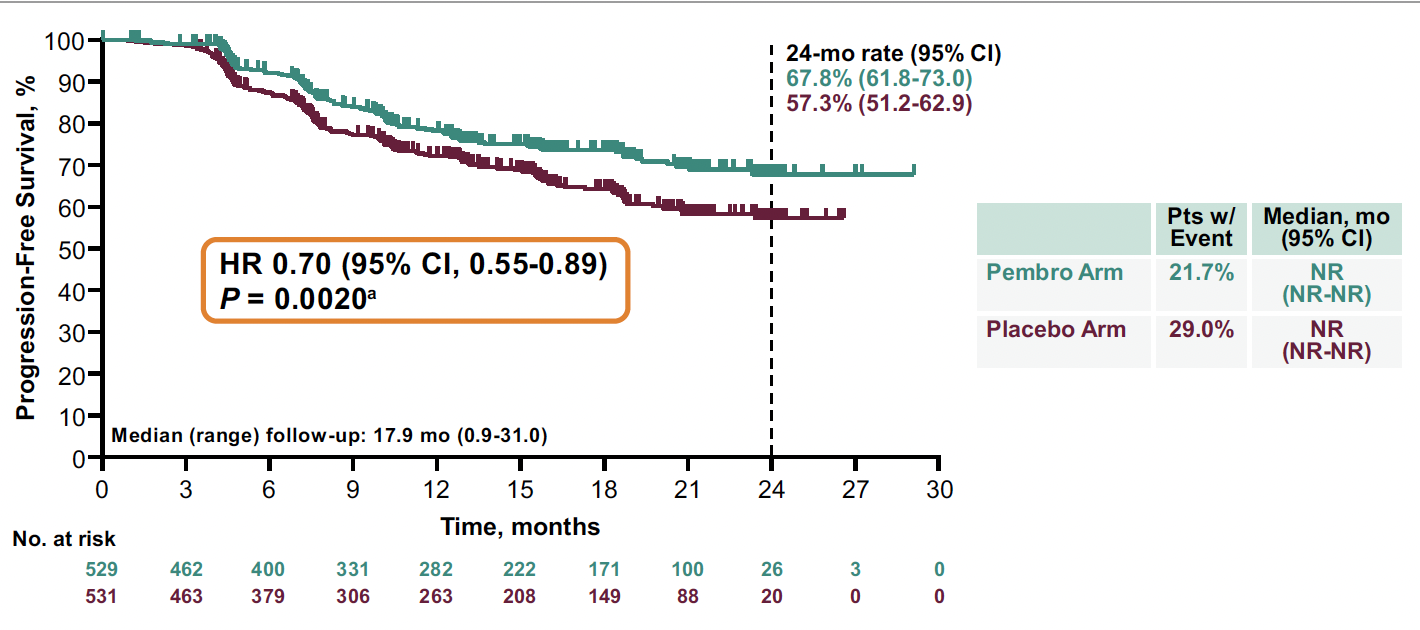
La survie sans progression est significativement améliorée dans le bras expérimental (Fig. 1), avec un Hazard Ratio (HR) de 0,70 (p = 0,0020) et une survie sans progression à 2 ans de 67,8 versus 57,3 %.
Figure 1 – ENGOT-cx11/GOG-3047/KEYNOTE-A18 : survie sans progression dans les cancers du col utérin localement avancés traités par chimio-radiothérapie avec ou sans pembrolizumab.
À la recherche de sous-groupes pouvant bénéficier le plus du pembrolizumab, on note un net bénéfice pour les patientes de stade III-IVA.
Pour la survie globale, le HR est de 0,73 (non significatif) avec, à 24 mois, des survies globales de 87,2 versus 80,8 % en faveur du bras pembrolizumab.
Tolérance
Le nombre d’événements de grade ≥ 3 est légèrement plus élevé dans le bras pembrolizumab (67 versus 60,6 %), mais avec assez peu d’événements liés à l’immunothérapie (4,2 %). Ces événements indésirables sont essentiellement liés à la CRT : anémie, nausées, diarrhées, leucopénie… On note cependant 30,7 % de perturbations thyroïdiennes et 2,7 % de colites auto-immunes. Il n’y a cependant pas de différence sur la qualité de vie, sauf une récupération plus tardive du niveau de base dans le bras pembrolizumab.
À retenir
Il s’agit d’une analyse intermédiaire, mais c’est un signal fort pour penser que l’association d’une CRT avec le pembrolizumab va devenir un standard de traitement dans les mois qui viennent. C’est une excellente nouvelle, car il n’y avait pas eu de progrès manifeste dans cette pathologie depuis la chimiothérapie concomitante et la curiethérapie guidée par l’image. Nous attendons donc l’analyse définitive et sa publication.
• Lorusso D et al. Pembrolizumab plus chemoradiotherapy for high-risk locally advanced cervical cancer: the randomized, double-blind, phase 3 ENGOT-cx11/GOG-3047/KEYNOTE-A18 study. Ann Oncol 2023 ; 34 : LBA38.
TOP 4 – PREOPANC-2 : chimiothérapie néoadjuvante par FOLFIRINOX versus chimio-radiothérapie avec gemcitabine pour les cancers du pancréas marginalement opérables (borderline)
Les résultats de la chirurgie dans les cancers pancréatiques localement avancés sont relativement décevants avec moins de 10 % de survivants à 5 ans. Mais cela reste le seul traitement réalisé à visée curative. Pour les cancers borderline, le Dutch Pancreatic Cancer Group (DPCG) avait montré qu’une chimio-radiothérapie (RCT) pré-opératoire améliorait la survie à 5 ans qui passait de 6,5 % avec chirurgie seule à 20,5 % (2). Cette approche a été confirmée par une méta-analyse regroupant sept essais randomisés (3). En France, une approche par chimiothérapie première par FOLFIRINOX est devenue un standard de traitement (4).
Cet essai vise à comparer les deux approches : RCT pré-opératoire versus FOLFIRINOX.
L’étude PREOPANC-2
Il s’agit d’un essai randomisé de phase III incluant les cancers du pancréas dits borderline essentiellement pour une proximité vasculaire de la tumeur.
• Le bras A consistait en 8 cycles de FOLFIRINOX suivis de chirurgie.
• Le bras B d’une CRT (avec de la gemcitabine employée à dose radio-sensibilisante) encadrée par un cycle de gemcitabine avant et après la RCT suivie d’une chirurgie et de quatre cycles de gemcitabine en adjuvant.
Le critère de jugement principal était la survie globale. En considérant que le FOLFIRINOX ferait mieux que la RCT, avec un HR attendu de 0,7, il était nécessaire d’inclure 368 patients.
Résultats
Les patients
Trois cent soixante-quinze patients ont été inclus entre juin 2018 et janvier 2021. L’âge médian était de 68 ans et 60 % des patients avaient un PS à 0.
Dans le bras RCT, 88 % des patients ont pu réaliser le traitement néoadjuvant dans son intégralité, contre 62 % dans le bras A ; mais 81 % ont reçu plus de quatre cycles de FOLFIRINOX.
Une exploration chirurgicale a été tentée chez respectivement 84 et 90 % des patients (bras A et B) et une résection a pu être faite dans 77 et 75 % des cas.
Survie globale, taux de réponse et tolérance
Il n’y a aucune différence en survie globale : les médianes de survie sont de 21,9 et 21,3 % (bras A et B) avec des survies à 3 ans de 35,6 versus 32,8 % (HR = 0,87 ; p = 0,28).
Les taux de réponse complète histologique sont de 11 versus 5 % (p = 0,26) et les taux de R0 de 61 versus 67 % (p = 0,28).
Les toxicités sont celles attendues avec, cependant, plus de diarrhées dans le bras FOLFIRINOX (23 versus 0 % ; p < 0,001).
À retenir
Aucune différence en survie ou sur les autres critères de jugement (résection complète, réponse complète histologique) entre une chimiothérapie et une chimio-
radiothérapie. Il n’y a pas non plus de différence majeure en termes de toxicité.
Le choix des deux stratégies repose donc sur le clinicien. Mais, une autre approche pourrait être de coupler les deux, en particulier pour ceux dont la régression après chimiothérapie n’est pas suffisante. Avec, entre chaque étape, une ré-évaluation chirurgicale.
En bref, cette étude a le mérite de reposer la CRT comme une approche validée en pré-opératoire, alors que la tendance actuelle est de privilégier la chimiothérapie. Les facteurs cliniques ou biologiques, devant faire préférer l’une à l’autre, restent à définir.
• Koerkamp BG et al. Neoadjuvant chemotherapy with FOLFIRINOX versus neoadjuvant gemcitabine based chemoradiotherapy for (borderline) resectable pancreatic cancer. Ann Oncol 2023 ; 34 : LBA83.
2. Versteijne E et al. Neoadjuvant chemoradiotherapy versus upfront surgery for resectable and borderline resectable pancreatic cancer: long-term results of the dutch randomized PREOPANC trial. J Clin Oncol 2022 ; 40 : 1220-30.
3. van Dam JL et al. Neoadjuvant therapy or upfront surgery for resectable and borderline resectable pancreatic cancer: A meta-analysis of randomised controlled trials. Eur J Cancer 2022 ; 160 : 140-9.
4. Conroy T et al. Five-year outcomes of FOLFIRINOX vs gemcitabine as adjuvant therapy for pancreatic cancer: a randomized clinical trial. JAMA Oncol 2022 ; 8 : 1571-8.
TOP 5 – Radiothérapie adjuvante ou différée précoce après prostatectomie radicale : résultats finaux de l’essai randomisé RADICALS RT
Il y a 3 ans étaient publiés trois essais randomisés (RADICALS RT, GETUG 17, RAVES) regroupés dans la méta-analyse ARTISTICS (5), comparant, après prostatectomie, une radiothérapie adjuvante (avec PSA indétectable) à une irradiation différée précoce, au moment où une récidive biologique est diagnostiquée. La conclusion était que les résultats étaient identiques quelle que soit la stratégie et que l’on pouvait donc attendre avant de proposer une irradiation, et ce, quels que soient les critères de gravité sur la pièce opératoire. Mais seul le contrôle biochimique était disponible à l’époque. Avec le recul, survie globale et survie sans métastase sont maintenant disponibles : les conclusions du plus important en nombre de ces trois essais ont-elles changé ?
L’étude RADICALS RT
Les critères d’inclusion étaient les patients opérés avec un PSA ≤ 0,2 ng/ml et un critère de mauvais pronostic (pT3/T4, Gleason 7-10, R1 ou PSA pré-opératoire ≥ 10 ng/ml).
Les patients étaient randomisés entre RT adjuvante ou différée précoce, en pratique, quand le PSA est > 0,1 ng/ml ou bien en augmentation sur trois dosages successifs.
La dose d’irradiation était soit de 66 Gy/33 fractions ou de 55 Gy/ 20 fractions.
Résultats
Mille trois cent quatre-vingt-seize patients ont été randomisés entre 2007 et 2016. Le suivi médian actuel est de 8 ans. Dans le bras différé précoce, 39 % des patients ont commencé la radiothérapie. Le taux de PSA médian au moment de la RT de rattrapage était de 0,2 ng/ml.
Les survies sans métastase à 10 ans sont de 93 % pour le bras adjuvant et de 90 % pour le bras différé précoce et les survies globales de 88 et 87 %, sans bien sûr de différence significative.
En revanche, on note plus de toxicités (incontinence urinaire ou fécale) dans le bras RT adjuvante.
À retenir
Avec un recul prolongé, les conclusions restent les mêmes : la radiothérapie adjuvante ne fait pas mieux qu’une radiothérapie différée précoce. Dans le bras RT adaptée au PSA, plus de 60 % des patients n’ont pas reçu de radiothérapie, ce qui explique la bien meilleure tolérance de ce bras.
Deux remarques cependant :
• un grand nombre de ces patients n’avaient pas de facteurs de risque de récidive importants : certaines publications laissent supposer que chez les patients T3b ou N1 une radiothérapie adjuvante reste indiquée (6) ;
• si une surveillance simple est décidée, en cas de risque élevé de récidive (par exemple, les patients pT3 R1), la surveillance du PSA doit être rapprochée pour ne pas passer à côté de la bonne fenêtre pour la radiothérapie : celle-ci est d’autant plus efficace que le PSA est bas, et au mieux en dessous de 0,5 ng/ml.
• Clarke N et al. Timing of radiotherapy (RT) after radical prostatectomy (RP): Final results of RADICALS RT randomised controlled trial. Ann Oncol 2023 ; 34 : 1764O.
5. Vale CL et al. Adjuvant or early salvage radiotherapy for the treatment of localised and locally advanced prostate cancer: a prospectively planned systematic review and meta-analysis of aggregate data. Lancet 2020 ; 396 : 1422-31.
6. Tilki D et al. Adjuvant versus early salvage radiation therapy for men at high risk for recurrence following radical prostatectomy for prostate cancer and the risk of death. J Clin Oncol 2021 ; 39 : 2284-93.
Christophe Hennequin déclare avoir des liens d’intérêt avec Amgen, Astellas, Bayer, Bouchara-Recordati, Ferring, Ipsen, Janssen, Lilly, Pfizer.