L’essentiel en un clin d’œil
Formidable congrès de l’ESMO en onco-urologie cette année avec la présentation de plusieurs études majeures qui viendront probablement changer nos pratiques dans les prochaines semaines.
• La très attendue étude EV-302 évaluant l’intérêt d’une combinaison enfortumab védotin et pembrolizumab (anti-PD-1) en comparaison à une chimiothérapie par sels de platine et gemcitabine chez les patients atteints d’un carcinome urothélial métastatique en situation de première ligne, avec des résultats sans commune mesure !
• L’étude CheckMate 901, deuxième blockbuster dans le carcinome urothélial métastatique lors de la même plénière, montrant pour la première fois un bénéfice significatif en survie globale en faveur d’un traitement par immunothérapie (nivolumab) en association avec une chimiothérapie par cisplatine et gemcitabine.
• L’étude PSMAfore, avec des résultats positifs en survie sans progression et en qualité de vie pouvant potentiellement nous amener à proposer le 177lutétium-PSMA à un stade plus précoce du cancer de la prostate métastatique résistant à la castration.
• L’étude de phase III THOR, déjà sous les feux de la rampe lors de l’ASCO de cette année, avec la présentation cette fois des données de la cohorte 2
(erdafitinib versus pembrolizumab) chez les patients atteints d’un carcinome urothélial métastatique avec une altération de FGFR2/3 et préalablement traités par un sel de platine.
• L’essai LITESPARK-005 s’intéressant à l’utilisation du belzutifan (en comparaison à l’évérolimus), un inhibiteur de HIF-2α, chez les patients atteints d’un carcinome rénal à cellules claires métastatique prétraités par au moins une immunothérapie et un inhibiteur de tyrosine kinase ciblant VEGF.
TOP 1 – EV-302/KEYNOTE-A39 : une nouvelle ère débute avec la combinaison enfortumab védotin et pembrolizumab en première ligne thérapeutique du carcinome urothélial métastatique !
Suite aux résultats positifs de l’étude de phase III EV-301, évaluant l’utilisation de l’enfortumab védotin en comparaison à une chimiothérapie conventionnelle (paclitaxel, docétaxel ou vinflunine) chez les patients atteints d’un carcinome urothélial métastatique et préalablement traités par une chimiothérapie à base de sels de platine et une immunothérapie (anti-PD-1/PD-L1), nous disposons désormais d’une nouvelle arme thérapeutique en situation de troisième ligne métastatique avec cet anticorps conjugué à un cytotoxique.
Les récentes données de l’étude EV-103 (cohorte K), s’intéressant cette fois à l’enfortumab védotin en association avec le pembrolizumab ou en monothérapie, chez des patients atteints d’un carcinome urothélial métastatique, non éligibles au cisplatine (avec un taux de réponse objective de 64,5 %, dont 10,5 % de réponse complète et une médiane de survie globale de 22,3 mois pour la combinaison), offraient des perspectives thérapeutiques prometteuses chez ces malades souvent fragiles.
C’est dans ce contexte que la très attendue étude EV-302 évaluait l’efficacité et la tolérance de l’enfortumab associée au pembrolizumab, cette fois-ci en situation de première ligne métastatique, en comparaison à un standard thérapeutique depuis plus de 30 ans par sels de platine et gemcitabine, avec des résultats au-delà de nos espérances et accueillis par une standing ovation !
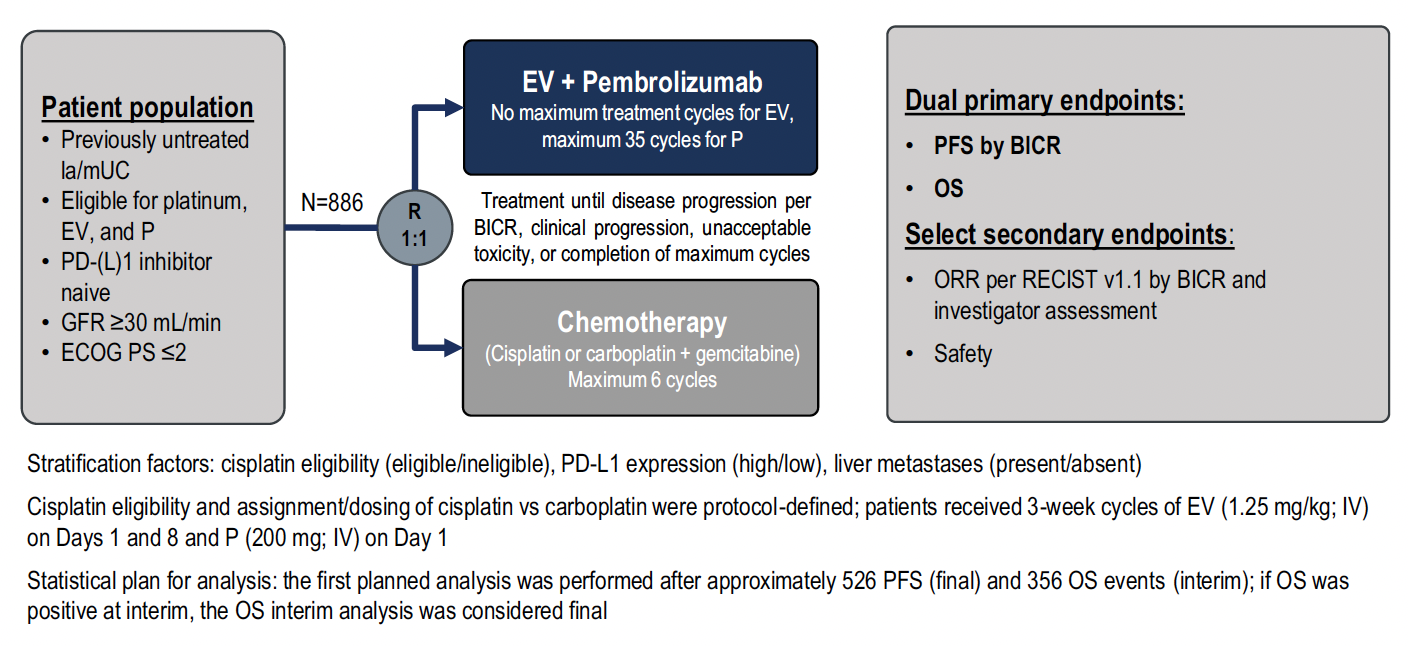
L’étude
Dans cette étude de phase III, les patients atteints d’un carcinome urothélial métastatique (n = 886) recevaient :
• soit un traitement par enfortumab védotin (jusqu’à progression ou toxicité) et pembrolizumab (pour une durée maximale de 2 ans),
• soit une chimiothérapie par cisplatine ou carboplatine et gemcitabine (avec six cycles au maximum) (Fig. 1).
Figure 1 – EV-302/KEYNOTE-A39 : schéma de l’étude.
Les résultats de l’étude JAVELIN-Bladder 100 n’étant pas encore connus à l’époque, un traitement de maintenance par avélumab n’était pas immédiatement proposé chez les patients sans progression de leur maladie au décours de la chimiothérapie par sels de platine. Toutefois, un amendement en cours d’inclusion a permis l’utilisation de cette immunothérapie chez une proportion restreinte de malades (environ 30 %).
Les caractéristiques des patients étaient homogènes et correspondaient au profil attendu avec 54 % de patients éligibles au cisplatine, 72 % de métastases viscérales et 58 % de tumeurs avec une sur-expression de PD-L1 (CPS ≥ 10).
Résultats
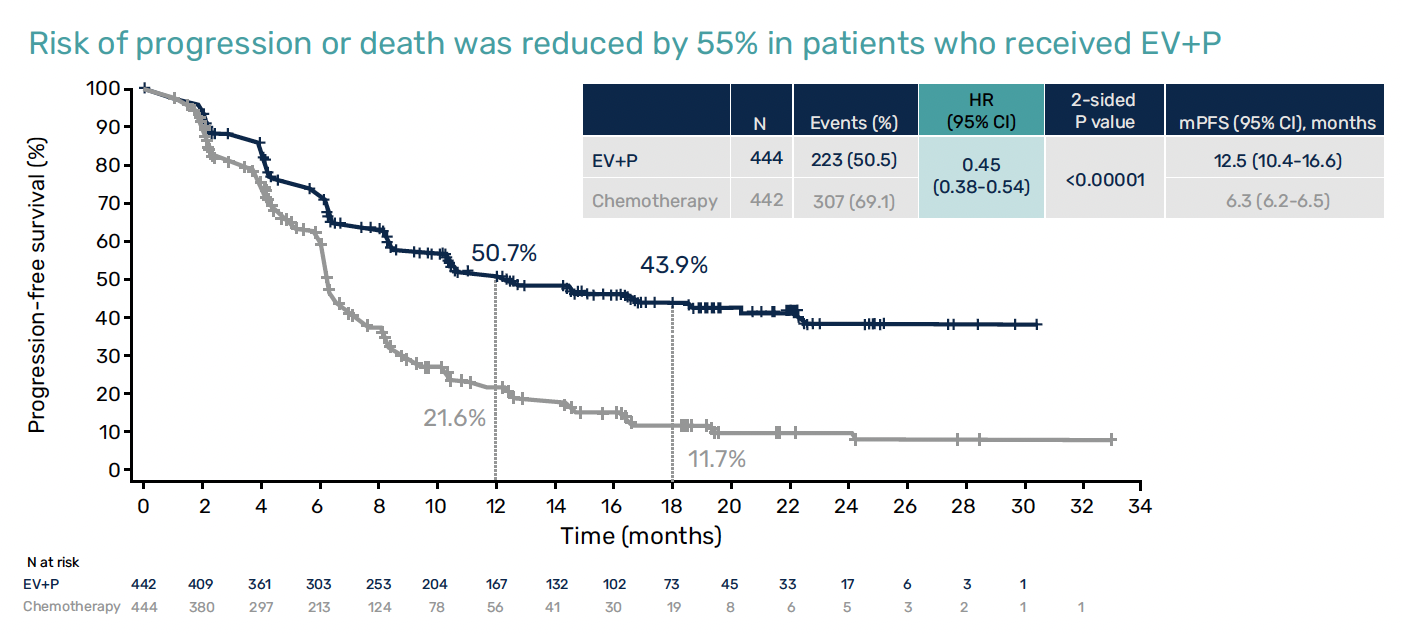
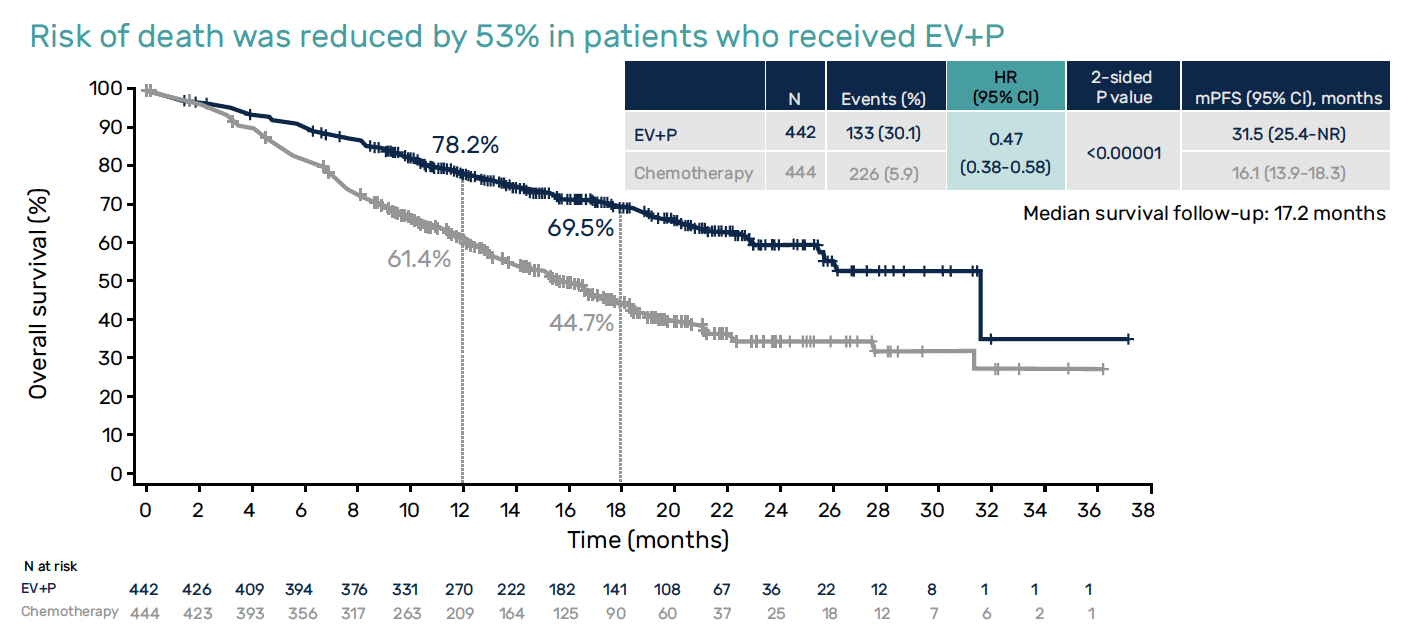
Après une médiane de suivi de 17,2 mois, les premières données sont spectaculairement en faveur de la combinaison (n = 442) devant :
• une diminution de 55 % du risque de progression de la maladie avec une médiane de survie sans progression (PFS) de 12,5 versus 6,3 mois (HR = 0,45 ; IC 95 % = 0,38-0,54 ; p < 0,00001),
• une survie globale (SG) quasiment doublée avec une médiane de SG de 31,5 versus 16,1 mois (HR = 0,47 ; IC 95 % = 0,38-0,58 ; p < 0,00001)
• et des taux de réponse objective de 67,7 % (dont 29 % de réponse complète !) versus 44,4 % (p < 0,00001) (Fig. 2 et 3).
Figure 2 – EV-302/KEYNOTE-A39 : données de survie sans progression.
Figure 3 – EV-302/KEYNOTE-A39 : données de survie globale.
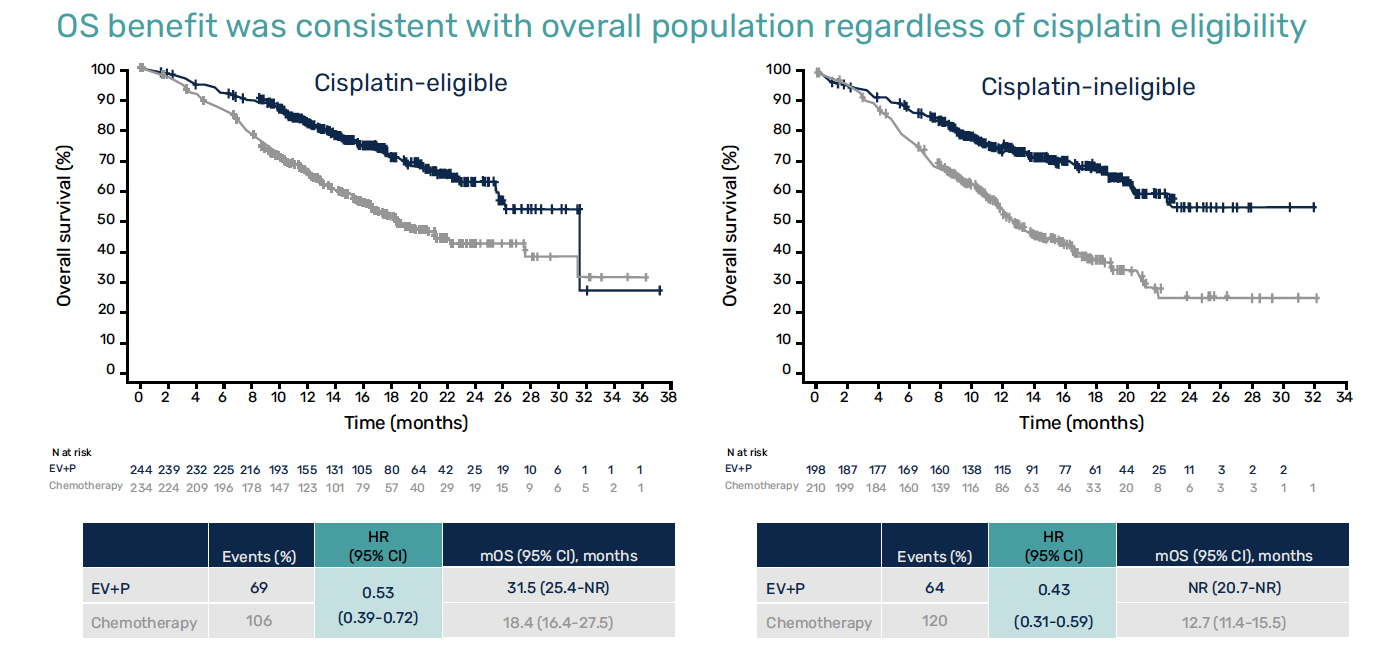
Ce bénéfice était confirmé indépendamment de l’éligibilité au cisplatine et du statut PD-L1, dans les analyses en sous-groupes (Fig. 4).
Figure 4 – EV-302/KEYNOTE-A39 : données de survie globale selon éligibilité du cisplatine.
La durée médiane de réponse n’était pas encore atteinte dans le bras enfortumab et pembrolizumab (versus 7 mois dans le bras chimiothérapie).
Tolérance
Concernant le profil de tolérance, il n’existait pas de nouveau signal en défaveur de l’association avec un taux d’événements indésirables liés au traitement de grade ≥ 3 de 55,9 % dans le bras enfortumab et pembrolizumab contre 69,5 % chez les patients sous chimiothérapie. Une attention toute particulière devra être apportée concernant la toxicité cutanée (15,5 % de réactions cutanées en lien avec l’enfortumab et 11,8 % avec le pembrolizumab) et la survenue d’une neuropathie périphérique (6,8 %) ou d’une hyperglycémie (6,1 %).
À retenir
Game changing donc ? L’amplitude du bénéfice de l’association enfortumab védotin et pembrolizumab, notamment en termes de survie globale, en fait naturellement le nouveau standard thérapeutique chez les patients atteints d’un carcinome urothélial en première ligne métastatique. Cette étude majeure soulève naturellement plusieurs questions.
• Comment extrapoler ces données en situation de première ligne, en sachant que le standard thérapeutique reste actuellement une chimiothérapie à base de sels de platine et gemcitabine (4 à 6 cycles) suivie d’un traitement de maintenance par avélumab chez les patients stables ou en réponse thérapeutique ? Dans l’étude EV-302, seulement 30 % des patients ont reçu un traitement de maintenance alors que 77 % y étaient théoriquement éligibles. De plus, nous n’avons pas connaissance de la proportion de malades ayant eu accès à l’enfortumab védotin dans les lignes ultérieures…
• Quelle sera désormais la séquence thérapeutique en situation de deuxième ligne ? Une chimiothérapie à base de sels de platine ou erdafitinib chez les patients porteurs d’une altération de FGFR2/3 ?
• Où pourraient désormais se positionner le sacituzumab govitécan et les autres anticorps conjugués à un cytotoxique ciblant HER2 ? En première ligne, avec une autre immunothérapie (TROPHY-U01) ? Un triplet avec enfortumab et pembrolizumab ? En deuxième ligne chez les patients non répondeurs ou avec une intolérance ?
• Quelle sera la réactivité de nos autorités compétentes afin d’offrir rapidement à nos malades cette avancée considérable (encore une plateforme d’accès précoce ?)
Le profil de tolérance méritera également une gestion attentive notamment chez les patients les plus fragiles.
Nous suivrons attentivement l’utilisation de cette combinaison en stratégie péri-opératoire chez les patients éligibles au cisplatine (KEYNOTE-B15/EV-304) ou non (KEYNOTE-905/EV-303) qui pourrait encore une fois changer la donne dans le carcinome urothélial.
• Powles T et al. EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). Ann Oncol 2023 ; 34 : LBA6.
TOP 2 – Nivolumab en association avec la chimiothérapie cisplatine et gemcitabine en premier traitement de première ligne du carcinome urothélial métastatique (CheckMate 901) : mention très honorable !
Jusqu’à présent, aucun essai thérapeutique randomisé de phase III n’a montré de bénéfice significatif en termes de survie globale en faveur d’un traitement par immunothérapie en première ligne du carcinome urothélial métastatique, qu’elle soit utilisée en association avec la chimiothérapie (pembrolizumab dans KEYNOTE-361, atézolizumab dans Imvigor-130) ou non (durvalumab ± trémélimumab dans Danube), prouvant qu’un démembrement moléculaire était indispensable dans ce cadre afin d’identifier des biomarqueurs pertinents.
C’est finalement en stratégie de maintenance thérapeutique que cette thérapie a su faire ses preuves, suite aux données de l’étude JAVELIN-Bladder 100, avec un bénéfice significatif en survie globale (21,4 versus 14,3 mois) et en survie sans progression (3,7 versus 2 mois) en faveur de l’avélumab (versus placebo) chez les patients atteints d’un carcinome urothélial métastatique en réponse après un traitement de première ligne à base de sels de platine, devenant le standard thérapeutique.
L’étude CheckMate 901 évaluant l’efficacité et la tolérance d’une association nivolumab avec une chimiothérapie cisplatine et gemcitabine (versus cisplatine et gemcitabine) pouvait théoriquement changer la donne. Les résultats pourtant positifs de cet essai thérapeutique ont souffert de la comparaison avec ceux de l’étude EV-302 présentés lors de la même plénière.
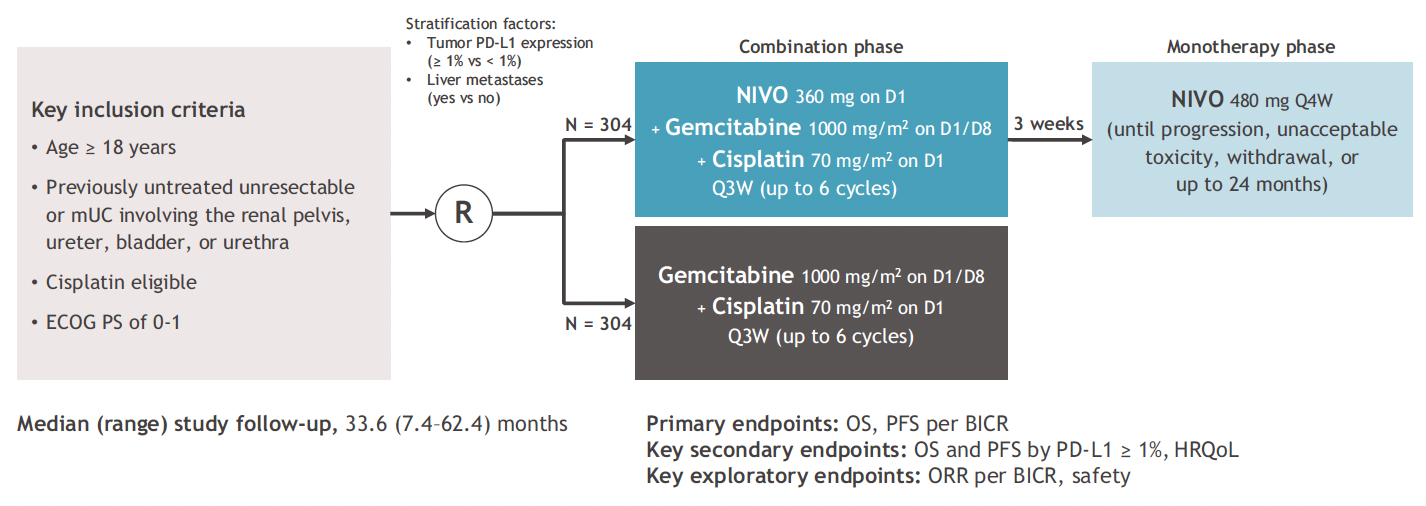
L’étude
Les patients inclus (n = 608) recevaient un traitement associant cisplatine-gemcitabine ± nivolumab 360 mg toutes les 3 semaines (pour six cycles au maximum) puis une immunothérapie (ou placebo) de maintenance toutes les 4 semaines, pour une durée maximale de 2 ans. Les critères de jugement principaux étaient la survie sans progression et la survie globale évaluées par un comité indépendant en aveugle (BICR) (Fig. 5).
Figure 5 – CheckMate-901 : schéma de l’étude.
Résultats
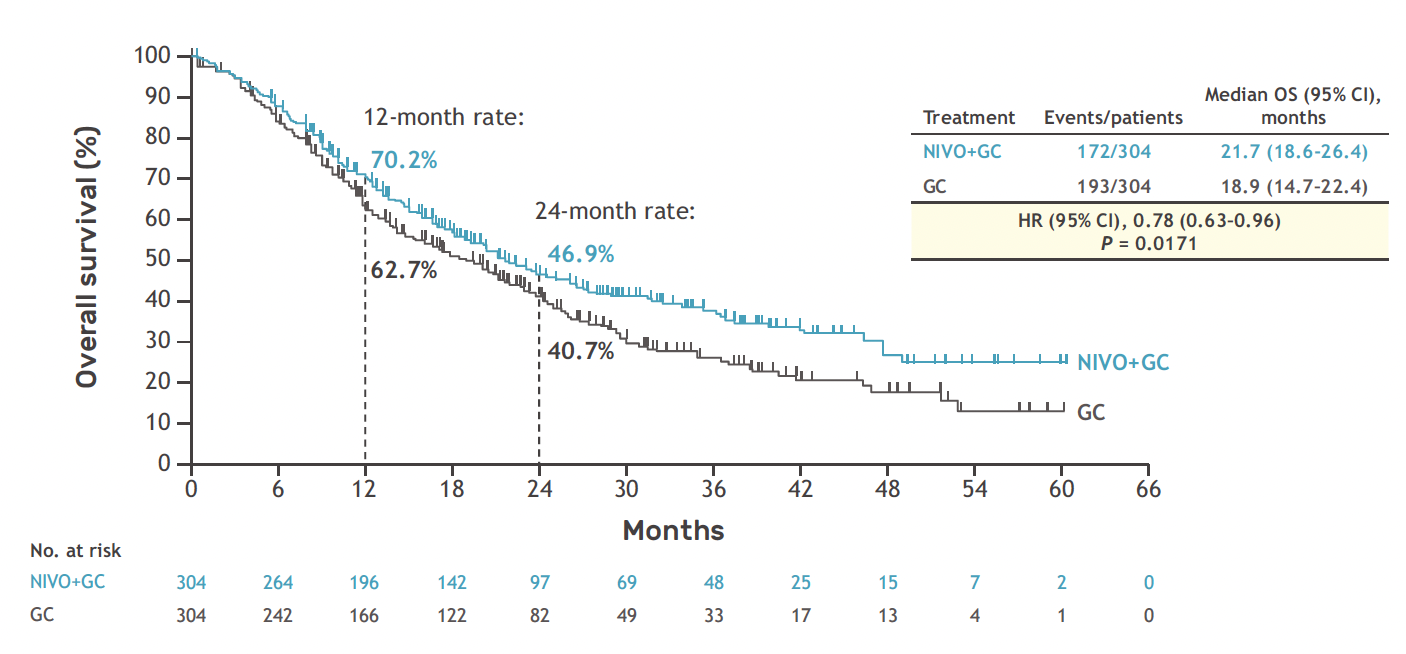
Après une médiane de suivi de 33,6 mois, les résultats sont en faveur de l’association nivolumab et chimiothérapie avec un bénéfice significatif :
• en survie globale devant une médiane de 21,7 versus 18,9 mois (HR = 0,78 ; IC 95 % = 0,63-0,96 ; p = 0,0171), dont 70,2 % de survie à 1 an (versus 62,7 %) et 46,9 % de survie à 2 ans (versus 40,7 %),
• en survie sans progression devant une médiane de 7,9 versus 7,6 mois (HR = 0,72 ; IC 95 % = 0,59-0,88 ; p = 0,0012), dont 34,2% de survie sans progression à 1 an (versus 21,8 %) et 9,6 % de survie sans progression à 2 ans (versus 9,6 %)
• et un taux de réponse objective de 57,6 % (versus 43,1 %), dont 21,7 % de réponse complète (versus 11,8 %) avec une durée de réponse de 9,5 versus 7,3 mois et une durée médiane de réponse complète de 37,1 versus 13,2 mois (Fig. 6).
Figure 6 – CheckMate-901 : données de survie globale.
Tolérance
Concernant le profil de tolérance, on notait un taux d’effets indésirables en lien avec le traitement de grade ≥ 3 plus important dans le bras chimiothérapie et nivolumab (61,8 versus 51,7 %).
À retenir
Pour la première fois, un essai thérapeutique de grande ampleur montre un bénéfice significatif en survie globale en faveur d’un traitement par immunothérapie en association avec la chimiothérapie standard. Ces données pouvaient théoriquement faire de cette combinaison un nouveau standard thérapeutique en première ligne métastatique. Elles restent contradictoires avec plusieurs autres essais pivots et doivent tenir compte des résultats de l’étude EV-302 avec une amplitude de bénéfice en survie globale beaucoup plus spectaculaire (et dont le bras standard incluait aussi des patients sous carboplatine et gemcitabine). CheckMate 901 a néanmoins le mérite de proposer une stratégie de maintenance avec une immunothérapie généralement bien tolérée, mais souffre forcément de la comparaison avec l’association enfortumab védotin et pembrolizumab.
• Van der Heijden M et al. Nivolumab plus gemcitabine-cisplatin versus gemcitabine-cisplatin alone for previously untreated unresectable or metastatic urothelial carcinoma: Results from the phase III CheckMate 901 trial. Ann Oncol 2023 ; 34 : LBA7.
TOP 3 – PSMAfore : la radiothérapie interne vectorisée au 177lutétium-PSMA remonte les lignes dans le cancer de la prostate métastatique !
Deux études pivots (VISION et TheraP) ont permis d’enrichir l’arsenal thérapeutique avec le 177Lu-PSMA-617 (disponible en France après traitement préalable par hormonothérapie de nouvelle génération et un taxane), ouvrant la voie à une médecine de précision dans le cancer de la prostate métastatique résistant à la castration (mCRPC), malgré de nombreuses contraintes administratives et difficultés d’accès inhérentes à cette thérapie.
Plusieurs essais thérapeutiques évaluant l’utilisation du 177Lu-PSMA-617 sont en cours, en association avec d’autres thérapies (avec une immunothérapie ou un inhibiteur de PARP par exemple) ou à un stade plus précoce de la maladie.
Les premiers résultats de l’étude de phase III PMSAfore ont été présentés lors de la dernière session présidentielle d’un congrès de l’ESMO réellement historique pour nos malades.
L’étude
Cet essai thérapeutique évaluait l’efficacité et la tolérance du 177Lu-PMSA (7,4 GBq toutes les 6 semaines avec six cycles au maximum) en comparaison avec un inhibiteur de la voie de signalisation des récepteurs aux androgènes, chez des patients naïfs de taxane et atteints d’un cancer de la prostate métastatique résistant à la castration. Les malades éligibles étaient candidats à un changement d’hormonothérapie de nouvelle génération (abiratérone ou enzalutamide) après une progression sous une NHT antérieure et présentaient ≥ une lésion surexprimant les récepteurs au PSMA et aucune lésion PSMA négative sous TEP/CT [68Ga] Ga-PSMA-11. Les patients randomisés dans le groupe hormonothérapie de nouvelle génération pouvaient recevoir une RIV au 177Lu-PSMA-617 dans le cadre d’un cross-over, après une progression radiographique (rPD) examinée de manière centralisée.
Résultats
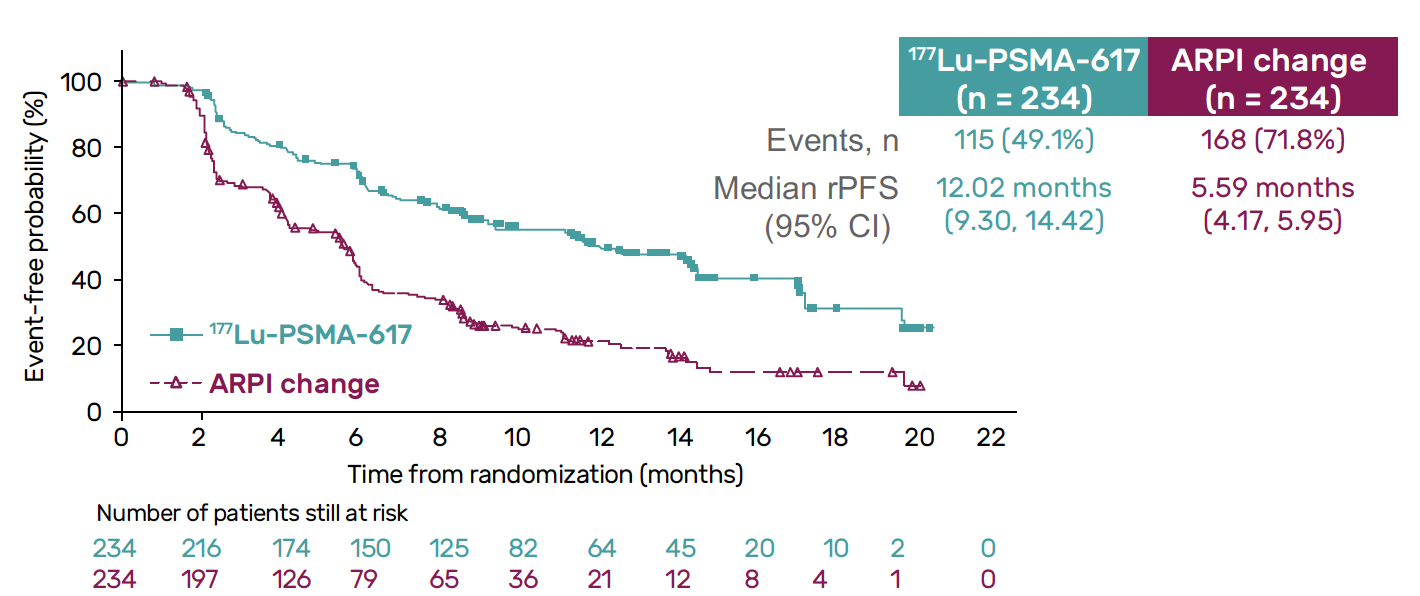
Après une médiane de suivi de 7,3 mois chez 468 patients randomisés, on notait une diminution significative du risque de progression radiographique de 59 % sur une première analyse intermédiaire en faveur du 177Lu-PMSA avec une médiane de 12 versus 5,6 mois (HR = 0,41 ; IC 95 % = 0,29-0,56 ; p < 0,0001), confirmée sur la deuxième analyse intermédiaire et un bénéfice en taux de réponse objective (41,9 versus 12,6 %) et en durée de réponse (17,1 versus 10,1 mois) (Fig. 7).
Figure 7 – PSMAfore : données de survie sans progression.
Il existait une tendance à l’amélioration de la survie globale en faveur du 177Lu-PSMA-617 dans les analyses statistiques ajustées sur le cross-over. Les patients sous RIV présentaient une meilleure qualité de vie selon le Functional Assessment of Cancer Therapy-Prostate (FACT-P) avec un délai médian de détérioration de 7,4 contre 4,1 mois.
Tolérance
Le taux d’événements indésirables de grade ≥ 3 était de 34 % (les plus fréquents : anémie, sécheresse buccale) versus 44 % (dont 20 versus 28 % d’effets indésirables graves), conduisant à un arrêt chez 5,7 versus 5,2 % des patients.
À retenir
Les résultats positifs en survie sans progression et en qualité de vie de PSMAfore peuvent potentiellement changer nos pratiques et nous amener à proposer le 177Lu-PSMA à un stade plus précoce de la maladie, en dépit d’une tendance à l’amélioration non significative de la survie globale (pouvant aussi s’expliquer par un cross-over).
Cependant, on peut s’interroger sur la faiblesse du bras comparateur (84 % de patients bénéficiant d’un cross-over !) en situation de première ligne mCRPC où il est recommandé d’utiliser un traitement par docétaxel. Le 177LuPMSA semble être une alternative intéressante à la chimiothérapie avec un profil de tolérance favorable. Des études avec une thérapie par radio-ligand sont en cours au stade métastatique hormonosensible (PSMAddition) ou en stratégie d’intensification thérapeutique chez les patients ne répondant pas suffisamment à un traitement standard (PEACE-6 Poor Responders).
• Sartor O et al. Phase III trial of [177Lu]Lu-PSMA-617 in taxane-naive patients with metastatic castration-resistant prostate cancer (PSMAfore). Ann Oncol 2023 ; 34 : LBA13.
TOP 4 – Erdafitinib versus pembrolizumab chez les patients atteints d’un carcinome urothélial métastatique avec une altération de FGFR2/3 et préalablement traités par un sel de platine : à “THOR” ou à raison ?
À l’instar du cancer de la prostate avec les mutations de BRCA1 et BRCA2, les dernières avancées de la biologie moléculaire ont également permis un démembrement du carcinome urothélial métastatique avec la mise en évidence d’un sous-groupe d’intérêt dans les tumeurs présentant une altération d’un gène de FGFR (Fibroblast Growth Factor Receptors) chez environ 15 à 20 % des patients. La découverte de ce driver oncogénique et la fréquence non négligeable d’une anomalie moléculaire en font donc un candidat naturel pour une thérapie ciblée, grâce à l’utilisation d’inhibiteurs de FGFR évalués dans plusieurs essais thérapeutiques, comme l’erdafitinib.
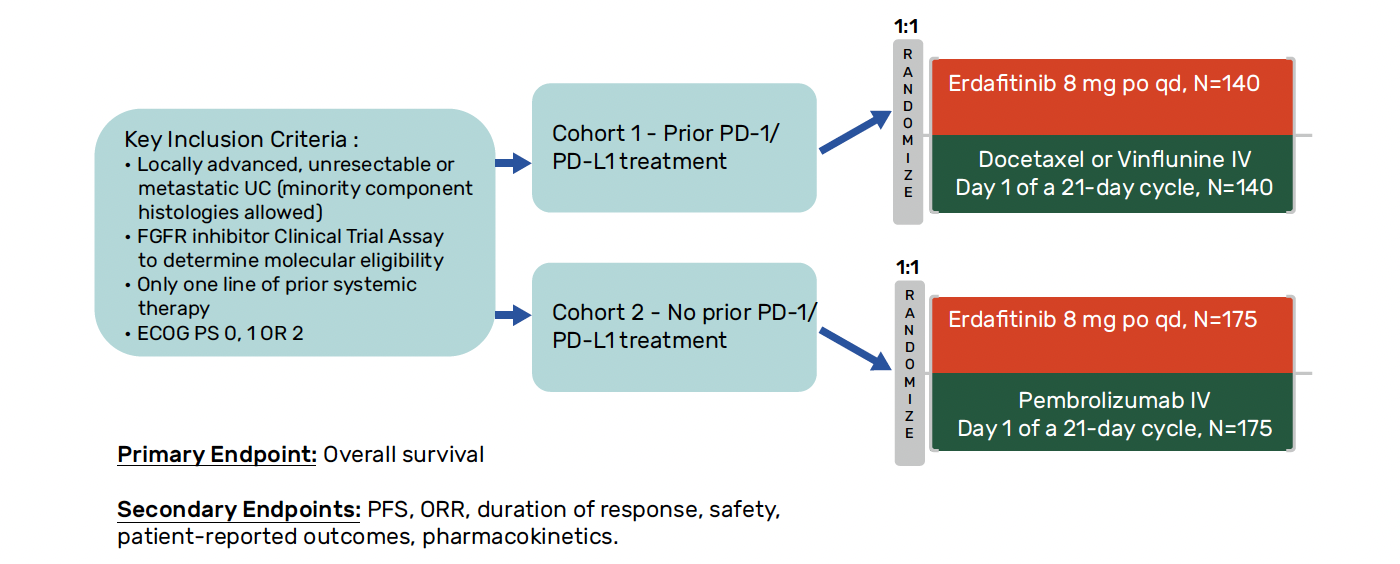
L’étude
Les premiers résultats de l’étude de phase III THOR ont été présentés à l’ASCO cette année chez des patients atteints d’un carcinome urothélial métastatique et d’une altération du FGFR2/3, préalablement traités par chimiothérapie à base de platine et un anti-PD-1/PD-L1 (cohorte 1) avec un bénéfice significatif de survie globale en faveur de l’erdafitinib (12,1 mois) par rapport à la chimiothérapie (vinflunine ou docétaxel) (7,8 mois) (HR = 0,64 ; IC 95 % = 0,47-0,88 ; p = 0,005). Il existait également une amélioration significative de la survie sans progression (5,6 versus 2,7 mois avec HR = 0,58 ; IC 95 % = 0,44-0,78 ; p = 0,0002) et du taux de réponse objective (45,6 versus 11,5 %) en faveur de l’inhibiteur de tyrosine kinase.
Les analyses en sous-groupe ne rapportaient pas de différence en fonction du type d’altération de FGRF, du nombre et du type de chimiothérapie reçue ou de la présence de métastases viscérales. Cette fois, les données de la cohorte 2 (erdafitinib versus pembrolizumab) avec des patients traités uniquement par chimiothérapie à base de platine ont été rapportées à l’ESMO (Fig. 8).
Figure 8 – THOR : schéma de l’étude.
Résultats
Après un suivi médian de 33,2 mois chez 351 patients inclus, il n’a pas été constaté de bénéfice significatif en termes de survie globale chez les malades traités par erdafitinib (n = 175) par rapport au pembrolizumab (n = 176) (10,9 versus 11,1 mois ; HR = 1,18 ; IC 95 % = 0,92-1,5 ; p = 0,18). Les analyses en sous-groupe ne rapportaient pas de différence en fonction du type d’altération de FGRF, de la présence de métastases viscérales ou du statut PD-L1. Il existait une tendance à l’amélioration non significative de la survie sans progression (4,4 contre 2,7 mois).
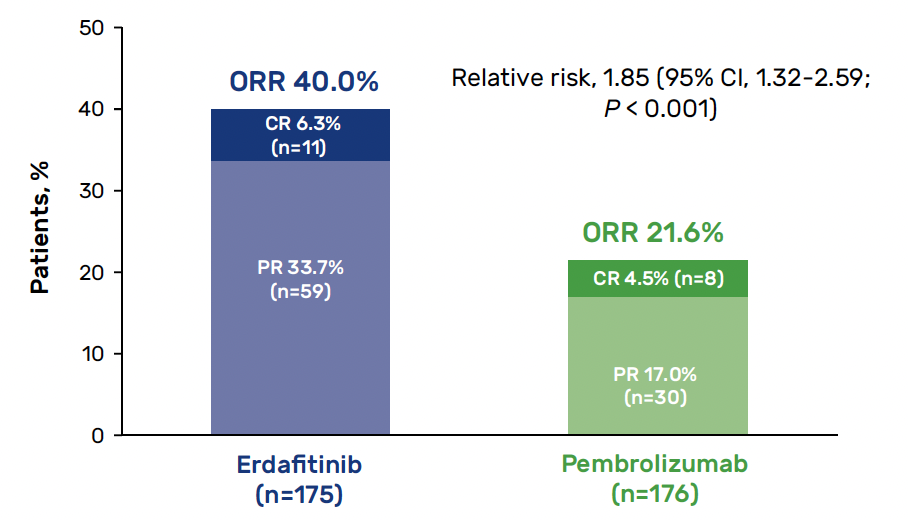
En revanche, le taux de réponse objective était plutôt en faveur de l’inhibiteur de tyrosine kinase (40 contre 21,6 %) avec une durée de réponse plus courte chez les patients traités par erdafitinib (4,3 contre 14,4 mois) (Fig. 9).
Figure 9 – THOR : taux de réponse objective (cohorte 2).
Tolérance
Concernant le profil de tolérance, on notait un taux de toxicité de grade ≥ 3 plus élevé avec l’erdafitinib (43 versus 12 %) et un taux d’arrêt du traitement plus important (15 versus 5 %). Les effets secondaires mentionnés en lien avec l’inhibiteur de tyrosine kinase étaient essentiellement une hyperphosphatémie (72,8 %), une stomatite (45,1 %), des diarrhées (44,5 %), une sécheresse buccale (35,3 %), un syndrome mains-pieds ou une toxicité unguéale. Il existait un signal particulier concernant la survenue de rétinopathie séreuse centrale dans le bras erdafitinib (22,5 % tous grades et 1,2 % de grade 3-4).
À retenir
Les résultats de la cohorte 2 de l’étude THOR sont plutôt décevants, mais confortent la place du pembrolizumab en situation de deuxième ligne chez les patients présentant une altération du FGFR, préalablement traités par une chimiothérapie à base de platine (sans entretien par avélumab) et avec un profil de tolérance bien meilleur. L’erdafinib, disponible actuellement dans le cadre d’un accès précoce, peut être envisagé dès la troisième ligne pour les patients ayant un état général correct. Il restera bien sûr à préciser son positionnement par rapport à l’enfortumab védotin et les potentiels autres anticorps conjugués à un cytotoxique.
• Siefker-Radtke A et al. Phase III THOR study: Results of erdafitinib (erda) vs pembrolizumab (pembro) in pretreated patients (pts) with advanced or metastatic urothelial cancer (muc) with select fibroblast growth factor receptor alterations (FGFRalt). Ann Oncol 2023 ; 34 : 2359O.
TOP 5 – Le belzutifan, un nouvel atout dans le carcinome rénal à cellules claires ? Résultats de l’étude de phase III LITESPARK-005
L’amélioration de la prise en charge thérapeutique du carcinome rénal avec les associations d’immunothérapies et d’inhibiteurs de tyrosine kinase a paradoxalement créé un vide en situation de deuxième ligne métastatique avec un besoin impérieux de nouvelles ressources thérapeutiques. Plusieurs approches semblent prometteuses avec notamment le belzutifan qui a fait l’objet de plusieurs présentations cette année.
Le rôle central de la voie VHL/HIF-VEGF est bien établi dans le processus de cancérogenèse du carcinome rénal et a contribué à l’utilisation des inhibiteurs de tyrosine kinase ciblant VEGFR. Une autre cible potentielle concerne la protéine HIF-2α (hypoxia-inductible factor-2α), un facteur de transcription naturellement surexprimé en situation d’hypoxie conduisant à l’angiogenèse. Le belzutifan est un inhibiteur sélectif HIF-2α qui bloque l’hétéro-dimérisation de HIF-2α avec HIF-1β, stoppant l’activation des gènes impliqués dans la carcinogenèse. Cette thérapie est déjà approuvée chez les patients atteints d’une maladie de VHL associée à un carcinome rénal, un hémangioblastome du système nerveux central ou à des tumeurs neuroendocrines pancréatiques.
L’étude
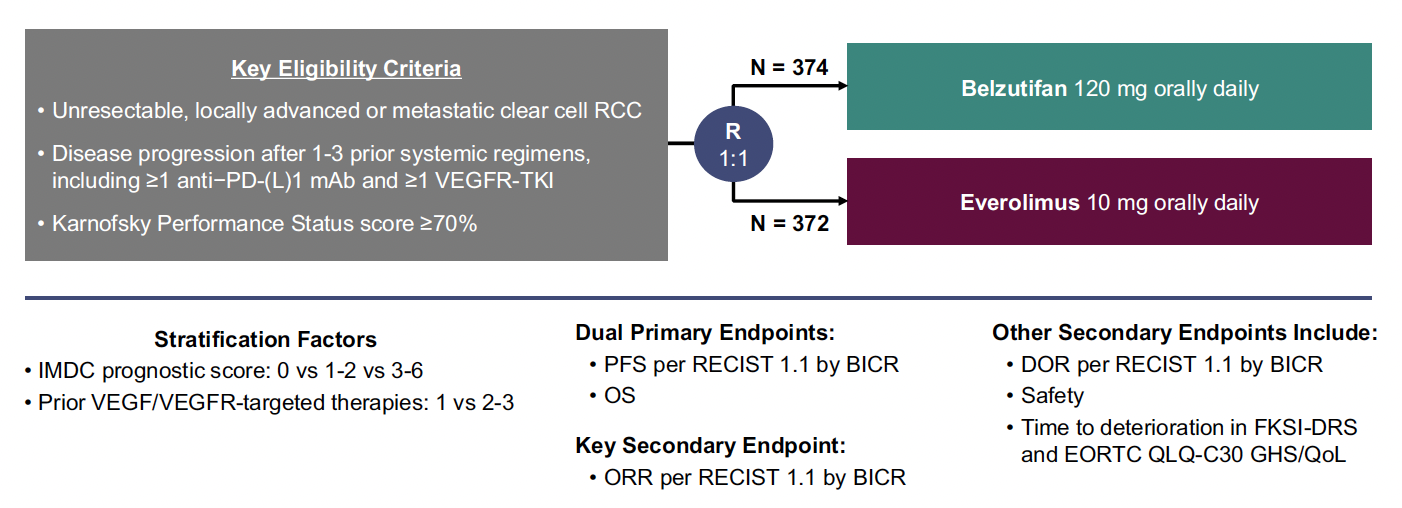
Les premières données de l’étude LITESPARK-005 ont été présentées, évoluant entre le belzutifan et l’évérolimus dans le carcinome rénal à cellules claires métastatique prétraité (une à trois lignes thérapeutiques systémiques antérieures incluant un anti-PD-1/L1 et un inhibiteur de tyrosine kinase) (Fig. 10).
Figure 10 – LITESPARK-005 : schéma de l’étude.
Résultats
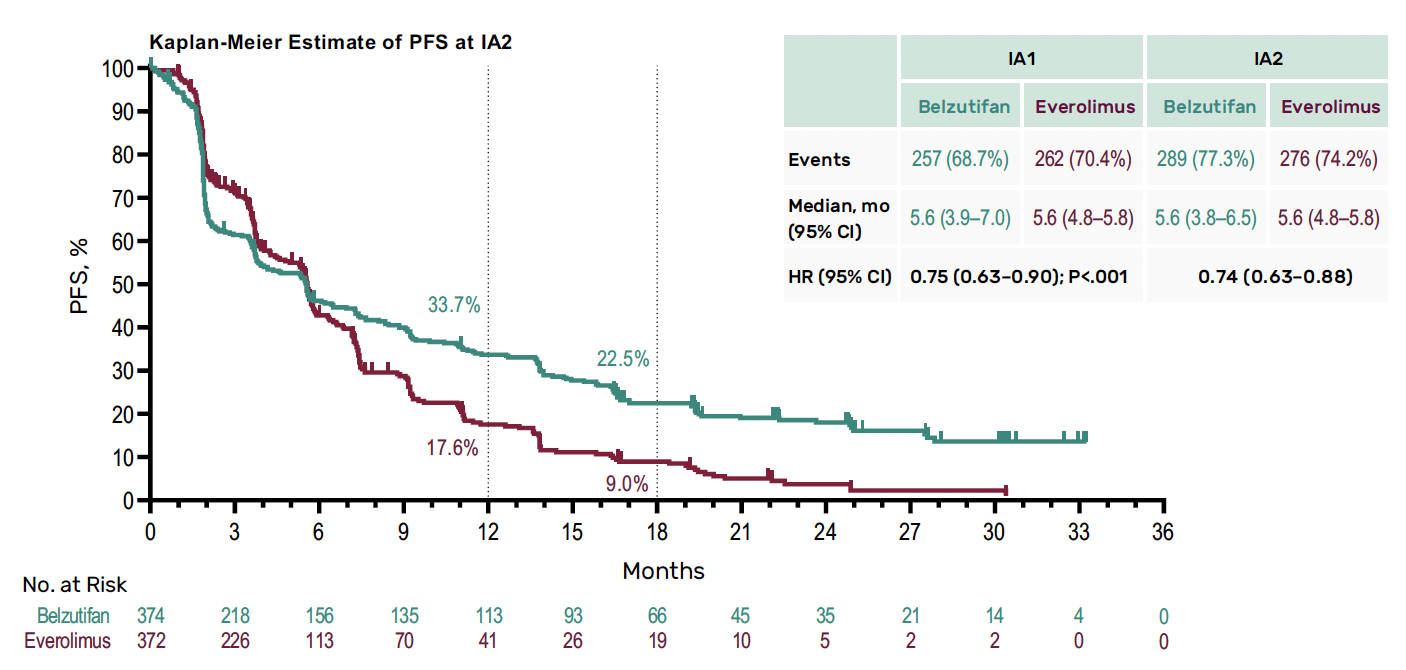
Après un suivi médian de 18,4 mois (première analyse intermédiaire) et de 25,7 mois (deuxième analyse intermédiaire), dans une population lourdement prétraitée (45 % des patients avaient déjà reçu trois lignes de traitement), le belzutifan a montré un bénéfice significatif en survie sans progression, avec à 12 mois 33,7 contre 17,6 % et à 18 mois 22,5 contre 9,0 % (Fig. 11).
Figure 11 – LITESPARK-005 : données de survie sans progression.
Le taux de réponse objective est également amélioré comparativement à l’évérolimus (23 versus 4 %) avec des réponses complètes observées chez 13 patients (3,5 %). Le délai médian de réponse objective était de moins de 4 mois avec une médiane de durée de réponse de plus de 19 mois. L’analyse de la survie globale n’était pas encore mature avec une absence d’amélioration significative pour le moment (21,4 contre 18,1 mois lors de la deuxième analyse intermédiaire ; HR = 0,88 ; IC 95 % = 0,73-1,07).
Tolérance
La tolérance du traitement était plutôt correcte avec un taux d’effets secondaires de grade ≥ 3 de 38,7 % (versus 39,4 %), avec notamment de nouvelles toxicités, spécifiques de classe, comme l’anémie par action du belzutifan sur la sécrétion d’EPO ou l’hypoxie.
À retenir
Peut-on considérer le belzutifan comme un standard thérapeutique potentiel dans le carcinome rénal à cellules claires préalablement traité par immunothérapie et TKI ? Les résultats de l’étude LITESPARK-005 sont quelque peu décevants, car l’amélioration de la survie globale doit rester l’objectif à atteindre en situation métastatique avancée, même si la durée de réponse prolongée et le maintien de la qualité sous belzutifan peuvent plaider pour une utilisation chez des patients lourdement prétraités. Plusieurs études randomisées de phase III sont attendues en situation adjuvante (LITESPARK-022), de première ligne métastatique avec le pembrolizumab et lenvatinib (LITESPARK-012) ou à une phase plus avancée de la maladie en association avec le lenvatinib (LITESPARK-011).
• Albiges L et al. Belzutifan versus everolimus in participants (pts) with previously treated advanced clear cell renal cell carcinoma (ccRCC): Randomized open-label phase III LITESPARK-005 study. Ann Oncol 2023 ; 34 : LBA88.
Benjamin Auberger déclare avoir des liens d’intérêt avec BMS, Sanofi, Ipsen, Janssen, Pfizer, Bayer, Novartis et AstraZeneca.