La prise en charge des cancers évolue constamment et les standards de traitement des cancers de l’œsophage ont été transformés ces dernières années vers une médecine plus personnalisée, que ce soit au stade localisé ou métastatique. Dans les cancers localisés, une approche fondée sur l’histologie, avec radiothérapie pour les carcinomes épidermoïdes et une approche systémique pour les adénocarcinomes est préconisée. L’immunothérapie est largement utilisée ainsi que d’autres thérapies ciblées. Cet article fait le point sur les standards actuels.
Résumé
Le traitement des cancers de l’œsophage a récemment été transformé. Si la radio-chimiothérapie néoadjuvante a encore toute sa place dans le traitement des carcinomes épidermoïdes de l’œsophage localement avancés, suivie après chirurgie d’une immunothérapie en cas de reliquat tumoral, son utilisation dans les adénocarcinomes peut maintenant être considérée comme sous-optimale. Il faut à présent privilégier une prise en charge semblable au cancer de l’estomac avec une chimiothérapie péri-opératoire.
Le traitement des cancers récidivants ou métastatiques associe une chimiothérapie à base de platines et de fluoropyrimidine, avec, le plus souvent, une immunothérapie selon l’histologie et le taux d’expression du PD-L1. Les thérapies ciblées ont bien sûr également leur place selon l’expression de certains marqueurs, le trastuzumab dans les adénocarcinomes HER2+ ou encore le zolbétuximab pour les CLD18.2+.
Abstract
Esophageal cancer: Standards of care for locally advanced and metastatic stages
The treatment of esophageal cancers has recently undergone a transformation. If neoadjuvant radio-chemotherapy still has its place in the treatment of locally advanced squamous cell carcinomas of the esophagus followed after surgery by immunotherapy in the cases of tumor remnant, its use in adenocarcinoma can now be considered suboptimal, and management similar to that used for gastric cancer with perioperative chemotherapy should now be prioritized. The treatment of recurrent or metastatic cancers combines platinum- and fluoropyrimidine-based chemotherapy, most often with immunotherapy depending on the histology and PDL1 expression level. Targeted therapies also have their place, depending on the expression of certain markers, such as Trastuzumab for HER2-positive adenocarcinomas and Zolbetuximab for CLD18.2-positive cancers.
Rappels, épidémiologie
Le cancer de l’œsophage est actuellement le 11e cancer mondial en termes d’incidence et le 7e en termes de décès (d’après le rapport GLOBOSCAN du GCO de 2022). Deux types histologiques sont responsables de la majorité des cancers de l’œsophage : le carcinome épidermoïde et l’adénocarcinome, qui sont totalement différents d’un point de vue épidémiologique, pronostique et théranostique. Dans les pays occidentaux, l’incidence des carcinomes épidermoïdes, surtout au tiers moyen et supérieur de l’œsophage, liés essentiellement au tabac et à l’alcool, diminue alors que celle des adénocarcinomes du tiers inférieur de l’œsophage augmente, en lien avec l’évolution des modes de vie (obésité, sédentarité, reflux gastro-œsophagien responsable d’endobrachyœsophage). Sur le plan des biomarqueurs, le PD-L1 est largement exprimé, et, à l’instar des cancers gastriques, 10 à 20 % des adénocarcinomes surexpriment HER2 (score 3+), mais aussi d’autres biomarqueurs qui peuvent être la cible de traitements comme la claudine 18.2 ou FGFR2b.
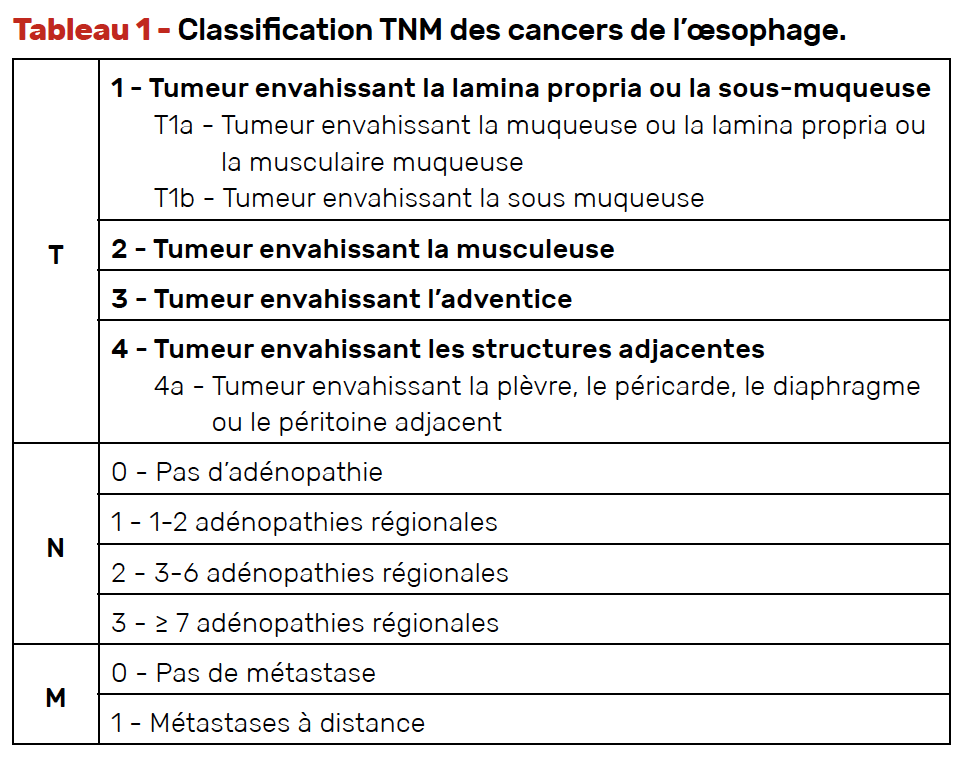
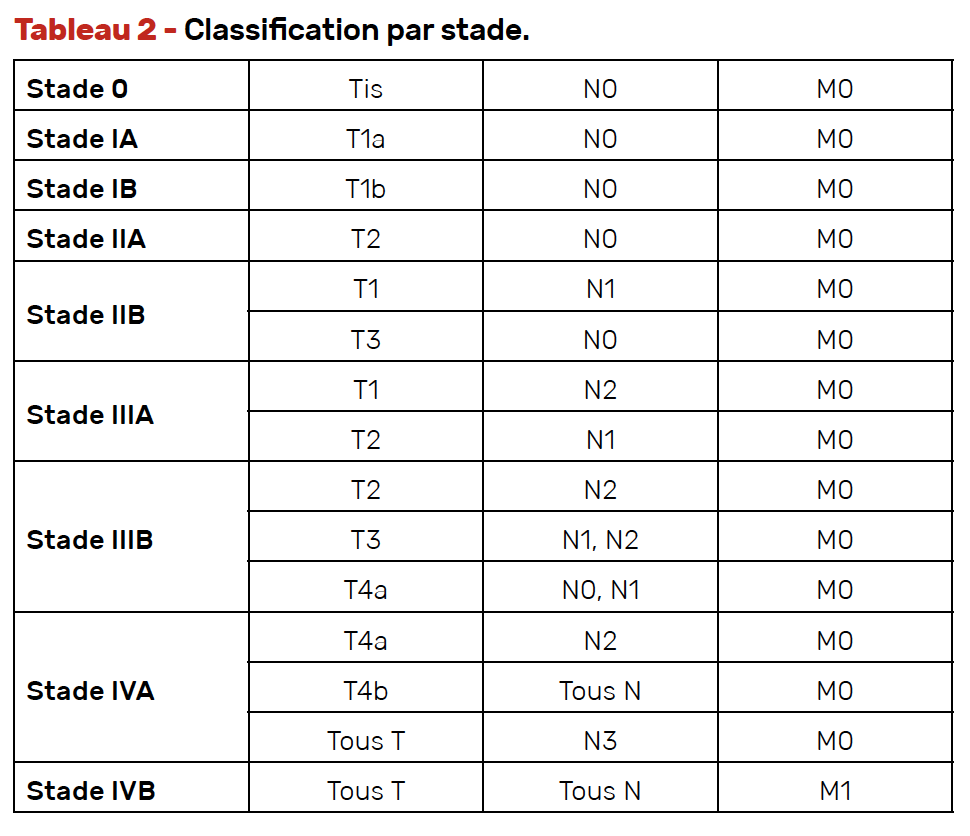
Les tableaux 1 et 2 rappellent la classification des cancers de l’œsophage.
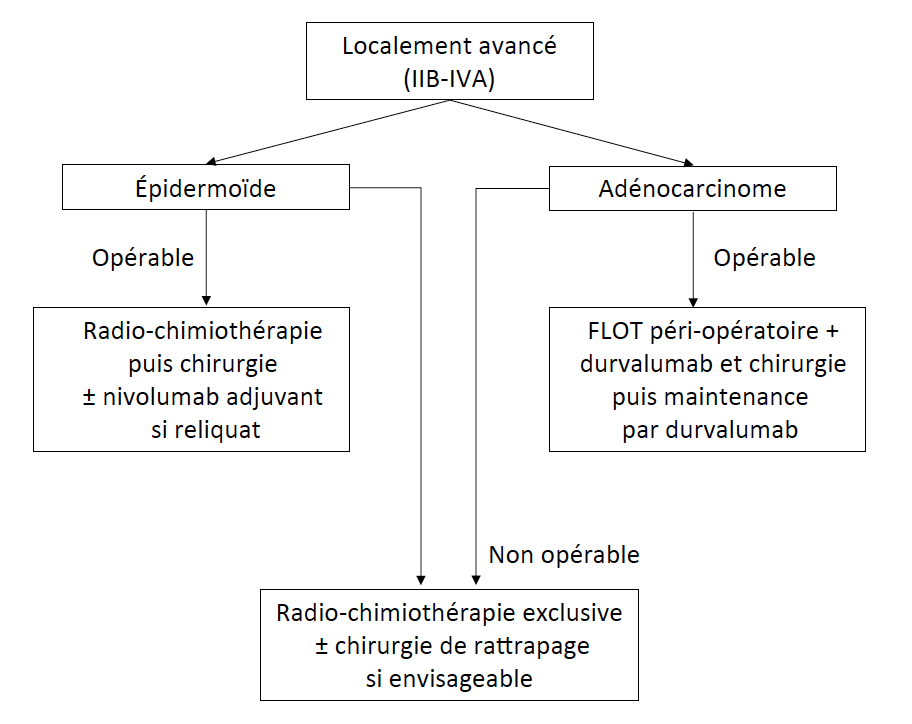
Prise en charge des cancers localement avancés (Fig. 1)
Figure 1 – Arbre décisionnel pour le cancer de l’œsophage localement avancé (IIB-IVA).
Les stades 1, bien que rares, sont traités préférentiellement par voie endoscopique (mucosectomie ou dissection sous-muqueuse), voire chirurgicalement.
Les cancers localement avancés
(≥ stade II) nécessitent un traitement multimodal.
La première étape, cruciale, est d’évaluer l’extension locorégionale pour évaluer la résécabilité de la tumeur, mais aussi l’état général du patient pour juger s’il est opérable et éligible à un traitement néoadjuvant.
Pour les carcinomes épidermoïdes
• L’essai CROSS a validé la radio-chimiothérapie néoadjuvante en tant que standard de traitement. Les patients recevaient cinq cycles hebdomadaires de carboplatine AUC2 et de paclitaxel à 50 mg/m2 en potentialisation avec une radiothérapie délivrant 41 à 45 Gy et étaient ensuite opérés. La survie à 10 ans était de 46 % (IC 95 % : 33-64) contre 23 % (IC 95 % : 13-40) en cas de chirurgie seule (1).
• L’étude Checkmate-577 a montré, en l’absence de réponse histologique complète après radio-chimiothérapie, qu’un traitement adjuvant par nivolumab pendant 1 an, quelle que soit l’expression de PD-L1, améliore la survie sans progression (SSP) à 29 mois (IC 95 % : 14,4-NA) contre 11 mois (IC 95 % : 7,6-17,8) (2).
• En cas de lésions inopérables après ce traitement néoadjuvant, la radio-chimiothérapie exclusive reste l’option à privilégier et est poursuivie jusqu’à 50 Gy.
Pour les adénocarcinomes
Les standards “historiques”
Pendant de nombreuses années, le choix de traitement des adénocarcinomes localement avancés a pu se faire selon deux modalités : la radio-chimiothérapie néoadjuvante ou la chimiothérapie péri-opératoire.
• En effet, l’essai CROSS a imposé également dans l’adénocarcinome la radio-chimiothérapie en traitement néoadjuvant.
• La chimiothérapie péri-opératoire était aussi une option et l’association la plus pertinente semble être la modalité par FLOT, consistant en quatre cycles avant et après la chirurgie, associant une chimiothérapie intraveineuse par fluorouracile à la dose de 2 600 mg/m2, leucovorine à 200 mg/m2, oxaliplatine à 85 mg/m2 et docétaxel à 50 mg/m2 toutes les 2 semaines. Cette association avait d’ailleurs montré sa supériorité en comparaison à d’autres molécules, comme dans l’étude FLOT4 qui étudiait l’association épirubicine, cisplatine et 5-FU (4).
Des études ont cherché à comparer les deux approches (radio-chimiothérapie versus chimiothérapie opératoire), comme l’essai NEO-AEGIS qui ne montrait alors pas de différence significative entre les deux modalités, en notant un manque de puissance et un arrêt précoce de l’essai dû au Covid-19 (5).
Supériorité de la chimiothérapie péri-opératoire par FLOT
Depuis l’ASCO 2024, l’approche dans les adénocarcinomes localement avancés a connu un tournant puisque la chimiothérapie péri-opératoire par FLOT a montré sa supériorité face à l’autre standard (la radio-chimiothérapie selon CROSS) et a conclu ainsi à une prise en charge proche des standards connus dans les cancers gastriques.
• En effet, les résultats de l’essai randomisé de phase III ESOPEC ont montré la supériorité de ce schéma. La survie globale (SG) à 3 ans était significativement augmentée à 57,4 % (IC 95 % : 50,1-64,0) pour le groupe FLOT contre 50,7 % (IC 95 % : 43,5-57,5) pour la radio-chimiothérapie par CROSS, le standard jusqu’ici (HR = 0,7 ; IC 95 % : 0,53-0,92) (6). La médiane de survie est presque doublée grâce au FLOT, passant de 37 à 66 mois.
• Le bénéfice du nivolumab adjuvant en cas de reliquat tumoral après radio-chimiothérapie, qui est plus modeste avec les adénocarcinomes (SSP de 19,4 mois (IC 95 % : 15,9-29,4) contre 11,1 mois (IC 95 % : 8,3-16,8)), ne permet pas de proposer une radio-chimiothérapie plutôt que du FLOT dans ces adénocarcinomes.
• L’essai TOPGEAR montre qu’une radiothérapie (45 Gy en 25 fractions) en pré-chirurgie avec le FLOT n’apporte aucun bénéfice en SG (7) et elle doit donc être définitivement abandonnée dans l’adénocarcinome œsophagien résécable.
Intérêt de l’immunothérapie
Plusieurs essais ont également cherché à étudier l’intérêt d’ajouter l’immunothérapie au schéma par FLOT.
• L’essai MATTERHORN (8), présenté à l’ASCO en 2025 et publié dans le New England Journal of Medicine, est la première étude démontrant un gain en survie sans événement (SSE) et en réponse pathologique complète, avec l’utilisation du durvalumab. Le bras expérimental de cette étude ajoutait donc au standard par FLOT le durvalumab 1 500 mg toutes les 4 semaines avec deux cycles avant et deux cycles après la chirurgie, puis à poursuivre pendant 10 mois en maintenance. Sur la SSE à 2 ans, on retrouve un HR à 0,71 (IC 95 % : 0,58-0,86 ; p < 0,001) en faveur du groupe avec l’immunothérapie. La réponse pathologique complète était également bien meilleure dans ce groupe : 19,2 versus 7,2 % (donc près de trois fois plus !). Ces résultats n’étaient pas au détriment d’une augmentation d’événements indésirables (grades 3 et 4 rapportés) puisque cela concernait un peu plus de 70 % de chacun des deux groupes.
Le standard actuel est donc une radio-chimiothérapie avec carboplatine et paclitaxel hebdomadaires suivie d’une chirurgie puis du nivolumab en cas de reliquat tumoral dans le carcinome épidermoïde, et le FLOT péri-opératoire (en association au durvalumab tout récemment) dans l’adénocarcinome.
Réflexion – À l’instar des adénocarcinomes, la radiothérapie va-t-elle disparaître ?
Une étude japonaise à trois bras suggère qu’une chimiothérapie néoadjuvante par trois TPF (cisplatine et docétaxel à 70 mg/m² à J1, 5-FU 750 mg/m²/j de J1 à J5) suivis de chirurgie pourrait être supérieure en SG par rapport à une radio-chimiothérapie avec deux cycles de cisplatine/5-FU suivie de chirurgie avec un HR à 0,80 (IC 95 % : 0,59-1,10) (3). Toutefois, la comparaison directe n’était pas planifiée au préalable et correspond à une analyse post-hoc, ne permettant pas de conclusion définitive, d’autant plus que la différence n’est pas significative.
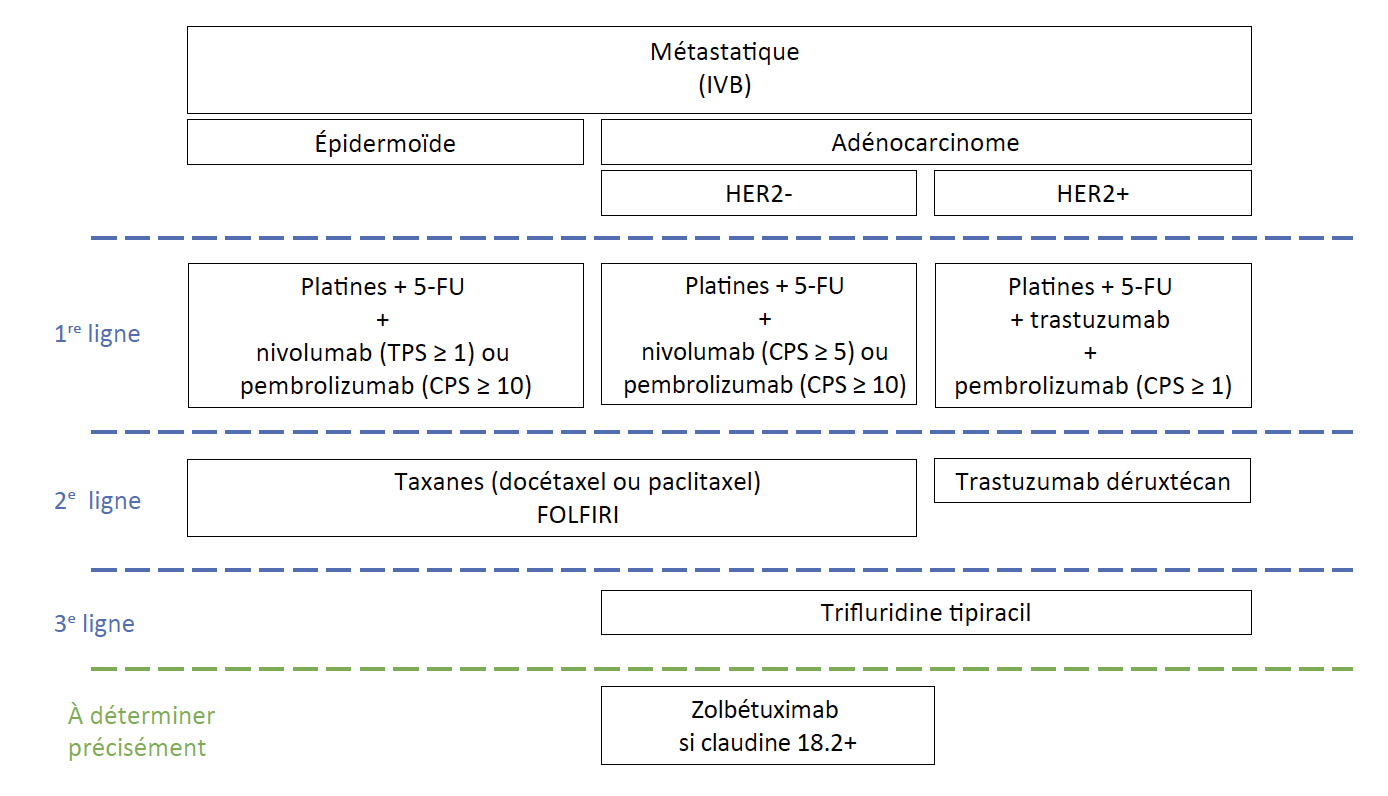
Prise en charge des cancers métastatiques (Fig. 2)
Figure 2 – Arbre décisionnel pour le cancer de l’œsophage métastatique (IVB).
Le choix du traitement systémique dépend avant tout du type histologique et du statut de certains biomarqueurs, tels PD-L1 (en CPS et en TPS) et HER2 dans l’adénocarcinome.
En première ligne des carcinomes épidermoïdes
Dans le carcinome épidermoïde, l’association cisplatine et fluorouracile est privilégiée, même si certaines études suggèrent que l’oxaliplatine pourrait remplacer le cisplatine.
Nivolumab versus pembrolizumab
Les taux de PD-L1 en CPS et TPS sont indispensables, puisqu’ils conditionnent l’utilisation du nivolumab ou du pembrolizumab. Pour rappel, le score CPS (combined positive score) représente le ratio du nombre de cellules exprimant PD-L1, incluant à la fois les cellules tumorales et les lymphocytes et macrophages du microenvironnement tumoral, par le nombre total de cellules tumorales (× 100) ; alors que le TPS (tumor proportion score) représente le ratio du nombre de cellules tumorales exprimant PD-L1 (sans prendre en compte les cellules immunes) par le nombre total de cellules tumorales (× 100).
• Ainsi, l’association cisplatine (80 mg/m2 J1) et 5-FU (800 mg/m2/j 5 jours) et nivolumab (TPS ≥ 1) ou pembrolizumab (CPS ≥ 10) permet une SG de 15,4 mois (IC 95 % : 11,9-19,5) et 13,9 mois (IC 95 % : 11,1-17,7) respectivement (9, 10). En l’absence d’éligibilité à l’immunothérapie, les survies sont plus faibles, aux alentours de 10,5 mois.
Autres anti-PD-1
D’autres anti-PD-1 démontrent des résultats similaires.
• Le tislélizumab, qui a une AMM européenne (mais pas de remboursement en France à ce jour) pour les patients avec TAP ≥ 5 % pour le PD-L1, permet une SG de 17,2 versus 10,6 mois (HR = 0,66 ; IC 95 % : 0,54-0,8), en notant que ces résultats ont été retrouvés dans une population majoritairement asiatique (75 %) (11).
Le score TAP (Tumor Area Positivity) est un score estimant l’expression du PD-L1 par la tumeur via une méthode d’estimation visuelle et est proche en termes de concordance et de reproductibilité avec d’autres méthodes d’estimation classique comme le CPS, qui doit, quant à lui, passer par un comptage des cellules exprimant le PD-L1 et est donc plus chronophage.
En première ligne des adénocarcinomes
Dans l’adénocarcinome, les traitements systémiques des stades métastatiques se rapprochent encore une fois de ceux des adénocarcinomes gastriques avec une combinaison à base de platine (cisplatine ou oxaliplatine) et de fluoropyrimidine (5-FU ou capécitabine), associée à une thérapie ciblée selon le statut HER2 et PD-L1, avec, de plus, des seuils différents de ceux des carcinomes épidermoïdes. Les résultats d’études font donc souvent référence à des essais dans les cancers gastriques.
• Une méta-analyse suggère que l’oxaliplatine est non inférieure au cisplatine, et que la capécitabine est supérieure au 5-FU. Le schéma XELOX ou FOLFOX semble donc le plus approprié actuellement.
Pour les patients HER2+ et PD-L1 ≥ 1 en CPS
Le pembrolizumab vient d’avoir un accès précoce et le standard est donc une association de type FOLFOX, trastuzumab, pembrolizumab permettant une SG de 20,0 mois (IC 95 % : 17,9-22,7) (12).
Pour les patients HER2+ PD-L1-
L’association FOLFOX ou 5-FU cisplatine-trastuzumab permet une survie aux alentours de 16 mois (étude TOGA) (13).
Pour les patients HER2- PD-L1+
L’association FOLFOX ou XELOX et nivolumab (CPS ≥ 5) ou pembrolizumab (CPS ≥ 10) permet une SG de 14,4 mois (IC 95 % : 13,1-16,2) (14) et 15,7 mois (IC 95 % : 13,8-19,3) (15) respectivement.
À noter qu’une étude de phase III comparant le classique schéma par FOLFOX avec le TFOX (chimiothérapie par docétaxel 50 mg/m², acide folinique 400 mg/m² et oxaliplatine 85 mg/m² suivie du 5-FU 2 400 mg/m² en continu sur 46 h toutes les 2 semaines) a démontré la supériorité de ce dernier en termes de SSP, SG et taux de réponse objective (TRO), pouvant faire de ce schéma par “FLOT modifié” le standard d’association pour les cancers HER2- en première ligne.
Pour les patients HER2- PD-L1-
Les résultats sont bien plus faibles, avec une survie de 11 mois.
À noter l’arrivée des anticorps anti-claudine 18.2, exprimée par 35 à 40 % des adénocarcinomes. Le zolbétuximab, en association au FOLFOX ou XELOX dans deux phases III, a montré des médianes de survie entre 14,4 et 18,2 mois (16, 17). Sa place par rapport à l’immunothérapie devra ainsi être déterminée à l’avenir.
En deuxième et troisième lignes
• En deuxième ligne, que ce soit pour les carcinomes épidermoïdes ou adénocarcinomes, les choix sont encore plutôt restreints, avec la possibilité d’utiliser des molécules comme l’irinotécan (en association avec le fluorouracile dans le schéma FOLFIRI) ou des taxanes comme le docétaxel ou paclitaxel.
• Plus spécifiquement dans les adénocarcinomes, le trifluridine tipiracil peut être utilisé en troisième ligne chez des patients en bon état général (Performance Statut de 0 ou 1).
Pour les patients HER2+
• L’étude Destiny-Gastric04, une étude de phase III tout récemment présentée à l’ASCO 2025, comparant un standard de deuxième ligne par ramucirumab et paclitaxel contre le trastuzumab déruxtécan a montré une augmentation de SG de plus de 3 mois avec le trastuzumab déruxtécan, faisant de ce dernier un standard de deuxième ligne à privilégier à présent.
Conclusion
Le traitement des cancers de l’œsophage a donc été bouleversé ces dernières années avec, à l’instar d’autres cancers, la recherche de biomarqueurs pour proposer des immunothérapies et thérapies ciblées qui ont considérablement amélioré la survie des patients.
Hugo Grève-Viallon n’a pas de liens d’intérêt. Jérôme Fayette déclare avoir des liens d’intérêt avec BMS, MSD, AstraZeneca, Merck Serono, Roche, Takeda, Meru ; Clélia Coutzac avec MSD Oncology, Merck Serono, Daiichi Sankyo, AstraZeneca, BMS, Pierre Fabre, Servier, Amgen, Mundipharma et Sandoz.
Bibliographie
1. Eyck BM, van Lanschot JJB, Hulshof MCCM et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: the randomized controlled CROSS trial. J Clin Oncol 2021 ; 39 : 1995-2004.
2. Kelly RJ, Ajani JA, Kuzdzal J et al. Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer. N Engl J Med 2021 ; 384 : 1191-203.
3. Kato K, Machida R, Ito Y et al. Doublet chemotherapy, triplet chemotherapy, or doublet chemotherapy combined with radiotherapy as neoadjuvant treatment for locally advanced oesophageal cancer (JCOG1109 NExT): a randomised, controlled, open-label, phase 3 trial. Lancet 2024 ; 404 : 55-66.
4. Al-Batran SE, Homann N, Pauligk N et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 2019 ; 393 : 1948-57.
5. Reynolds JV, Preston SR, O’Neill B et al. Trimodality therapy versus perioperative chemotherapy in the management of locally advanced adenocarcinoma of the oesophagus and oesophagogastric junction (Neo-AEGIS): an open-label, randomised, phase 3 trial. Lancet Gastroenterol Hepatol 2023 ; 8 : 1015-27.
6. Hoeppner J, Brunner T, Schmoor C et al. Perioperative chemotherapy or preoperative chemoradiotherapy in oesophageal cancer. N Engl J Med 2025 ; 392 : 323-35.
7. Leong T, Smithers B. M, Michael M et al. Preoperative chemoradiotherapy for resectable gastric cancer. N Eng J Med 2024 ; 391 : 1810-21.
8. Janjigian YY, Al-Batran SE, Wainberg ZA et al. Perioperative durvalumab in gastric and gastroesophageal junction cancer. N Engl J Med 2025 ; 393 : 217-30.
9. Doki Y, Ajani JA, Kato K et al. Nivolumab combination therapy in advanced esophageal squamous-cell carcinoma. N Engl J Med 2022 ; 386 : 449-62.
10. Sun JM, Shen L, Shah MA et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): a randomised, placebo-controlled, phase 3 study. Lancet 2021 ; 398 : 759-71.
11. Xu J, Kato K, Raymond E et al. Tislelizumab plus chemotherapy versus placebo plus chemotherapy as first-line treatment for advanced or metastatic oesophageal squamous cell carcinoma (RATIONALE-306): a global, randomised, placebo-controlled, phase 3 study. Lancet Oncol 2023 ; 24 : 483-95.
12. Janjigian YY, Kawazoe A, Bai Y et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023 ; 402 : 2197-208.
13. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010 ; 376 : 687-97.
14. Janjigian YY, Shitara K, Moehler M et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet 2021 ; 398 : 27-40.
15. Rha SY, Oh DY, Yañez P et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol 2023 ; 24 : 1181-95.
16. Shah MA, Shitara K, Ajani JA et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med 2023 ; 29 : 2133-41.
17. Shitara K, Lordick F, Bang YJ et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2023 ; 401 : 1655-68.