Introduction
Épidémiologie
Le cancer de la prostate (CaP) est le cancer le plus fréquent chez l’homme de plus de 50 ans, et notamment dans les pays développés, où il demeure la troisième cause de mortalité par cancer.
Au cours des années 1980-2010, il a été constaté une augmentation de son incidence (1) dans les pays développés en raison du vieillissement de la population, mais également du dosage plus fréquent du PSA (Prostate-Specific Antigen). Durant cette période, en cas d’élévation du PSA et/ou d’anomalie clinique au toucher rectal, il était alors réalisé 12 biopsies dites systématiques, car étagées à la partie postérieure de la prostate, sous guidage échographique. Cette stratégie a entraîné une nette augmentation du nombre de cancers, le plus souvent indolents, de faible grade et de petite taille, dont le traitement immédiat a été remis en cause. Et à l’inverse, environ 30 % de cancers de haut grade étaient manqués par les biopsies systématiques, notamment ceux développés à la partie antérieure de la prostate, non échantillonnée lors des biopsies systématiques (2).
Apport de l’IRM multiparamétrique
Avec l’arrivée de l’IRM multiparamétrique (IRM-mp), permettant de localiser avec précision les foyers tumoraux (3), il a été possible de réaliser des biopsies prostatiques ciblées sur les anomalies visibles en IRM. Cette nouvelle stratégie a ainsi permis d’augmenter la détection des cancers significatifs et d’améliorer l’estimation de leur grade tout en diminuant le taux de cancers indolents.
L’objectif est donc de sélectionner au mieux les indications thérapeutiques à l’heure où des alternatives au traitement radical ont été démontrées, et en première ligne la surveillance active.
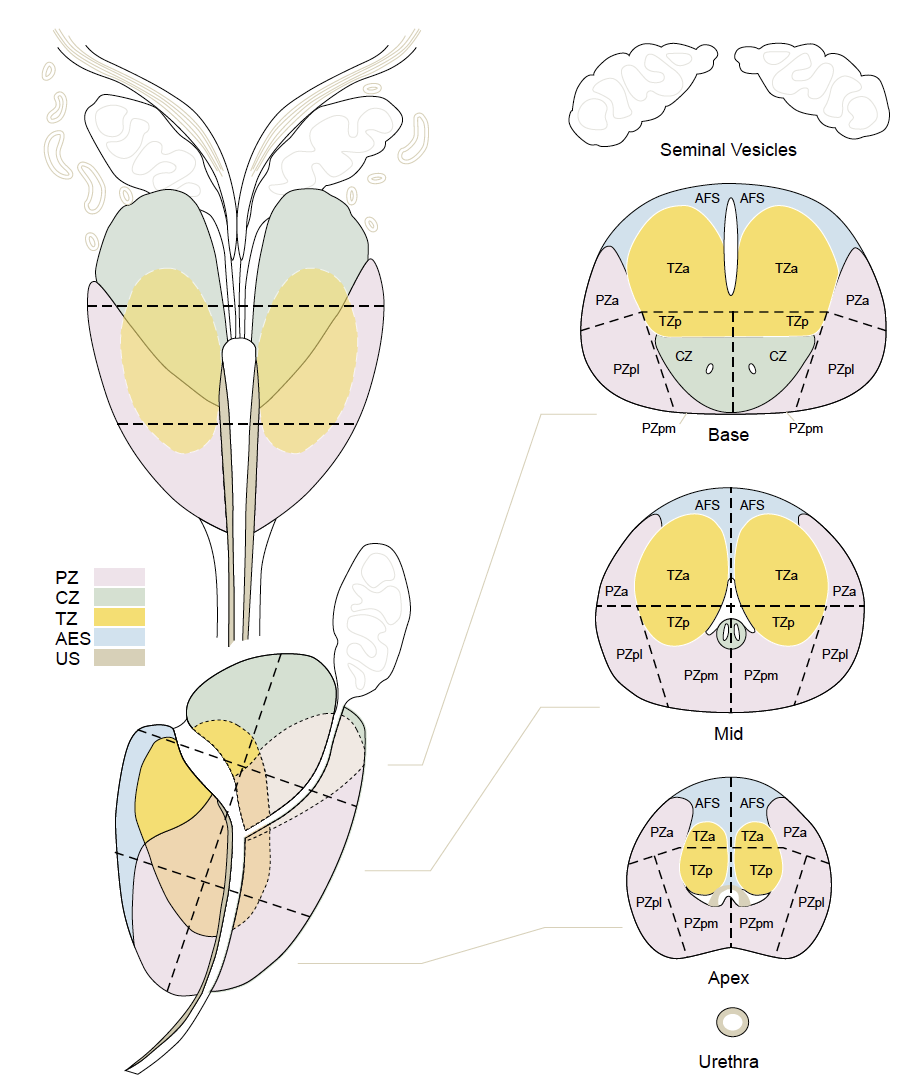
L’anatomie de la prostate
La prostate est située dans la cavité pelvienne sous la vessie, en avant du rectum et est classiquement décrite comme une châtaigne, divisée en deux lobes prostatiques droit et gauche et en trois parties selon la hauteur (Fig. 1) :
• la base de la prostate, située à la partie haute (sous le col de la vessie en avant et la racine des vésicules séminales en arrière) ;
• l’apex prostatique, situé à la partie basse ;
• la partie moyenne, entre les deux.
Figure 1 – Segmentation de la prostate selon le PIRADS v2.1 (5).
Pour chaque lobe prostatique droit et gauche, la ZP, en rose, est divisée à la base, partie moyenne et apex, en plusieurs secteurs : postéro-médial (PZpm), postéro-latéral (PZpl) et antérieur (PZa). De même, la ZT, en jaune, est divisée en secteurs antérieurs (TZa) et postérieurs (TZp). Le SFMA (AFS), en bleu, vient tapisser la partie antérieure de la prostate. La ZC (CZ), en vert, est retrouvée à la base de la prostate, avec une forme de “moustache” sur la coupe coronale.
Elle est divisée, depuis la description de Mc Neal (4), en plusieurs zones disposées autour de l’urètre prostatique et des canaux éjaculateurs. Il existe ainsi trois zones glandulaires et une quatrième zone non glandulaire (Fig. 1) :
• la zone périphérique (ZP), postérieure et latérale, est accessible au toucher rectal ; c’est la zone d’origine des prostatites et d’environ 70 % des cancers ;
• la zone centrale (ZC) entoure les canaux éjaculateurs et a la forme d’un cône inversé qui s’étend de la base de la prostate jusqu’au veru montanum ;
• la zone de transition (ZT), située en avant de la ZC et bordée latéralement par la ZP, est le siège de l’hyperplasie bénigne de prostate au cours du vieillissement ; environ 20 % des cancers sont localisés dans cette zone, souvent à la partie antérieure et à l’apex ;
• le stroma fibro-musculaire antérieur (SFMA), en avant de la ZT, correspond à un épaississement antérieur de la capsule prostatique composé de fibres musculaires et de tissu conjonctif.
Le dépistage
Le dépistage organisé du CaP n’est actuellement pas recommandé par la Haute Autorité de santé (HAS), notamment en raison du risque de diagnostiquer trop de cancers indolents (“surdiagnostic” à l’origine d’un “surtraitement”), comme l’ont démontré deux études, l’une européenne (6) et l’autre américaine (7).
L’Association française d’urologie (AFU) préconise un dépistage individuel annuel en dosant le PSA et en réalisant un toucher rectal. Désormais, il est prescrit une IRM de prostate si l’un des deux paramètres est anormal avant la réalisation d’éventuelles biopsies ciblées en complément des biopsies systématiques (8).
Les marqueurs biologiques
Le taux de PSA
Le PSA est excrété dans la lumière des glandes prostatiques.
Une partie du PSA passe dans le sang permettant ainsi d’effectuer son dosage par un prélèvement veineux. Il s’agit d’un marqueur spécifique d’organe, mais non spécifique de cancer : il peut être augmenté dans d’autres circonstances, notamment l’hypertrophie bénigne de la prostate et la prostatite. Il faut donc réaliser au moins deux dosages successifs au-delà de la valeur seuil, distants de quelques semaines ou percevoir une anomalie au toucher rectal pour justifier la poursuite des investigations.
Le taux de PSA est normal lorsqu’il est inférieur à 4 ng/ml, mais ce chiffre est à pondérer par le volume de la prostate, soit par un calcul mental (le taux normal est < 10 % du volume (en cm3) + 1), soit en calculant la densité de PSA.
La densité du PSA
La densité du PSA (PSAd) (9) correspond au ratio du PSA total par rapport au volume prostatique déterminé par IRM ou échographie (largeur x hauteur x longueur x 0,52). La PSAd est destinée à minimiser l’effet de l’hypertrophie bénigne de la prostate. En général, une PSAd supérieure à 0,15 ng/ml/cm3 fait suspecter la présence d’un cancer.
Score de Gleason et groupes histopronostiques
Les grades histologiques définis par Gleason (10) reflètent l’hétérogénéité de l’architecture tumorale et permettent de calculer un score indiquant l’agressivité tumorale qui constitue un facteur pronostique essentiel dans la prise en charge du CaP. Le score est la somme des deux grades les plus représentés en indiquant en premier le grade majoritaire.
Les groupes histopronostiques
En 2016, l’Organisation mondiale de la santé (OMS) a adopté le système de classification proposé par l’ISUP (International Society of Urological Pathology) qui dissocie les scores 7 de Gleason en scores 3+4 et 4+3 selon la prédominance du grade 4 (< ou > 50 %). Il existe ainsi cinq groupes histopronostiques :
• groupe histopronostique 1 : score de Gleason ≤ 6 ;
• groupe histopronostique 2 : score de Gleason 7 = 3+4 (grade 4 < 50 %) ;
• groupe histopronostique 3 : score de Gleason 7 = 4+3 (grade 4 > 50 %) ;
• groupe histopronostique 4 : score de Gleason 8 = 4+4 (très rarement 3+5 ou 5+3) ;
• groupe histopronostique 5 : score de Gleason > 8.
Le groupe 1 est considéré comme bas grade, le groupe 2 est considéré comme grade intermédiaire et les grades 3 à 5 comme haut grade.
Le diagnostic
Avec l’arrivée de l’IRM multiparamétrique (IRM-mp), incluant des séquences fonctionnelles (diffusion et perfusion) en complément de l’imagerie morphologique (séquences T2), il a été ainsi permis de localiser avec fiabilité les foyers suspects afin de réaliser des biopsies ciblées.
L’IRM avant biopsie est donc devenue une recommandation de la part des sociétés savantes urologiques. En effet, l’interprétation peut être faussée après la réalisation de biopsies en raison des remaniements hémorragiques.
L’IRM prostatique
Le déroulement
L’examen peut être aussi bien effectué à 1,5 ou 3 Tesla, sans antenne endorectale et en 20 minutes, surtout si l’on privilégie une acquisition biparamétrique (T2 et diffusion, sans injection de produit de contraste).
Le rectum doit être collabé, car la présence d’air est source d’artéfacts sur la séquence de diffusion. Il est donc recommandé de réaliser un lavement rectal dans les heures précédant l’examen. L’air peut également être aspiré par une petite canule juste avant la réalisation de l’examen. Il faut vérifier au préalable l’absence de contre-
indications à l’IRM et/ou à l’injection de produit de contraste, comme pour tout examen, en faisant remplir un formulaire par le patient.
Les séquences IRM
Le score PI-QUAL (Prostate Imaging Quality) a été développé pour évaluer et améliorer la qualité des images de l’IRM prostatique afin d’optimiser la détection de foyers tumoraux. Une nouvelle version a été publiée en 2024 (11).
Les séquences doivent couvrir la prostate en totalité ainsi que les vésicules séminales. Le protocole inclut :
• une séquence T2 (séquence 3D ou au moins deux plans de l’espace orthogonaux afin de bien apprécier la capsule prostatique) ;
• une séquence de diffusion DWI (Diffusion Weighted Imaging) avec la cartographie ADC : il est recommandé de réaliser des acquisitions avec trois valeurs de b : une basse (b 50-b 100), une moyenne (b 500) et une élevée (b 800-1 000 s/mm2). Pour la lecture qualitative des images, une valeur de b ≥ 1 400 s/mm2 est nécessaire. Celle-ci doit être soit acquise par une séquence séparée, soit obtenue en utilisant des images synthétiques, à partir des valeurs de b acquises. En général, la lecture se fait sur une valeur de b 2 000, voire b 2 500 s/mm² (plutôt qu’à b 1 400 s/mm²) (12) et des valeurs de b calculées encore plus élevées peuvent être utiles chez certains patients (3 000, 4 000 s/mm², voire plus) (13), afin de différencier les lésions bénignes des malignes. En effet, ces images à valeurs élevées de b permettent de supprimer le signal de la prostate bénigne, alors que le cancer reste en hypersignal ;
• une séquence dynamique en écho de gradient 3D T1 après injection de produit de gadolinium (Dynamic Contrast Enhanced, DCE) à haute résolution temporelle, permettant d’analyser le rehaussement précoce des lésions focales ;
• une séquence ganglionnaire lombo-pelvienne remontant jusqu’à hauteur des hiles rénaux.
De plus en plus, l’IRM biparamétrique (T2 et diffusion) est réalisée permettant de répondre à la demande croissante d’IRM prostatique, mais elle nécessite des critères de qualité et d’interprétation optimaux au risque d’une baisse de la performance diagnostique (14).
Une acquisition multiparamétrique est néanmoins recommandée pour les lecteurs moins expérimentés, en cas d’artéfacts sur les séquences morphologiques et/ou d’antécédents de traitements prostatiques, qu’il s’agisse d’une prostatectomie radicale, de radiothérapie/curiethérapie ou plus rarement de traitement local comme l’HIFU.
L’interprétation
La réalisation et la lecture de l’IRM prostatique ont fait l’objet de recommandations, initialement en 2012, où l’European Society of Urogenital Radiology (ESUR) a introduit le score PI-RADS (Prostate Imaging Reporting And Data System) dans sa version v1 (15), révisée en version v2 puis v2.1 en 2019 (5).
La lecture de l’IRM nécessite un apprentissage et une connaissance précise du score PI-RADS.
• Pour la zone périphérique, la séquence de diffusion est la séquence dominante ; la séquence de DCE est la séquence secondaire.
• Pour la zone de transition, la séquence T2 est la séquence dominante ; la séquence de DWI est la séquence secondaire.
Le score PI-RADS et le score de Likert
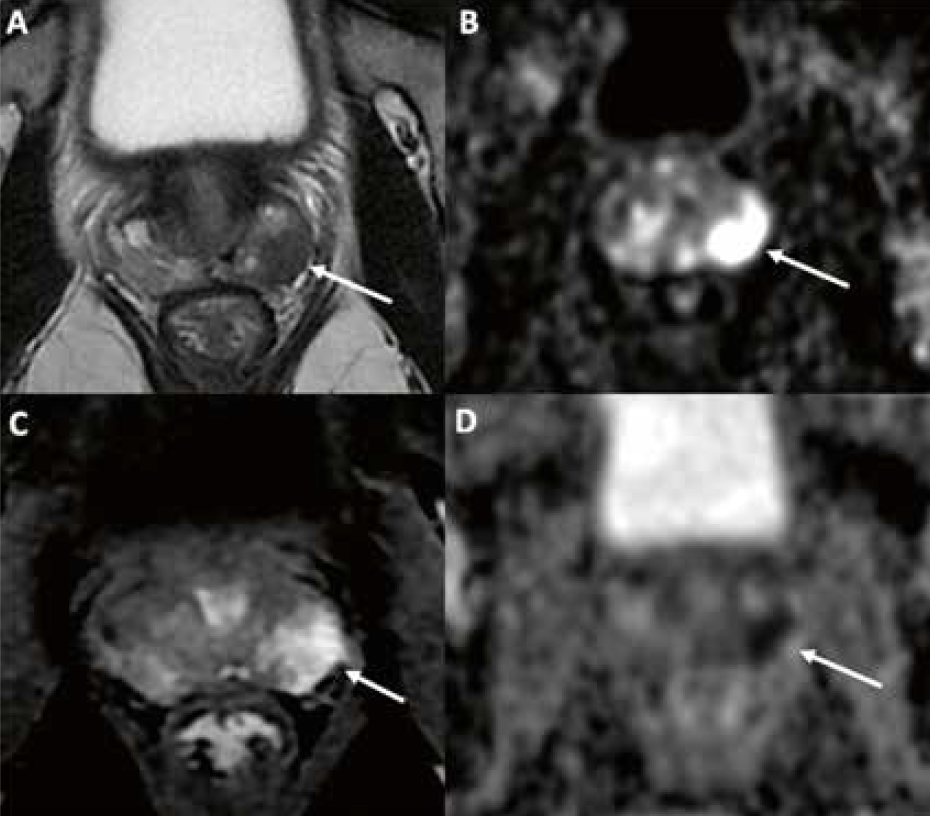
L’analyse de l’imagerie par un radiologue expérimenté permet ainsi de donner le score PI-RADS dans chaque zone prostatique. La présomption de malignité a été évaluée sur une échelle de 1 à 5 selon le score de Likert (score 1 : cancer très peu probable à score 5 : cancer très probable). Le PI-RADS est maintenant largement utilisé et validé, dans la pratique quotidienne et dans les études, par tous les praticiens impliqués dans la prise en charge du CaP. La figure 2 montre un exemple de cancer de la prostate de la zone périphérique gauche PI-RADS 5.
Figure 2 – IRM prostatique PI-RADS 5.
Patient de 66 ans avec un PSA à 12 ng/ml. Anomalie focale de la zone périphérique gauche de 16 mm à la partie moyenne avec effacement et irrégularité capsulaire, en hyposignal T2 (A, flèche), franc hypersignal diffusion (B, flèche), hyposignal ADC (D, flèche), et prise de contraste précoce (C, flèche). Gleason 4+3 sur les biopsies ciblées. Stade T3a IRM.
En cas d’IRM suspecte avec un score PI-RADS ≥ 3
Il faut réaliser des biopsies ciblées au niveau de l’anomalie visible en IRM pour une détection optimale du CaP, en complément des biopsies systématiques. En combinant l’IRM-mp et les biopsies ciblées (associées aux biopsies systématiques), le taux de détection du CaP cliniquement significatif est d’environ 96 % (16).
On peut éventuellement surseoir la biopsie pour un score PI-RADS 3 en l’absence de facteurs de risque, et poursuivre une surveillance biologique et IRM de la cible.
En cas d’IRM non suspecte (PI-RADS 1 ou 2)
On peut surseoir aux biopsies en cas de faible risque clinique et biologique, à réévaluer au cours de la surveillance. En cas de risque plus élevé, les biopsies systématiques restent recommandées.
Évaluation de l’extension de la maladie
Outre son rôle de détection des anomalies focales, l’analyse de l’IRM permet d’évaluer l’extension de la maladie, notamment en extra-prostatique (T3a), au niveau des vésicules séminales (T3b), les rapports avec le col vésical, le rectum, le sphincter urétral, la paroi pelvienne (T4), mais aussi de rechercher des ganglions suspects (N) ou des lésions osseuses (M) afin d’établir le stade TNM.
L’IRM prostatique est donc cruciale dans l’évaluation de l’extension tumorale et peut avoir une incidence dans la prise en charge thérapeutique en ajoutant au traitement standard une hormonothérapie de nouvelle génération en cas d’atteinte extra-capsulaire, comme en témoigne l’étude Stampede (17).
Détection des récidives et surveillance active
Finalement, l’IRM joue un rôle majeur dans la détection des récidives après traitement (prostatectomie, radiothérapie ou curiethérapie, ou plus rarement traitements focaux), mais aussi dans le cadre de la surveillance active avec le développement de scores qui sont respectivement le PI-RR (Prostate Imaging for Recurrence Reporting) (18) et PRECISE (Prostate cancer Radiological Estimation of Change In Sequential Evaluation) (19).
Dernières avancées en IRM prostatique
Malgré la volonté de standardisation des critères de détection des cancers à l’IRM-mp avec le score PI-RADS, l’interprétation des images par les radiologues demeure qualitative : il manque donc de reproductibilité et de spécificité.
L’analyse des anomalies focales prostatiques
Depuis plusieurs années, de nombreuses études se sont intéressées à différents paramètres pour l’analyse des anomalies focales prostatiques afin de différencier les lésions bénignes des lésions malignes comme la réalisation de b élevés, la mesure quantitative de l’ADC (valeur moyenne de l’ADC, ADC volumique, le développement d’ADC ratio par rapport à la prostate saine), et, dans le cadre de la recherche l’IVIM (Intra-Voxel Incoherent Motion), le Kurtosis, et le tenseur de diffusion.
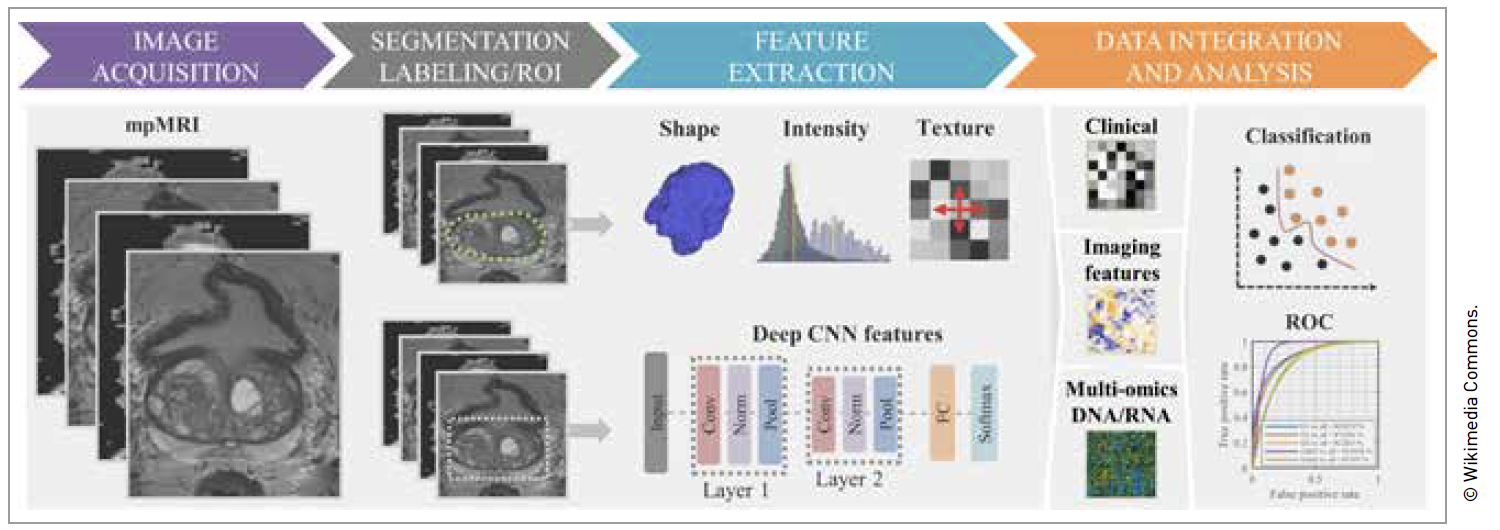
La radiomique
De nos jours, la radiomique devient de plus en plus émergente et consiste à extraire d’examens d’imagerie une grande quantité d’informations non perceptibles à l’œil nu par le radiologue afin de réaliser des diagnostics de précision.
Après l’étape d’acquisition d’images respectant des critères de qualité afin de fournir des informations interprétables et comparables, une segmentation des lésions est réalisée. Puis, il y a une phase d’extraction de caractéristiques de forme, d’intensité et/ou de texture et enfin une phase d’analyses et d’apprentissage statistique avec notamment le deep-learning (Fig. 3).
Figure 3 – Exemple de modèle de radiomique (20).
La radiomique (21, 22) permet, dans le cadre de l’IRM prostatique, d’améliorer la détection du CaP, la prédiction du score de Gleason, l’extension extra-capsulaire, d’évaluer le risque de rechute biochimique, et même la réponse thérapeutique avec l’objectif d’adapter le traitement à cette réponse pour chaque patient.
Les biopsies prostatiques ciblées
Comme dans tout cancer, l’analyse histologique conditionne l’attitude thérapeutique.
Intérêt
Les biopsies ciblées sont donc indispensables pour donner une évaluation précise de la tumeur avec notamment une longueur maximale de cancer plus importante et une estimation du grade de Gleason plus précise que les biopsies systématiques. Les biopsies ciblées permettent de sélectionner au mieux les indications thérapeutiques, y compris la surveillance active.
En pratique
Les biopsies sont encore souvent réalisées par voie endorectale, mais la voie transpérinéale est recommandée afin de diminuer le risque infectieux (23) et elle permet notamment d’atteindre plus facilement les cibles antérieures.
Les biopsies peuvent être effectuées sous guidage échographique avec éventuelle fusion IRM-échographie, mais aussi sous guidage IRM, nécessitant alors un robot IRM compatible.
Les biopsies ciblées sous guidage échographique +/- fusion IRM-échographie
Il y a deux approches possibles.
• La première méthode consiste à projeter mentalement l’anomalie IRM sur la zone correspondante lors de l’échographie, permettant le plus souvent de retrouver la lésion en échographie, notamment dans la zone périphérique. La localisation de la tumeur par échographie est encore plus facile en utilisant la micro-échographie (sonde de très haute fréquence).
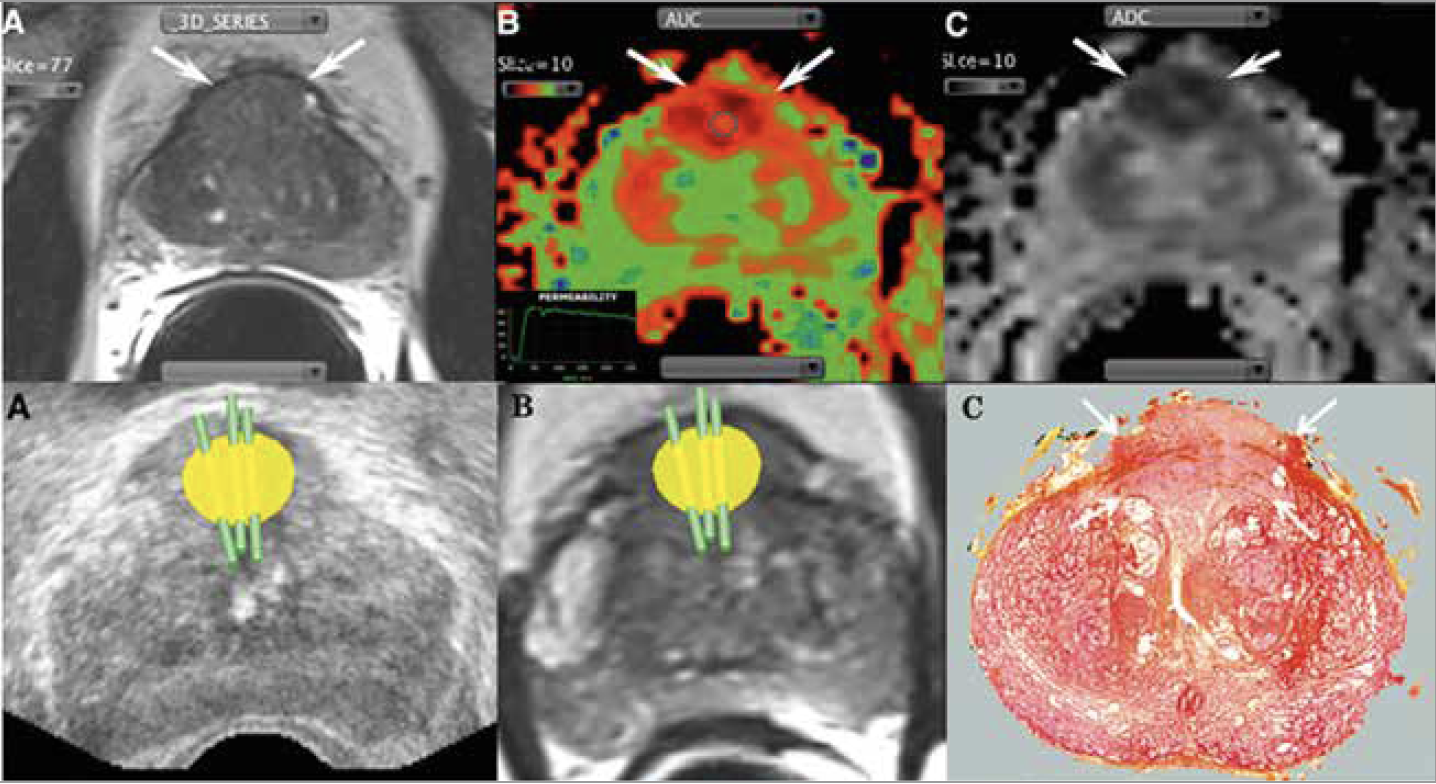
• La seconde méthode consiste à recaler les données d’IRM avec celles de l’échographie (fusion d’images) en utilisant un logiciel dédié (Fig. 4). Certains logiciels permettent même d’obtenir une reconstruction tridimensionnelle de la prostate avec une fusion d’images dite élastique qui recale les volumes IRM et échographiques en temps réel.
Figure 4 – Biopsies ciblées sous guidage échographique avec fusion d’images élastique IRM (24).
Patient de 69 ans avec un PSA à 9 ng/ml. Anomalie focale de la ZT antérieure médiane en
hyposignal T2 (A blanc, flèches), hypervascularisée (B blanc, flèches), avec baisse de l’ADC
(C blanc, flèches). Après fusion échographie-IRM 3D, trois biopsies sont réalisées au sein de la cible (A, B noirs) correspondant à un adénocarcinome (C noir, flèches) Gleason 7 : 4+3.
Cependant, des erreurs de ciblage sont toujours possibles, même chez des experts, notamment en raison des mouvements involontaires de la prostate et/ou du patient lors de la biopsie, et/ou à la non-concordance exacte des images lors du recalage.
Les biopsies ciblées sous guidage IRM direct
Elles sont réalisées à l’aide d’un robot IRM compatible, disposé entre les jambes du patient, installé en décubitus ventral. Des séries axiales et sagittales T2 rapides sont acquises et transférées à un logiciel permettant, après avoir repéré la lésion cible, d’aligner le guide avec la cible puis d’effectuer les biopsies ciblées (Fig. 5).
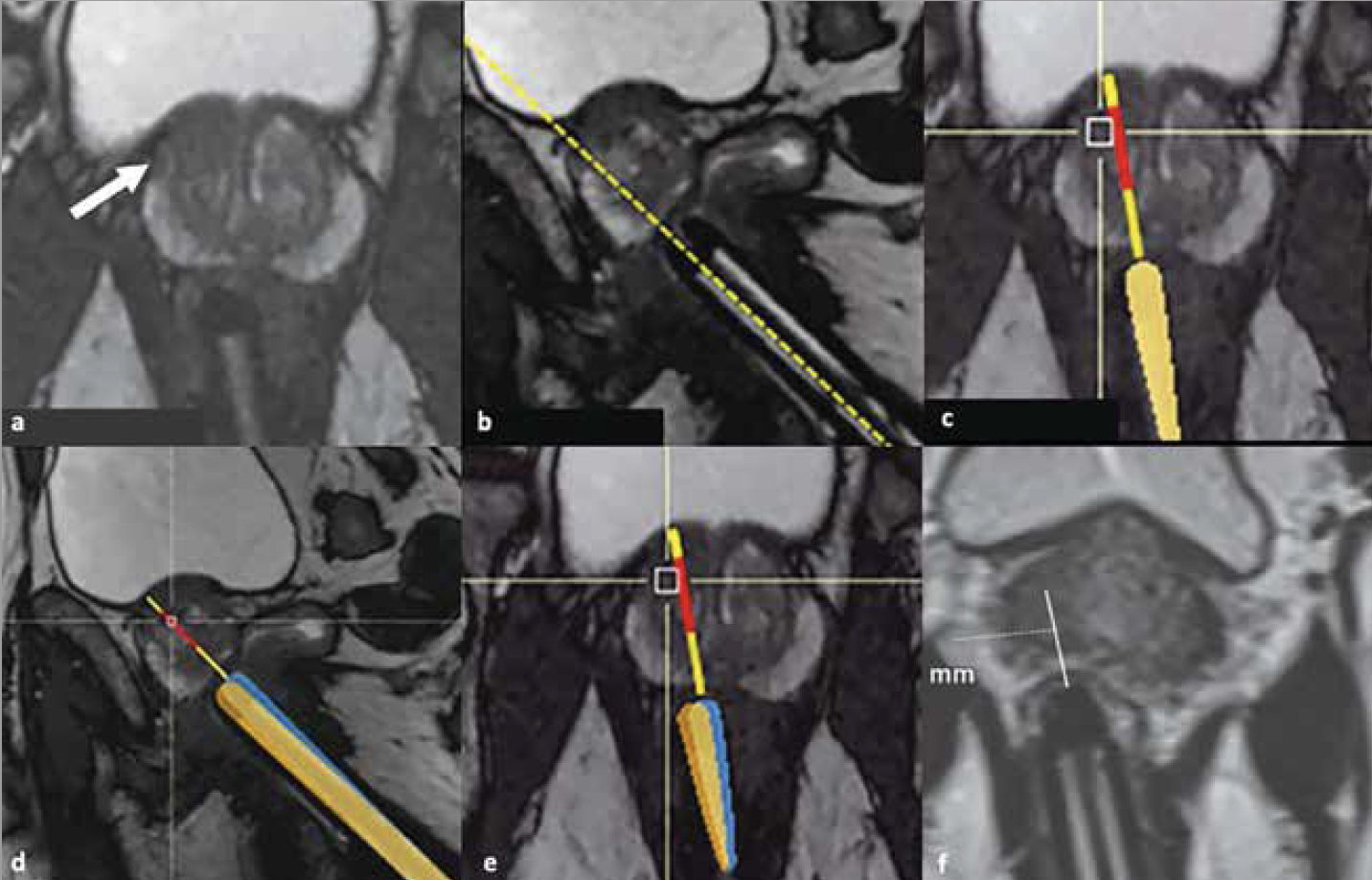
Figure 5 – Biopsies ciblées sous guidage IRM par voie transrectale (25).
Anomalie focale de la ZT antérieure droite (a, flèche) chez un patient de 67 ans avec un PSA à 8,1 ng/ml. Après mise en place du robot, ciblage de l’anomalie sous guidage IRM sur des séquences rapides axiales et sagittales (b, c) avant prélèvement qui permettent d’ajuster la précision du ciblage avant prélèvement (d, e). Une fois la mesure de la distance jusqu’à la cible effectuée (f), la biopsie peut être réalisée.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Jemal A, Fedewa SA, Ma J et al. Prostate cancer incidence and PSA testing patterns in relation to USPSTF screening recommendations. JAMA 2015 ; 314 : 2054.
2. Ouzzane A, Renard-Penna R, Marlière F et al. Magnetic resonance imaging targeted biopsy improves selection of patients considered for active surveillance for clinically low risk prostate cancer based on systematic biopsies. J Urol 2015 ; 194 : 350-6.
3. Ahmed HU, El-Shater Bosaily A et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet 2017 ; 389 : 815-22.
4. McNeal JE. The zonal anatomy of the prostate. Prostate 1981 ; 2 : 35-49.
5. Turkbey B, Rosenkrantz AB, Haider MA et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2. Eur Urol 2019 ; 76 : 340-51.
6. Schröder FH, Hugosson J, Roobol MJ et al. Prostate-cancer mortality at 11 years of follow-up. N Engl J Med 2012 ; 366 : 981-90.
7. Andriole GL, Crawford ED, Grubb RL 3rd et al. Prostate cancer screening in the randomized prostate, lung, colorectal, and ovarian cancer screening trial: mortality results after 13 years of follow-up. J Natl Cancer Inst 2012 ; 104 : 125-32.
8. Delporte G, Villers A, Penel N. Dépistage du cancer de la prostate : éléments de la controverse. Bull Cancer 2018 ; 105 : 1111-8.
9. Görtz M, Radtke JP, Hatiboglu G et al. The value of prostate-specific antigen density for prostate imaging-reporting and data system 3 lesions on multiparametric magnetic resonance imaging: a strategy to avoid unnecessary prostate biopsies. Eur Urol Focus 2021 ; 7 : 325-31.
10. Gleason DF. Histologic grading of prostate cancer: A perspective. Hum Pathol 1992 ; 23 : 273-9.
11. De Rooij M, Allen C, Twilt JJ et al. PI-QUAL version 2: an update of a standardised scoring system for the assessment of image quality of prostate MRI. Eur Radiol 2024 ; 34 : 7068-79.
12. Jendoubi S, Wagner M, Montagne S et al. MRI for prostate cancer: can computed high b-value DWI replace native acquisitions? Eur Radiol 2019 ; 29 : 5197-204.
13. Vural M, Ertag G, Onay A et al. Conspicuity of peripheral zone prostate cancer on computed diffusion-weighted imaging: comparison of cDWI1500, cDWI2000, and cDWI3000. BioMed Res Int 2014 ; 2014 : 768291.
14. Twilt JJ, Saha A, Bosma JS et al. Evaluating biparametric versus multiparametric magnetic resonance imaging for diagnosing clinically significant prostate cancer: an international, paired, noninferiority, confirmatory observer study. Eur Urol 2025 ; 87 : 240-50.
15. Barentsz JO, Richenberg J, Clements R et al. ESUR prostate MR guidelines 2012. Eur Radiol 2012 ; 22 : 746-57.
16. Freifeld Y, Xi Y, Passoni N et al. Optimal sampling scheme in men with abnormal multiparametric MRI undergoing MRI-TRUS fusion prostate biopsy. Urol Oncol 2019 ; 37 : 57-62.
17. Attard G, Murphy L, Clarke NW et al. Abiraterone acetate and prednisolone with or without enzalutamide for high-risk non-metastatic prostate cancer: a meta-analysis of primary results from two randomised controlled phase 3 trials of the STAMPEDE platform protocol. Lancet 2022 ; 399 : 447-60.
18. Panebianco V, Villeirs G, Weinreb JC et al. Prostate magnetic resonance imaging for local recurrence reporting (PI-RR): international consensus-based guidelines on multiparametric magnetic resonance imaging for prostate cancer recurrence after radiation therapy and radical prostatectomy. Eur Urol Oncol 2021 ; 4 : 868-76.
19. Englman C, Maffei D, Allen C et al. PRECISE Version 2: updated recommendations for reporting prostate magnetic resonance imaging in patients on active surveillance for prostate cancer. Eur Urol 2024 ; 86 : 240-55.
20. Chaddad A, Kucharczyk MJ, Cheddad A et al. Magnetic resonance imaging based radiomic models of prostate cancer: a narrative review. Cancers 2021 ; 13 : 552.
21. Ferro M, de Cobelli O, Musi G et al. Radiomics in prostate cancer: an up-to-date review. Ther Adv Urol 2022 ; 14 : 17562872221109020.
22. Cutaia G, La Tona G, Comelli A et al. Radiomics and prostate MRI: current role and future applications. J Imaging 2021 ; 7 : 34.
23. Grummet J, Pepdjonovic L, Huang S et al. Transperineal vs. transrectal biopsy in MRI targeting. Transl Androl Urol 2017 ; 6 : 368-75.
24. Cornud F, Brolis L, Barry Delongchamps N et al. TRUS–MRI image registration: a paradigm shift in the diagnosis of significant prostate cancer. Abdom Imaging 2013 ; 38 : 1447-63.
25. Barral M, Lefevre A, Camparo P et al. In-bore transrectal MRI-guided biopsy with robotic assistance in the diagnosis of prostate cancer: an analysis of 57 patients. Am J Roentgenol 2019 ; 213 : W171-9.