La chimiothérapie utilisée dans le cancer du sein s’accompagne d’une baisse de la capacité d’exercice, affectant la qualité de vie des patientes. Avec une approche à l’interface entre la recherche clinique et la recherche fondamentale, nous avons identifié des mécanismes clés qui pourraient être contrecarrés par un exercice adapté.
Résumé
La chimiothérapie utilisée dans le cancer du sein se compose principalement d’une administration séquentielle d’épirubicine-cyclophosphamide (EC) et de paclitaxel (TAX). Ces traitements ont nettement contribué à l’amélioration de la survie des patientes, mais s’accompagnent néanmoins d’effets secondaires systémiques, affectant la capacité d’exercice et la qualité de vie des patientes. Ces altérations, précoces et non linéaires au cours du traitement, incluent un déconditionnement neuromusculaire et cardiorespiratoire qui pourrait être prévenu à partir de la compréhension des mécanismes sous-jacents. Nos travaux de recherche menés à l’Institut de cancérologie Strasbourg Europe (ICANS) et à l’UR 3072 ont mis en évidence divers mécanismes affectant le tissu musculaire squelettique, particulièrement après l’administration d’EC. Pour les contrecarrer, l’exercice est considéré comme un “médicament” nécessitant une prescription individualisée qui sera abordée dans cet article de synthèse.
Abstract
Decreased exercise capacity in breast cancer patients treated with chemotherapy : early management is needed
Chemotherapy used for breast cancer patients includes the sequential administrations of epirubicin-cyclophosphamide (EC) and paclitaxel (TAX). While these drugs have significantly improved patients’ survival rates, they are associated with off-target systemic side effects that usually impair patients’ exercise capacity and quality of life. These alterations, which are early and non-linear during treatment, include neuromuscular and cardiorespiratory deconditioning. However, understanding the underlying mechanisms is essential for developing preventive strategies. Our research, conducted at the Institut de cancérologie Strasbourg Europe and UR 3072, identified various mechanisms affecting skeletal muscle, particularly after EC administrations. To counteract these alterations, exercise is considered «medicine», requiring individualized prescription that will be detailed in this article.
Contexte
Les effets de la chimiothérapie
Le cancer du sein est souvent traité avec une chimiothérapie qui se compose majoritairement d’une administration séquentielle d’épirubicine-cyclophosphamide (EC) et de paclitaxel (TAX). Si ce type de traitement a permis d’améliorer considérablement le taux de survie des patientes, il est souvent associé à des effets secondaires systémiques au niveau neuromusculaire et cardiorespiratoire (1, 2), ce qui affecte drastiquement la capacité d’exercice des patientes et leur qualité de vie.
Dès lors, la mise en place de stratégies préventives, fondées sur de l’activité physique adaptée (APA) et, plus généralement, sur la pratique d’exercice, est nécessaire dès le début du traitement.
L’unité APA de l’ICANS
Cet article de synthèse s’appuie sur les travaux menés par notre équipe de recherche au sein de l’unité APA de l’Institut de cancérologie Strasbourg Europe (ICANS) et du laboratoire UR 3072 « Mitochondrie, stress oxydant et plasticité musculaire » du Centre de recherche en biomédecine de Strasbourg (CRBS). La spécificité de ces travaux en physiologie de l’exercice, initiés en 2019, est d’être à l’interface entre la recherche clinique et la recherche fondamentale, ce qui représente une approche novatrice dans le domaine de l’APA. Aujourd’hui, notre unité se compose à l’ICANS de deux chercheurs en APA qui la coordonnent, ainsi que d’un doctorant et de deux stagiaires de master de la Faculté des sciences du sport de Strasbourg. En plus des nombreuses études menées par l’équipe, près de 200 patients par an sont accompagnés sur le plan clinique et bénéficient des méthodes de mesures de pointe utilisées dans la recherche.
Un déconditionnement physique précoce et non linéaire
La baisse de la capacité d’exercice chez les patientes atteintes d’un cancer du sein a d’abord été caractérisée à distance de l’arrêt du traitement, ce qui a historiquement conduit à la mise en place d’exercice chez des patientes en rémission. Toutefois, il convient de noter que, dans la plupart des modèles expérimentaux connus pour engendrer un déconditionnement physique, la cinétique d’apparition des altérations est rapide et non linéaire.
Ce qui est observé
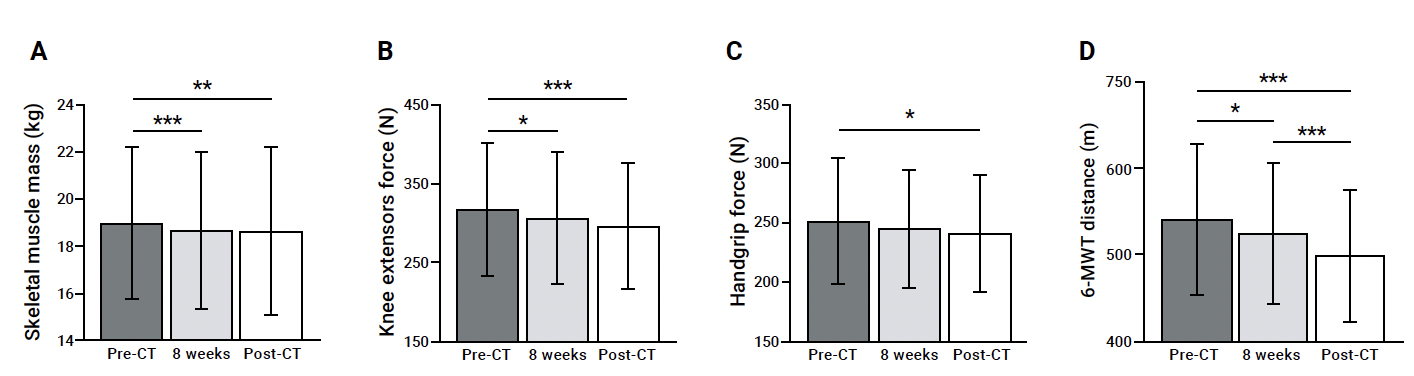
C’est pourquoi nous avons mené une étude de recherche à l’ICANS visant à étudier l’évolution de la capacité d’exercice chez 100 patientes atteintes d’un cancer du sein et traitées par chimiothérapie (3). Nous avons confirmé la présence d’un déconditionnement physique rapide et non linéaire (Fig. 1), caractérisé par une baisse de la masse musculaire et une réduction de la force des quadriceps dès 8 semaines de traitement. Ces altérations neuromusculaires étaient associées à une baisse globale de la capacité d’exercice et de la qualité de vie, ainsi qu’à une augmentation de la fatigue perçue. Toutefois, il convient de noter deux éléments essentiels.
Figure 1 – Déconditionnement physique au cours du traitement par chimiothérapie.
Évolution de la masse musculaire (A), force des extenseurs du genou (B), force de préhension (C) et capacité d’exercice (D) chez 100 patientes atteintes d’un cancer du sein avant la chimiothérapie (pré-CT), à 8 semaines (8 weeks) et à la fin du traitement (post-CT). Cette figure est adaptée d’une publication de notre équipe de recherche (3). 6-MWT, test de marche de 6 minutes. *P < 0,05 ; **P < 0,01 ; ***P < 0,001.
• Le premier concerne le fait qu’entre 8 semaines et la fin du traitement, la capacité d’exercice a continué de diminuer contrairement aux paramètres neuromusculaires, ce qui suggère que d’autres mécanismes, comme une toxicité cardiovasculaire, pourraient contribuer à l’aggravation du déconditionnement physique.
• Le second élément à souligner est que, si la baisse de force au niveau des quadriceps était précoce, la réduction de la force de préhension, évaluée par handgrip, était plus faible et plus tardive. Dès lors, dans un contexte clinique, il semble plus pertinent d’évaluer la force du membre inférieur, qui décline plus rapidement, de manière plus importante, et qui est davantage reliée aux activités de la vie quotidienne comme la locomotion, plutôt que d’évaluer systématiquement la force de préhension, malgré son caractère facile de mise en place.
Ainsi, en plus de devoir monitorer la capacité d’exercice tout au long du traitement pour détecter des changements précoces, la pratique d’exercice devrait s’effectuer le plus tôt possible pour prévenir les altérations, plutôt que d’attendre qu’elles soient installées pour les contrecarrer. Néanmoins, afin d’adapter la prise en charge et d’individualiser la pratique d’exercice, la compréhension des mécanismes à l’origine du déconditionnement physique est nécessaire.
Étudier les mécanismes à l’origine du déconditionnement physique pour individualiser la prescription d’exercice
De plus en plus, l’exercice est considéré comme un médicament dans le domaine de l’oncologie (4). Ainsi, à l’image d’un médicament, il doit être prescrit avec une posologie adéquate, qui comprend l’intensité, la fréquence, la durée et la modalité d’exercice.
Afin de déterminer ces paramètres de manière optimale, il est nécessaire d’identifier les mécanismes à l’origine du déconditionnement physique chez les patientes atteintes d’un cancer du sein pour pouvoir les cibler efficacement avec une posologie adaptée.
Des altérations mitochondriales musculaires responsables de la baisse de la capacité d’exercice
Les mitochondries sont des organites de la cellule qui sont essentiels pour la production de l’énergie (i.e. ATP). De facto, elles jouent un rôle clef dans le maintien de la capacité d’exercice étant donné la relation linéaire qu’il existe entre la quantité de mitochondries et la capacité maximale aérobie.
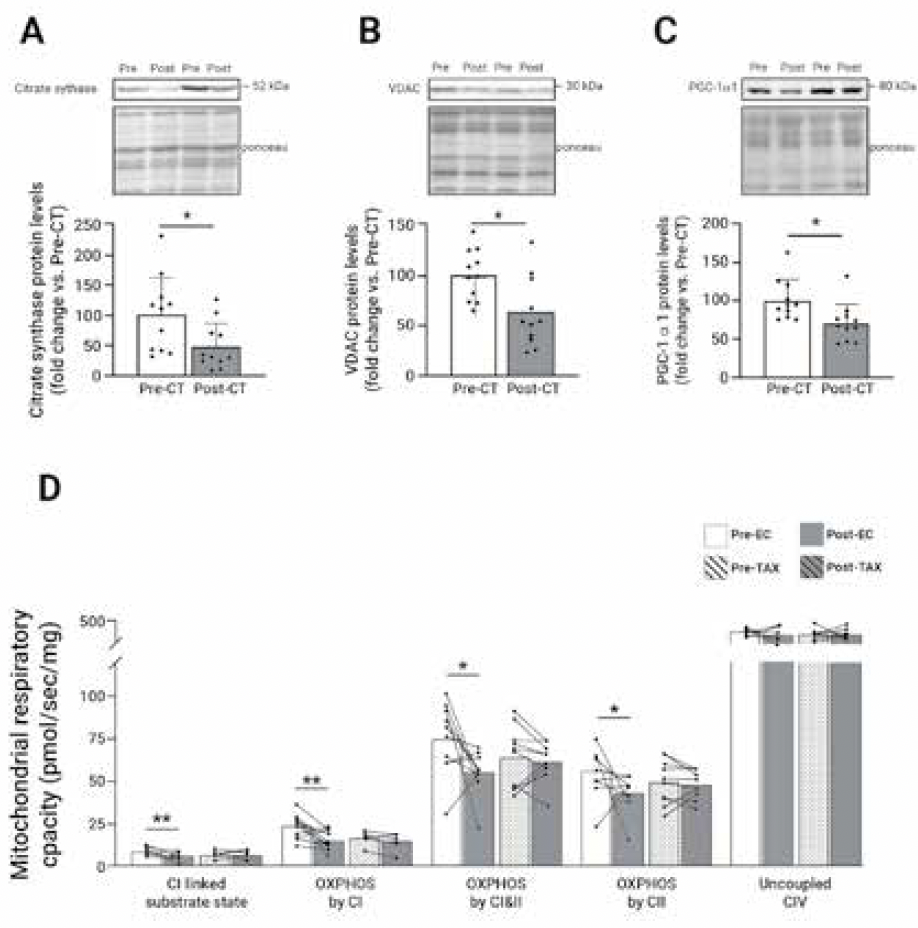
• Notre équipe a d’abord confirmé des travaux antérieurs en observant, grâce à des biopsies musculaires du quadriceps réalisées avant et après l’ensemble du traitement par chimiothérapie, une diminution du contenu mitochondrial au niveau du muscle vaste latéral (Fig. 2) (5). Ainsi, en plus des effets sur la capacité d’exercice, cette baisse du contenu mitochondrial pourrait également expliquer une partie de la fatigue liée au cancer. En effet, un même effort physique réalisé avec un contenu mitochondrial plus faible va entraîner une production d’énergie plus importante par la mitochondrie pour maintenir l’effort, ce qui génère une plus grande production de métabolites responsables de la fatigue musculaire. Au niveau mécanistique, cette baisse du contenu mitochondrial est en partie liée à une baisse de la biogenèse mitochondriale (PGC-1α) qui peut être augmentée par un exercice aérobie de haute intensité, générant un stimulus métabolique élevé.
Figure 2 – Altérations mitochondriales au cours du traitement par chimiothérapie.
Contenu mitochondrial évalué par les expressions protéiques de citrate synthase (A) et VDAC (B), et biogenèse mitochondriale évaluée par l’expression protéique de PGC-1α (C) avant (pré-CT) et après le traitement par chimiothérapie (post-CT). Capacité respiratoire mitochondriale (D) avant (pré) et après (post) la première administration d’épirubicine-cyclophosphamide (EC) ou de paclitaxel (TAX). Ces données proviennent de biopsies musculaires de patientes atteintes d’un cancer du sein dont les figures sont issues de deux publications de notre équipe de recherche (5, 6). *P < 0,05 ; **P < 0,01. C : complexe ; OXPHOS : phosphorylation oxydative.
• D’autre part, dans une autre étude, nous avons dissocié l’effet spécifique de l’EC et du TAX en réalisant des biopsies musculaires avant et 4 jours après la première administration de ces traitements (6). Étant donné que le schéma de traitement classique comprend une administration d’EC puis de TAX, il convient de noter que les patientes traitées par TAX avaient préalablement reçu de l’EC, ce qui a pu masquer certaines altérations. Toutefois, nous avons montré que la plupart des altérations présentes en fin de traitement étaient majoritairement attribuables à l’administration d’EC.
• Nous avons par ailleurs montré que l’administration d’EC était associée à une baisse de la respiration mitochondriale, le processus cellulaire permettant la production d’ATP (Fig. 2).
Ainsi, la pratique d’exercice aérobie devrait être mise en place prioritairement pendant les cycles d’EC pour les patientes dont le traitement comprend de l’EC puis du TAX.
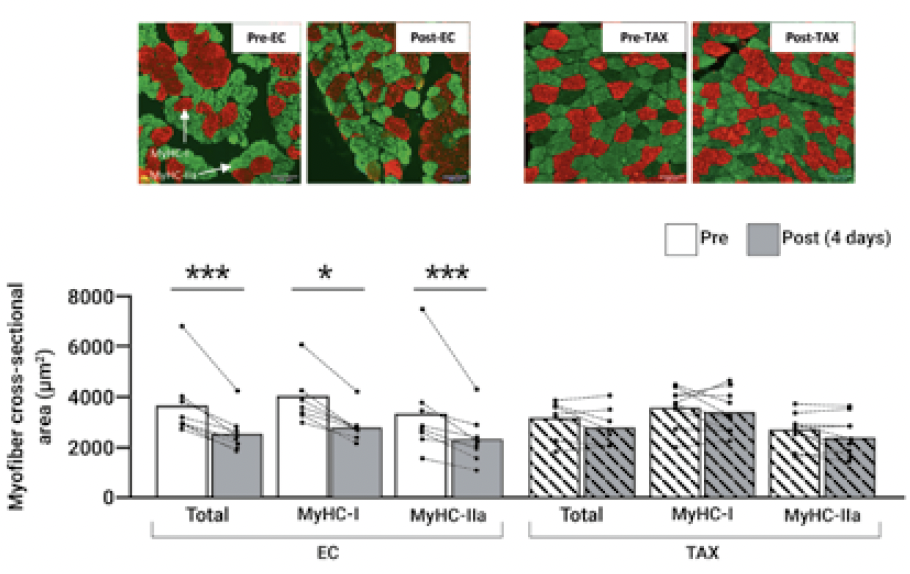
Une atrophie musculaire majeure en seulement 4 jours de chimiothérapie responsable de la baisse de force
En plus des altérations mitochondriales, qui affectent la qualité du muscle, nous avons identifié que l’atrophie musculaire observée à la fin du traitement par chimiothérapie (7) était majoritairement attribuable à la première administration d’EC (Fig. 3) (6). À titre comparatif, le degré d’atrophie induit en seulement 4 jours était comparable à 60 années de vieillissement, ce qui souligne l’effet majeur de la chimiothérapie au niveau musculaire et qui explique la perte de force observée à la fin du traitement. Bien que nous étudiions actuellement les mécanismes à l’origine de l’atrophie par une approche transcriptomique, que nous couplons à de la culture cellulaire, il est important de mentionner que l’exercice en résistance, par son stimulus mécanique, est connu pour lutter contre l’atrophie en favorisant l’augmentation de la synthèse protéique.
Figure 3 – Atrophie musculaire induite par la chimiothérapie.
Modifications de surface de section transversale des fibres musculaires du vaste latéral avant (pré) et 4 jours après (post) la première administration d’épirubicine-cyclophosphamide (EC) ou de paclitaxel (TAX), avec des images représentatives associées. Les membranes des fibres musculaires de type I (MyHC-1) sont marquées en rouge et les fibres de type IIa en vert (MyHC-IIa). *P < 0,05 ; **P < 0,01 ; ***P < 0,001. Cette figure est issue d’une publication de notre équipe de recherche (6).
Ainsi, en plus de l’exercice aérobie, l’exercice en résistance devrait être mis en place dès le début du traitement par EC.
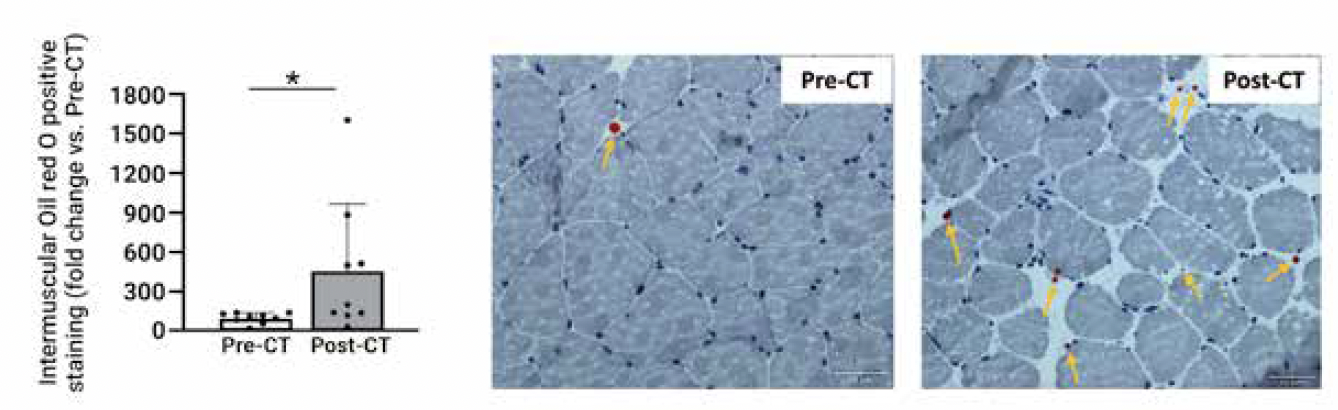
Un développement d’infiltrations graisseuses intermusculaires qui altère la capacité d’exercice et la production de force
Dans certains cas, l’atrophie musculaire peut s’accompagner d’un développement d’infiltrations graisseuses, caractérisé par la présence d’adipocytes entre les fibres musculaires. Nous avons montré que c’était également vrai pour les patientes atteintes d’un cancer du sein après un traitement par chimiothérapie (Fig. 4) (7), et que cela s’expliquait par une augmentation de la quantité de progéniteurs fibro-adipogéniques. Classiquement, ces infiltrations graisseuses, qui peuvent être prévenues par la pratique régulière d’exercice (aérobie ou résistance), sont associées à une baisse de force et une baisse de la capacité d’exercice, ce qui peut expliquer les altérations mises en évidence à la fin du traitement chez les patientes atteintes d’un cancer du sein.
Figure 4 – Modifications du contenu lipidique intermusculaire.
Marquage à l’huile rouge des fibres musculaires du vaste latéral issues de biopsies musculaires réalisées avant (pré) et après (post) l’ensemble du traitement par chimiothérapie (CT) chez des patientes atteintes d’un cancer du sein. *P < 0,05. Cette figure est issue d’une publication de notre équipe de recherche (7).
Une diminution de la capacité du système nerveux central à activer le muscle au cours d’un exercice en fin de traitement
En plus des altérations sur le plan de la qualité et de la quantité musculaires, des altérations en amont de la jonction neuromusculaire ont été mises en évidence par notre équipe de recherche chez des patientes atteintes d’un cancer du sein à l’issue du traitement par chimiothérapie, en comparaison à des sujets contrôles (8). En effet, au cours d’une tâche fatigante, nous avons montré que, en plus d’une capacité d’exercice plus faible, les patientes développaient une fatigue centrale caractérisée par une diminution plus importante de l’activation volontaire du système nerveux central. Cette altération pourrait être améliorée par la répétition d’un stimulus mécanique intense (e.g. exercice en résistance) au niveau musculaire, bien que des preuves soient encore nécessaires. D’autre part, au niveau mécanistique, l’origine de cette fatigue centrale à l’exercice pourrait provenir d’une exacerbation des afférences de type III-IV (i.e. feedback des muscles vers le système nerveux central), ce que nous sommes en train d’étudier.
Un stimulus métabolique et mécanique induit par l’exercice est nécessaire pour améliorer la capacité d’exercice des patientes
Devant l’ensemble des altérations et des mécanismes évoqués ci-dessus, il semblerait qu’un exercice fondé sur un stimulus mécanique (i.e. une tension musculaire importante) et métabolique (i.e. une perturbation métabolique importante) soit nécessaire pour contrer la baisse de la capacité d’exercice.
Faisabilité et effets du pédalage concentrique et excentrique
Dans ce contexte, nous avons étudié la faisabilité de deux types de pédalage à intensité élevée chez des patientes atteintes d’un cancer du sein (9). Nous avons ainsi testé :
• d’une part une session de pédalage concentrique, c’est-à-dire le pédalage classique,
• et d’autre part une session de pédalage excentrique, fondé sur une action de freinage des pédales entraînées en arrière par un moteur à l’aide des quadriceps (Fig. 5).
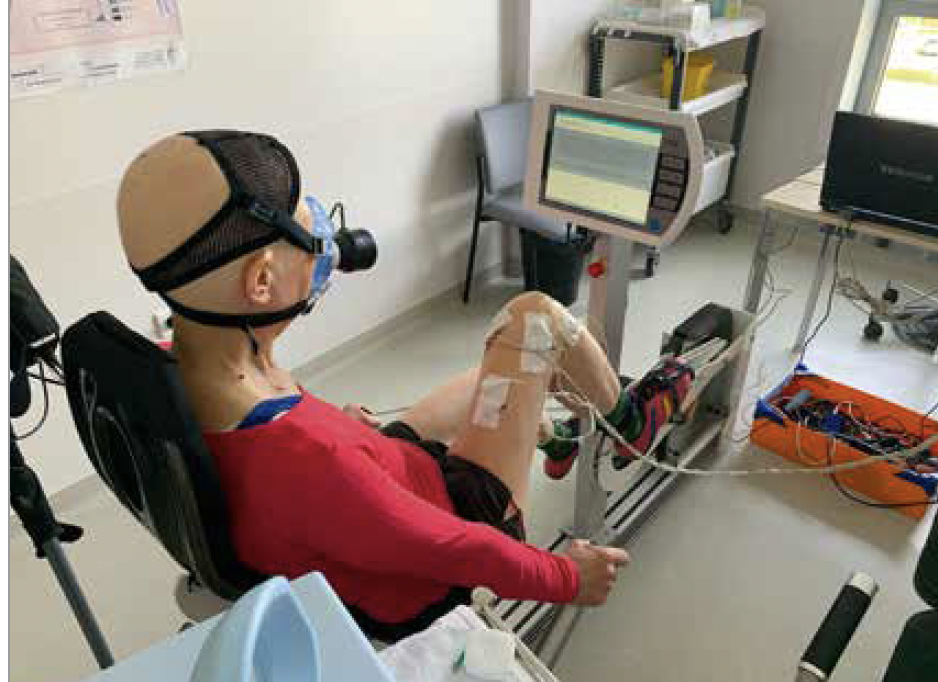
Figure 5 – Patiente atteinte d’un cancer du sein réalisant du pédalage excentrique dans le cadre d’une étude de recherche. Crédit photo : Elyse Hucteau
Au-delà d’avoir montré la faisabilité de ces deux types de pédalage, nous avons montré que le pédalage concentrique induisait un stimulus métabolique important tandis que le pédalage excentrique se caractérisait par un stimulus mécanique élevé, permettant de solliciter le muscle de manière importante à faible coût énergétique.
Faisabilité et effets d’un entraînement chronique à distance de l’arrêt des traitements
Si cette étude s’intéressait aux réponses aiguës du pédalage concentrique et excentrique (i.e. après une seule session), nous avons ensuite testé la faisabilité d’un entraînement chronique fondé sur ces deux types d’exercice à distance de l’arrêt des traitements. Bien que ces données ne soient pas encore publiées, nous avons montré des améliorations globales de la capacité d’exercice, aussi bien au niveau musculaire que cardiorespiratoire.
Faisabilité d’un entraînement chronique pendant le traitement par chimiothérapie
À ce jour, nous avons lancé un essai randomisé contrôlé multicentrique avec l’ICANS et le CH de Colmar pour tester l’efficacité d’un entraînement fondé sur ces types de pédalage pendant le traitement par chimiothérapie. La première étape de ce projet consiste à mesurer les effets du pédalage concentrique seul par rapport à l’absence d’exercice (i.e. prise en charge standard), pour ensuite comparer les effets de chaque type de pédalage (concentrique vs excentrique). L’un des caractères novateurs de cette étude est la fréquence des séances d’exercice. En effet, si les recommandations actuelles sont fondées sur la réalisation de plusieurs séances d’entraînement par semaine, la réalité clinique nous a amenés à tester l’effet d’une seule séance de pédalage par semaine, afin d’améliorer le taux d’adhésion des patientes. De plus, d’après nos résultats préliminaires, cette séance d’intensité élevée se révèle efficace pour améliorer la capacité d’exercice.
Si cette tendance est confirmée à la fin de l’étude, cela pourrait aboutir à un changement de paradigme sur les recommandations de pratique d’exercice pendant les traitements par chimiothérapie.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Mallard J, Hucteau E, Hureau TJ, Pagano AF. Skeletal muscle deconditioning in breast cancer patients undergoing chemotherapy: current knowledge and insights from other cancers. Front Cell Dev Biol 2021 ; 9 : 719643.
2. Peel AB, Thomas SM, Dittus K et al. Cardiorespiratory fitness in breast cancer patients: a call for normative values. J Am Heart Assoc 2014 ; 3 : e000432.
3. Mallard J, Hucteau E, Schott R et al. Early skeletal muscle deconditioning and reduced exercise capacity during (neo)adjuvant chemotherapy in patients with breast cancer. Cancer 2023 ; 129 : 215‑25.
4. Schmitz KH, Campbell AM, Stuiver MM et al. Exercise is medicine in oncology: Engaging clinicians to help patients move through cancer. CA Cancer J Clin 2019 ; 69 : 468‑84.
5. Mallard J, Hucteau E, Charles AL et al. Chemotherapy impairs skeletal muscle mitochondrial homeostasis in early breast cancer patients. J Cachexia Sarcopenia Muscle 2022 ; 13 : 1896‑907.
6. Mallard J, Hucteau E, Bender L et al. A single chemotherapy administration induces muscle atrophy, mitochondrial alterations and apoptosis in breast cancer patients. J Cachexia Sarcopenia Muscle 2024 ; 15 : 292‑305.
7. Mallard J, Hucteau E, Bender L et al. Development of skeletal muscle atrophy and intermuscular adipose tissue in patients with early breast cancer treated with chemotherapy. Am J Physiol Cell Physiol 2022 ; 323 : C1325‑32.
8. Hucteau E, Mallard J, Pivot X et al. Exacerbated central fatigue and reduced exercise capacity in early-stage breast cancer patients treated with chemotherapy. Eur J Appl Physiol 2023 ; 123 : 1567‑81.
9. Hucteau E, Mallard J, Barbi C et al. Impact of eccentric versus concentric cycling exercise on neuromuscular fatigue and muscle damage in breast cancer patients. Med Sci Sports Exerc 2024 ; 56 : 2103‑16.