L’essentiel en un clin d’œil
Le congrès de l’ASCO 2024 a mis en avant de nombreuses études en oncologie thoracique, en particulier pour les situations d’addiction oncogénique, avec plusieurs résultats d’essais de phase II prometteurs en termes de nouvelles options thérapeutiques, possiblement applicables en France avec les nombreux essais cliniques ouverts et les accès compassionnels possibles. Pour cette sélection, nous avons retenu les résultats des essais randomisés impactant rapidement nos algorithmes thérapeutiques.
TOP 1 – ADRIATIC : durvalumab en consolidation après chimio-radiothérapie des cancers bronchiques à petites cellules limités au thorax
Le standard de prise en charge pour les patients atteints de cancer bronchique à petites cellules (CBPC) de stade limité est une chimio-radiothérapie concomitante à base de platine et une irradiation crânienne prophylactique (ICP).
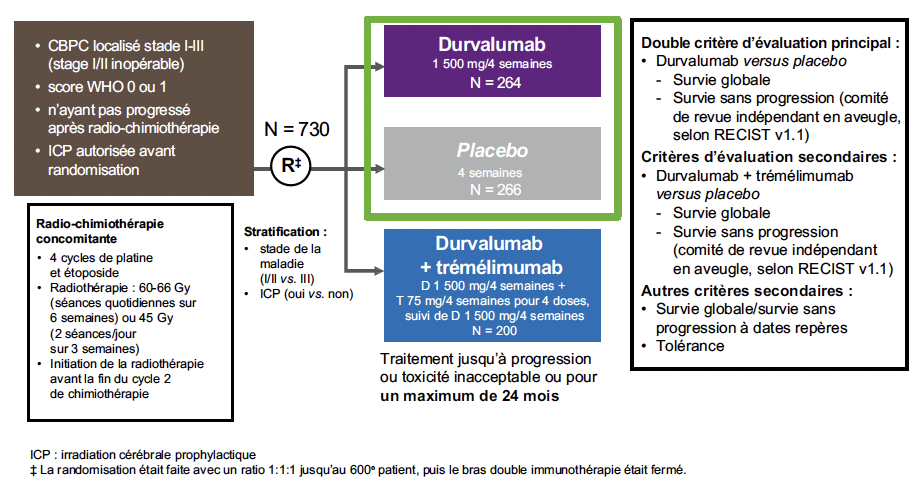
L’étude ADRIATIC
ADRIATIC est une étude de phase III, randomisée, en double aveugle, contrôlée contre placebo, qui a évalué le durvalumab associé ou non au trémélimumab comme traitement de consolidation pour les patients qui n’ont pas progressé après la chimio-radiothérapie. Le traitement était poursuivi pendant 2 ans, en l’absence de progression tumorale ou de toxicité (Fig. 1).
Figure 1 – ADRIATIC : schéma de l’étude.
Les critères de jugement étaient la survie globale (SG) et la survie sans progression (SSP).
Les patients
Au total, 730 patients ont été randomisés, dont 264 pour le traitement de consolidation par durvalumab, et 266 pour le placebo. Les caractéristiques des patients étaient équilibrées dans les deux groupes ; la radiothérapie avait été administrée en fractionnement quotidien pour plus de 70 % des patients dans les deux bras, et 54 % des patients avaient reçu une ICP.
Les résultats
Les résultats montrent que la SG et la SSP ont été significativement améliorées avec le traitement de consolidation par durvalumab.
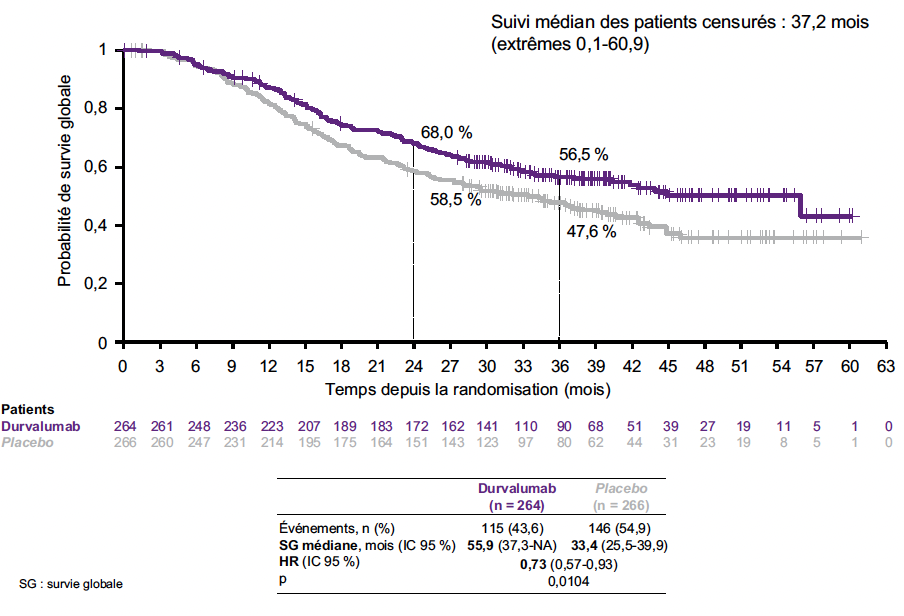
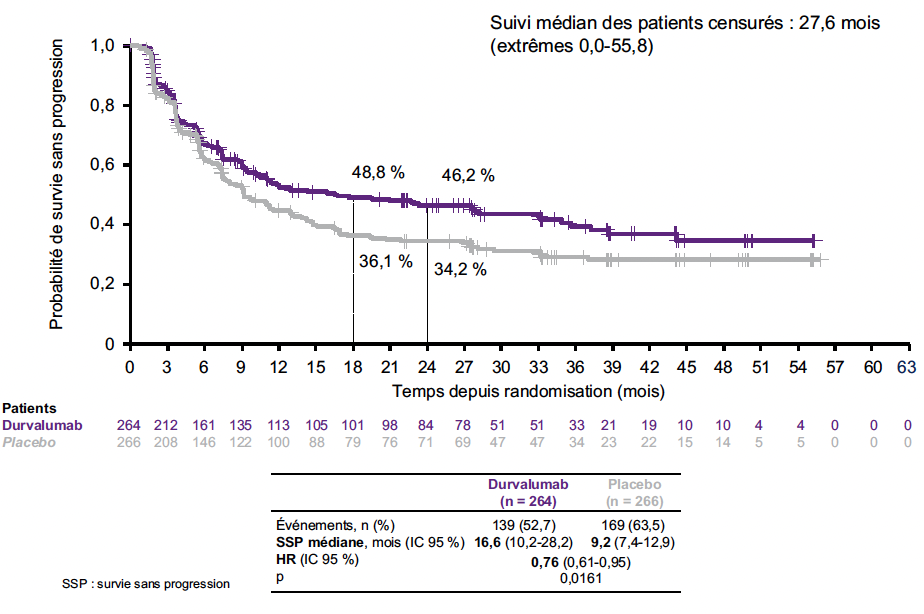
La réduction du risque de décès avec le durvalumab était de 27 % (HR = 0,73 ; IC 95 % : 0,57-0,93 ; p = 0,0104), avec une médiane de SG à 55,9 versus 33,4 mois pour les patients ayant reçu le placebo (Fig. 2). La réduction du risque de progression était de 24 % (HR = 0,76 ; IC 95 % : 0,61-0,95 ; p = 0,0161), avec une médiane de SSP pour les patients ayant reçu le durvalumab de 16,6 versus 9,2 mois pour ceux ayant reçu le placebo (Fig. 3).
Figure 2 – ADRIATIC : survie globale.
Figure 3 – ADRIATIC : survie sans progression.
Tolérance
Le risque de pneumopathie radique était respectivement 38 versus 30 %, avec des taux inférieurs à 3 % pour les événements de grade 3 ou 4.
À retenir
Au total, ces résultats sont de nature à modifier le standard de prise en charge des patients atteints de cancer bronchique à petites cellules de stade limité, avec l’introduction de la consolidation par durvalumab.
• Spigel DR, Cheng Y, Cho BC et al. ADRIATIC: durvalumab (D) as consolidation treatment (tx) for patients (pts) with limited-stage small-cell lung cancer (LS-SCLC). J Clin Oncol 2024 ; 42 : abstr. LBA5.
TOP 2 – LAURA : osimertinib en situation de consolidation après chimio-radiothérapie des cancers bronchiques non à petites cellules localement avancés non résécables EGFR+
Pour les patients atteints de cancer bronchique non à petites cellules (CBNPC) localement avancé non résécable, le standard de prise en charge repose sur la chimio-radiothérapie suivie d’une consolidation par le durvalumab de consolidation pendant 1 an, selon le schéma PACIFIC (1). Le bénéfice de l’immunothérapie de consolidation n’était pas spécifiquement retrouvé pour les patients atteints d’un cancer avec mutation commune de l’EGFR (2).
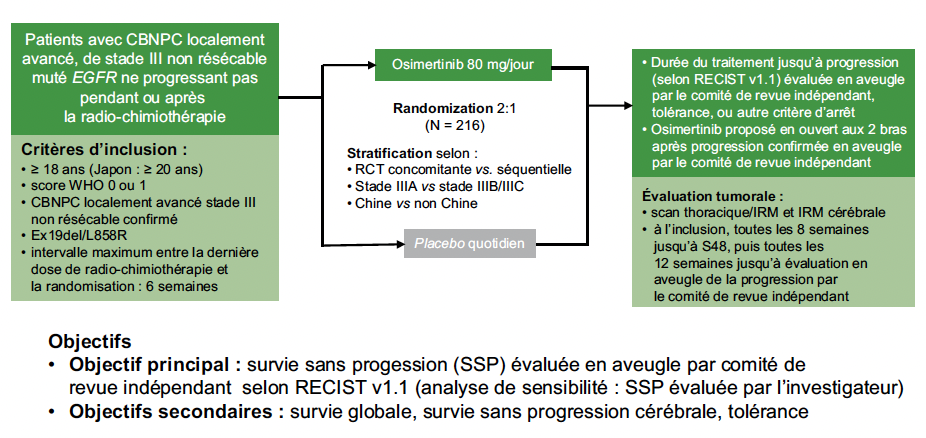
L’étude LAURA
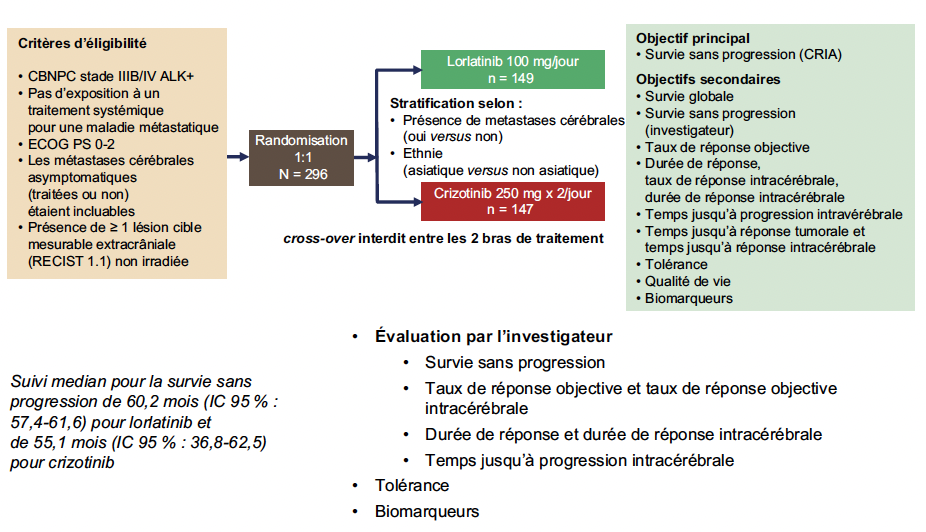
L’essai LAURA s’est ainsi intéressé à évaluer un traitement de consolidation par osimertinib dans cette population (3). L’essai était randomisé en double aveugle contre placebo, avec une randomisation après chimio-radiothérapie séquentielle ou concomitante, et la poursuite de l’osimertinib ou du placebo jusqu’à progression ou toxicité. L’évaluation, contrairement à ce qui avait été proposé dans l’essai PACIFIC, comportait un scanner et des imageries par résonnance magnétique cérébrales systématiques, compte tenu de la propension de ces tumeurs à récidiver dans le système nerveux central. Le critère de jugement principal était la survie sans progression (Fig. 4).
Figure 4 – LAURA : schéma de l’étude.
Les résultats
Au total, 216 patients ont été randomisés, 143 dans le groupe osimertinib, et 73 dans le groupe placebo.
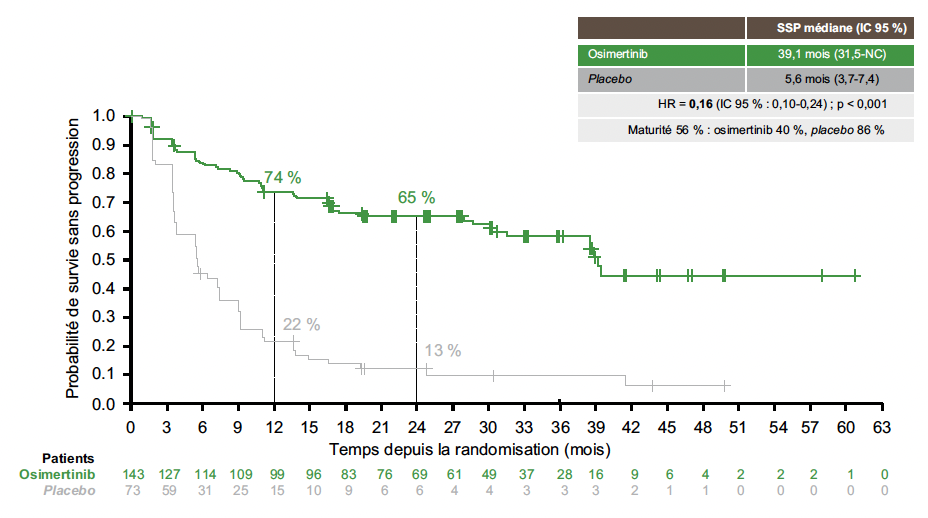
Les résultats montrent un bénéfice de l’osimertinib en termes de SSP (HR = 0,16 ; IC 95 % : 0,10-0,24 ; p < 0,001), avec une médiane respectivement de 39,1 versus 5,6 mois (Fig. 5).
Figure 5 – LAURA : survie sans progression.
L’analyse intermédiaire de la SG était limitée par la faible maturité des données, mais il existait une tendance en faveur de l’osimertinib (HR = 0,81 ; IC 95 % : 0,42-1,56 ; p = 0,530).
Tolérance
Des événements indésirables de grade 3 ont été observés chez 35 % des patients ayant reçu l’osimertinib, et 12 % de ceux ayant reçu le placebo, conduisant à l’arrêt du traitement dans respectivement 13 versus 5 % des cas.
À retenir
Au total, des données en ligne avec celles observées après chirurgie d’un cancer bronchique non à petites cellules avec mutation commune de l’EGFR avec l’osimertinib en adjuvant pendant 3 ans, dans le cadre de l’essai ADAURA. L’étude LAURA montre un bénéfice majeur en termes de réduction du risque de rechute, notamment au niveau cérébral, et comme dans l’essai ADAURA, ceci est de nature à intégrer la consolidation par osimertinib comme standard de traitement dans cette situation.
• Ramalingam SS, Kato T, Dong X et al. Osimertinib (osi) after definitive chemoradiotherapy (CRT) in patients (pts) with unresectable stage (stg) III epidermal growth factor receptor-mutated (EGFRm) NSCLC: Primary results of the phase 3 LAURA study. J Clin Oncol 2024 ; 42 : abstr. LBA4.
1. Faivre-Finn C, Vicente D, Kurata T et al. Four-year survival with durvalumab after chemoradiotherapy in stage III NSCLC-an update from the PACIFIC trial. J Thorac Oncol 2021 ; 16 : 860-7.
2. Naidoo J, Antonia S, Wu YL et al. Brief report: durvalumab after chemoradiotherapy in unresectable stage III EGFR-mutant NSCLC: a post hoc subgroup analysis from PACIFIC. J Thorac Oncol 2023 ; 18 : 657-63.
3. Lu S, Kato T, Dong X et al. Osimertinib after chemoradiotherapy in stage III EGFR-mutated NSCLC. N Engl J Med 2024 ; Online ahead of print.
TOP 3 – CROWN : lorlatinib en première ligne des cancers bronchiques non à petites cellules ALK+, données à 5 ans
Le lorlatinib est un inhibiteur de troisième génération d’ALK ciblant des mutations de résistance survenant sous inhibiteurs de première ou de seconde génération. Il est actuellement disponible en France en cas de progression sous inhibiteurs d’ALK de seconde génération, et dès la première ligne thérapeutique, sur la base de l’essai CROWN, précédemment rapporté.
L’étude CROWN
Cette étude de phase III a comparé en première ligne le lorlatinib (100 mg/j) au crizotinib (250 mg 2 x/j) chez 296 patients CBNPC ALK+ de stades avancés ou métastatiques non pré-traités (4) (Fig. 6). Les métastases cérébrales asymptomatiques, traitées ou non, étaient autorisées.
Figure 6 – CROWN : schéma de l’étude.
Les résultats
L’étude était positive sur son critère de jugement principal qui est la SSP évaluée par une revue centralisée indépendante, avec une réduction du risque de progression de 72 % dans le groupe lorlatinib comparativement au groupe crizotinib (HR = 0,28 ; IC 95 % : 0,19-0,41 ; p < 0,001). Ce bénéfice était observé dans tous les sous-groupes de patients. Le risque d’effets secondaires de grade 3-4 était supérieur dans le groupe lorlatinib (72 contre 56 % avec le crizotinib), d’ordre essentiellement biologique (hypertriglycéridémie, hypercholestérolémie). Des troubles cognitifs sont rapportés avec le lorlatinib nécessitant une vigilance particulière. Les taux d’arrêt de traitement étaient respectivement de 7 et 9 % dans le groupe crizotinib.
Données actualisées à 5 ans
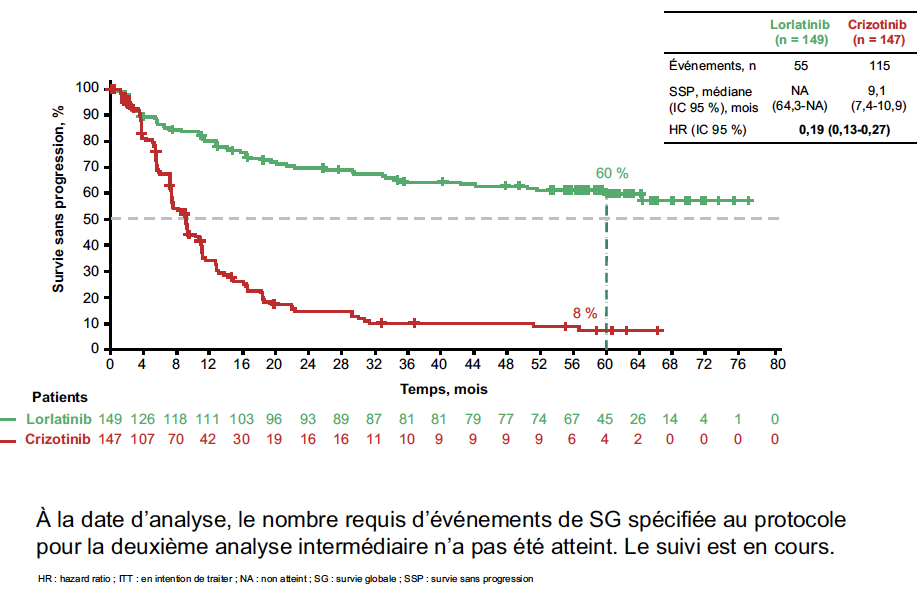
Lors du congrès, les données actualisées de l’essai ont été présentées, après 5 ans de suivi médian dans le groupe lorlatinib. La SSP médiane n’était toujours pas atteinte dans le bras lorlatinib, et était de 9,1 mois avec le crizotinib (HR = 0,19 ; IC 95 % : 0,13-0,27). La SSP à 5 ans était de 60 % avec le lorlatinib et de 8 % avec le crizotinib (Fig. 7).
Figure 7 – CROWN : survie sans progression.
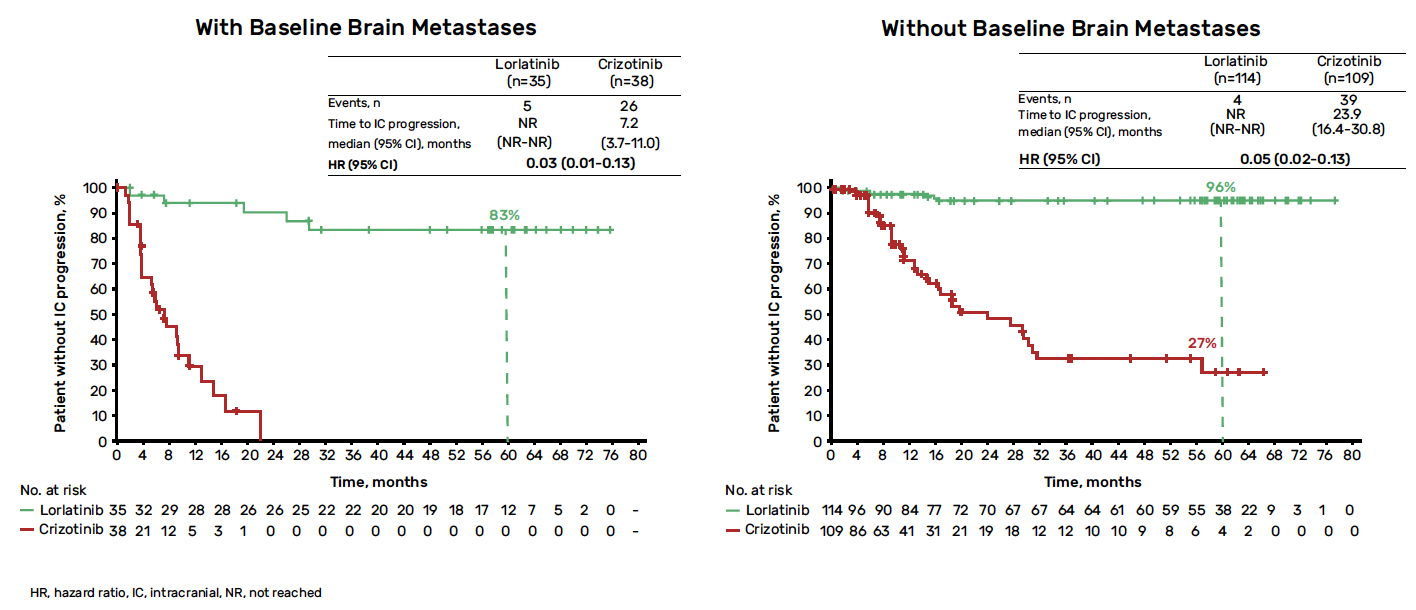
Le temps médian jusqu’à la progression intracérébrale était non atteint avec le lorlatinib et de 16,4 mois avec le crizotinib (HR = 0,06 ; IC 95 % : 0,03-0,12). Dans le groupe lorlatinib, seuls quatre des 114 patients n’ayant pas de métastases cérébrales au diagnostic ont développé une progression cérébrale, survenue au cours des 16 premiers mois de traitement (Fig. 8).
Figure 8 – CROWN : progression selon la présence de métastases ou non au diagnostic.
À retenir
Ces résultats confortent le lorlatinib comme traitement préférentiel de première ligne en situation de cancer bronchique non à petites cellules avec réarrangement d’ALK, compte tenu de la durée de son efficacité, la plus longue jamais rapportée avec une thérapie ciblée dans les cancers bronchiques, et de son effet protecteur des progressions cérébrales.
• Solomon BL, Liu G, Felip E et al. Lorlatinib vs crizotinib in treatment-naïve patients with advanced ALK+ non-small cell lung cancer: 5-year progression-free survival and safety from the CROWN study. J Clin Oncol 2024 ; 42 : abstr. LBA8503.
4. Solomon BJ, Liu G, Felip E et al. Lorlatinib versus crizotinib in patients with advanced ALK-positive non-small cell lung cancer: 5-year outcomes from the phase III CROWN study. J Clin Oncol 2024 : JCO2400581.
TOP 4 – KRYSTAL-12 : adagrasib en seconde ligne des cancers bronchiques non à petites cellules KRAS+
En situation de CBNPC avec mutation de KRAS de type G12C, le sotorasib, un inhibiteur spécifique de cette mutation, avait montré sa supériorité au docétaxel en seconde ligne thérapeutique, dans l’essai CODEBREAK-200 (5) ; l’évaluation par la Haute Autorité de santé de cette étude n’a pas permis d’obtenir sa commercialisation en France. L’adagrasib est également un inhibiteur covalent de KRASG12C, qui avait montré, dans l’étude de phase I/II KRYSTAL-1, son efficacité avec des réponses profondes et durables en situation de CBNPC avancé avec mutation de KRAS G12C.
L’étude KRYSTAL-12
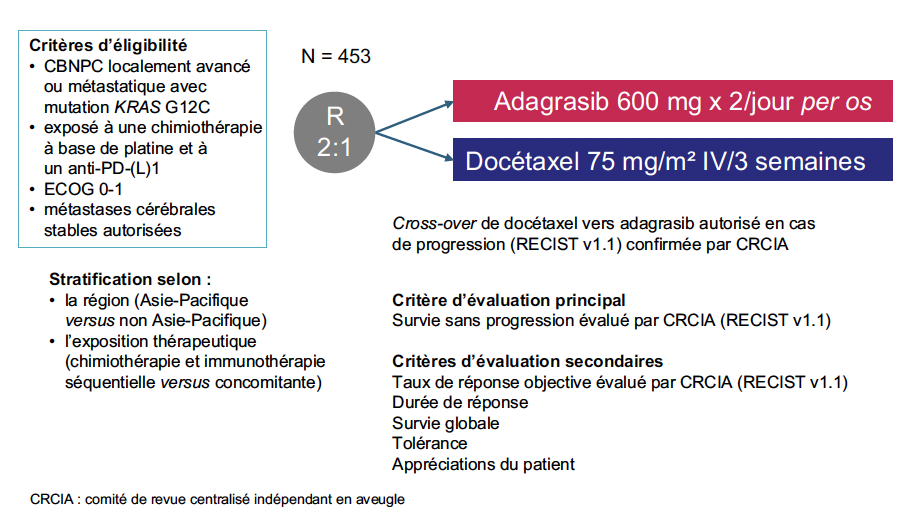
L’étude KRYSTAL-12 est l’essai de phase III randomisé et ouvert comparant l’adagrasib au docétaxel dans cette situation, après traitement de première ligne avec une chimiothérapie à base de platine, associée de façon concomitante ou séquentielle avec une immunothérapie ciblant PD-1 ou PD-L1. L’essai comportait la possibilité de cross-over vers l’adagrasib en cas de progression dans le bras contrôle. Le critère de jugement principal était la SSP (Fig. 9).
Figure 9 – KRYSTAL-12 : schéma de l’étude.
Les résultats
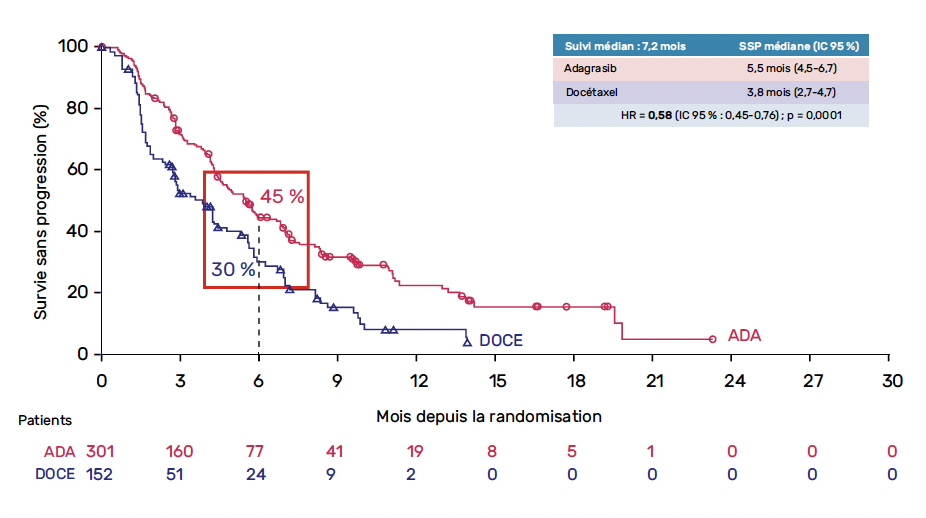
Au total, 301 patients ont été randomisés, et, après un suivi médian de 9,4 mois, la SSP médiane était significativement supérieure avec l’adagrasib – 5,5 mois – par rapport au docétaxel – 3,8 mois – (HR = 0,58 ; IC 95 % : 0,45-0,76 ; p = 0,0001) (Fig. 10). Le taux de réponse était de 32 % avec l’adagrasib, et de 9 % avec le docétaxel.
Figure 10 – KRYSTAL-12 : survie sans progression.
Tolérance
Les profils de tolérance étaient très différents entre les deux agents : hématologiques et neurologiques avec le docétaxel, hépatiques et digestifs avec l’adagrasib. L’adagrasib a été arrêté pour effet indésirable chez 7,7 % des patients.
À retenir
Au total, ces données montrent l’efficacité de l’adagrasib en situation de cancer bronchique non à petites cellules avec mutation de KRAS G12C en seconde ligne thérapeutique, situation dans laquelle il est disponible dans le cadre d’un accès précoce compassionnel en France.
• Mok T, Yao W, Duruisseaux M et al. KRYSTAL-12: phase 3 study of adagrasib versus docetaxel in patients with previously treated advanced/metastatic non-small cell lung cancer (NSCLC) harboring a KRASG12C mutation. J Clin Oncol 2024 ; 42 : abstr. LBA8509.
5. de Langen AJ, Johnson ML, Mazieres J et al. Sotorasib versus docetaxel for previously treated non-small-cell lung cancer with KRASG12C mutation: a randomised, open-label, phase 3 trial. Lancet 2023 ; 401 : 733-46.
TOP 5 – MARIPOSA, PALOMA-2 : amivantamab et lazertinib en première ligne des cancers bronchiques non à petites cellules EGFR+
L’étude MARIPOSA
L’amivantamab est un anticorps bispécifique EGFR-MET, qui a été associé au lazertinib, un inhibiteur de tyrosine kinase EGFR de troisième génération, en première ligne thérapeutique des CBNPC avec mutation commune de l’EGFR, dans le cadre de l’essai MARIPOSA.
Au total, 1 074 patients ont été randomisés avec un ratio de 2:2:1 pour recevoir cette association, l’osimertinib, ou le lazertinib seul. Le critère de jugement principal était la SSP de l’association amivantamab et lazertinib par rapport à l’osimertinib, par un comité de revue centralisé.
Les résultats
Après un suivi médian de 22 mois, l’association amivantamab-lazertinib a montré une réduction de 30 % du risque de progression de la maladie ou de décès par rapport à l’osimertinib seul (HR = 0,70 ; IC 95 % : 0,58-0,85 ; p < 0,001), avec une SSP médiane de 23,7 mois (IC 95 % : 19,1-27,7) contre 16,6 mois (IC 95 % : 14,8-18,5). Les effets indésirables liés à l’inhibition de l’EGFR et de MET étaient plus élevés pour l’association, à l’exception de la diarrhée, qui était plus fréquente chez les patients traités par osimertinib. Les événements thromboemboliques étaient plus nombreux, principalement de grade 1-2, pendant les premiers mois de traitement et gérés efficacement avec des anticoagulants.
Patients de mauvais pronostic
Lors du congrès, les données dans les sous-groupes de patients de mauvais pronostic ont été présentées : patients avec métastases cérébrales, hépatiques, co-mutation de TP53 dans la tumeur, détection d’ADN tumoral circulant au diagnostic. Les résultats indiquent un bénéfice de SSP d’amplitude similaire à celle observée dans la population globale de l’essai, pour tous les sous-groupes, et donc la difficulté à identifier des situations cliniques dans lesquelles cette association serait à prioriser ou non par rapport à l’osimertinib ou par rapport à l’association osimertinib et chimiothérapie.
L’étude PALOMA-2
L’étude PALOMA-2 est un essai de phase II évaluant l’amivantamab par voie sous-cutanée, dans une situation clinique identique à celle de l’essai MARIPOSA, dans deux cohortes comportant une anticoagulation prophylactique pendant les 4 premiers mois de traitement pour 126 patients.
Les résultats
Les taux de réponse étaient identiques à ceux rapportés dans l’essai MARIPOSA, la pharmacocinétique satisfaisante, et les taux de réaction à la perfusion réduits à 11 % dans la cohorte la plus récente, avec une réduction du risque de thrombose par rapport aux essais historiques.
À retenir
Ces données sont en lignes avec celles de l’essai randomisé de phase III PALOMA-3, en ligne avancée, avec l’association amivantamab par voie sous-cutanée ou intraveineuse et lazertinib, montrant une pharmacocinétique non inférieure avec l’administration par voie sous-cutanée, et une efficacité numériquement supérieure.
• Felip E, Cho BC, Gutierrez V et al. Amivantamab plus lazertinib vs osimertinib in first-line EGFR-mutant advanced non-small cell lung cancer (NSCLC) with biomarkers of high-risk disease: A secondary analysis from the phase 3 MARIPOSA study. J Clin Oncol 2024 ; 42 : abstr. 8504.
• Lim SM, Tan JL, Dias JM et al. Subcutaneous amivantamab and lazertinib as first-line treatment in patients with EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Results from the phase 2 PALOMA-2 study. J Clin Oncol 2024 ; 42 : abstr. LBA8612.
• Leighl N, Akamatsu H, Lim SM et al. Subcutaneous amivantamab vs intravenous amivantamab, both in combination with lazertinib, in refractory EGFR-mutated, advanced non-small cell lung cancer (NSCLC): Primary results, including overall survival (OS), from the global, phase 3, randomized controlled PALOMA-3 trial. J Clin Oncol 2024 ; 42 : abstr. 8505.
En conclusion, le congrès de l’ASCO 2024 ouvre de nouvelles voies pour des stratégies thérapeutiques optimisées dans de nombreuses situations cliniques. Le rendez-vous est donné pour les congrès à venir World Conference on Lung Cancer et de l’European Society for Medical Oncology en septembre.
Nicolas Girard déclare avoir des liens d’intérêt avec Abbvie, Amgen, AstraZeneca, BeiGene, Boehringer Ingelheim, BMS, Daiichi Sankyo, Eli Lilly, Gilead, Hoffmann-La Roche, Ipsen, Janssen, Leo Pharma, Medtronic, Merck, Merck Sharp & Dohme, Novartis, Pfizer, Sanofi, Sivan et Takeda.