L’essentiel en un clin d’œil
Cette année, l’actualité en onco-urologie a semblé marquer un temps de pause, comme pour se remettre de plusieurs congrès successifs où de nombreuses études majeures ont vu bousculer nos pratiques. La recherche clinique passe obligatoirement par ces temps d’introspection, mais on devine déjà de nouvelles pistes prometteuses se dessiner dans les prochains mois !
TOP 1 – KIM-1 : un biomarqueur circulant pertinent dans la prise en charge adjuvante du cancer du rein ?
L’étude KEYNOTE-564 a récemment montré qu’un traitement adjuvant pembrolizumab pendant 1 an permettait pour la première fois d’obtenir un bénéfice significatif en survie globale (SG) dans une population sélectionnée de patients atteints d’un carcinome rénal opéré et à risque non négligeable de récidive (1). Cette stratégie devrait donc tout naturellement s’imposer comme un nouveau standard dans les prochains mois. Les données de cette étude majeure restaient toutefois contradictoires avec plusieurs essais réalisés dans le même cadre, dont CheckMate 914 (2) et IMmotion010. Au-delà d’essayer d’expliquer ces résultats contrastés avec des traitements et des stratégies différentes, il convient surtout d’identifier quel patient doit réellement bénéficier d’un traitement adjuvant (56,6 % des malades de l’étude KEYNOTE-564 n’ont pas récidivé sous placebo), les systèmes pronostiques (UISS, score de Leibovitch…) paraissant désormais obsolètes à l’ère de la médecine personnalisée. Il paraît donc indispensable d’identifier un biomarqueur pertinent pour clarifier l’intérêt de l’immunothérapie adjuvante et d’éclairer la prise de décision. Ce raisonnement a fait l’objet d’une présentation de Laurence Albiges lors du congrès de l’ASCO concernant la valeur prédictive et pronostique d’un biomarqueur circulant KIM-1 évaluée sur une analyse exploratoire et rétrospective de l’essai IMmotion010.
L’étude IMmotion010
On rappelle que l’étude IMmotion010, évaluant l’efficacité et la tolérance d’un traitement adjuvant par atézolizumab (versus placebo) chez des patients atteints d’un carcinome rénal opéré à haut risque de récidive, n’avait pas montré de diminution significative du risque de rechute avec une médiane de survie sans progression (SSP) de 57,2 mois dans le bras immunothérapie versus 49,5 mois dans le bras placebo (HR = 0,93 ; IC 95 % : 0,75-1,15 ; p = 0,50) (3). Une analyse rétrospective protéomique fondée sur l’exploration de plus de 3 000 échantillons biologiques a permis d’identifier, de quantifier et de caractériser, à un instant T, un certain nombre de protéines d’intérêt. Certaines présentaient des profils d’abondance différents sur les échantillons à l’inclusion et ceux réalisés lors de la récidive de la maladie (n = 73).
KIM-1
KIM-1, une glycoprotéine transmembranaire, présentait le différentiel le plus significatif lors de la récidive par rapport à sa valeur initiale. Elle avait déjà été identifiée comme un biomarqueur potentiel du carcinome rénal à cellules claires, notamment dans l’essai ASSURE évaluant le sunitinib ou le sorafénib en situation adjuvante où les taux plasmatiques préthérapeutiques les plus élevés de KIM-1 au décours de la chirurgie semblaient associés à un pronostic plus péjoratif en termes de SSP et de SG. Concernant l’étude IMmotion010, des tests d’électrochimiluminescence évaluaient les taux de KIM-1 sur les échantillons plasmatiques disponibles à l’inclusion et au moment de la récidive de la maladie. Parmi les 778 patients inclus, 752 (97 %) présentaient un taux plasmatique de KIM-1 exploitable de baseline (taux élevé chez 300 patients et faible chez 452).
Les résultats
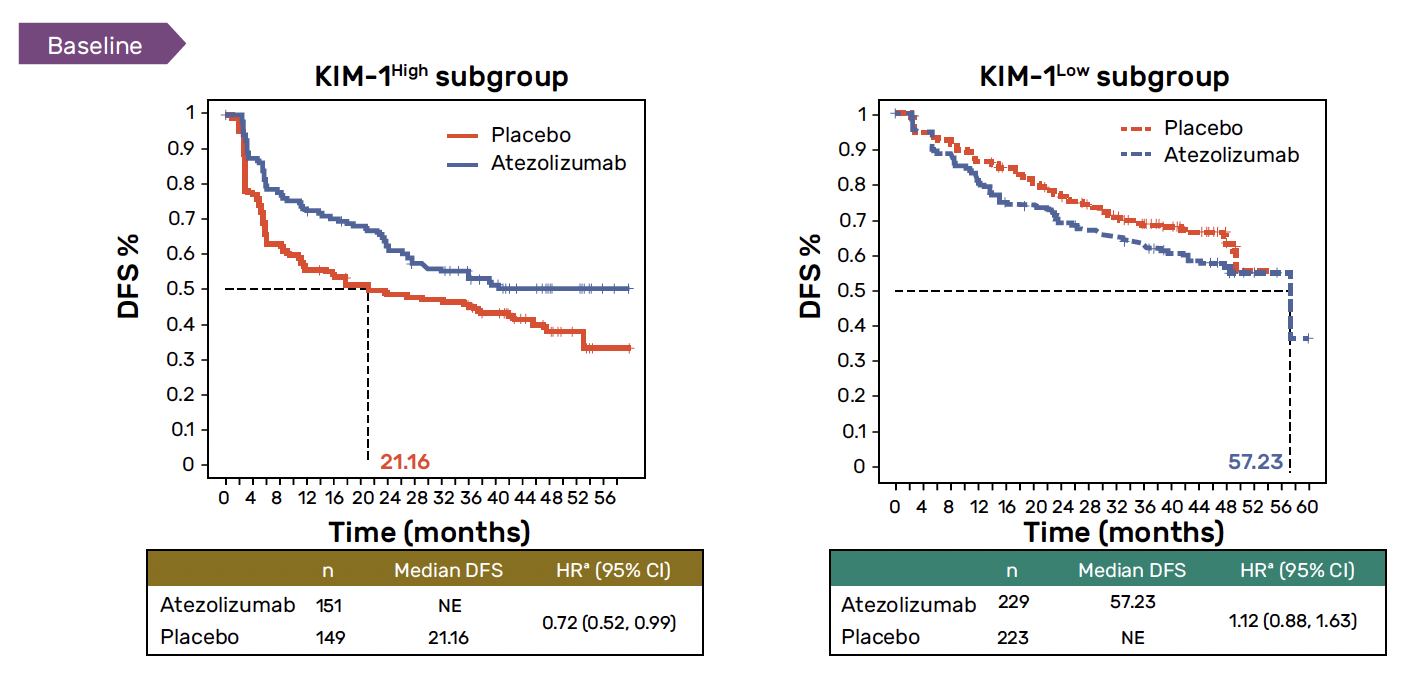
Il a été confirmé qu’un taux de KIM-1 élevé était associé à un risque de récidive de la maladie plus précoce avec une médiane de survie sans récidive de 35,8 contre 57,2 mois chez les patients avec un taux plasmatique de KIM-1 plus faible (HR = 1,75 ; IC 95 % : 1,40-2,17). De plus, il semblerait qu’un taux plasmatique de KIM-1 soit également associé à un bénéfice plus important en termes de survie sans maladie (SSM) chez les patients recevant un traitement adjuvant par atézolizumab (versus placebo) (HR = 0,72 ; IC 95 % : 0,52-0,99) (Fig. 1). Dans ce sous-groupe, les malades étaient moins susceptibles de présenter une augmentation du taux de KIM-1 lors de leur suivi après un traitement par immunothérapie. Enfin, il a été prouvé qu’une augmentation ≥ 30 % du taux plasmatique était également associée à une SSM plus faible quel que soit le taux de KIM-1, indépendamment du traitement reçu.
Figure 1 – IMmotion010 : données de survie sans récidive chez les patients recevant un traitement adjuvant par atézolizumab en fonction du taux plasmatique de KIM-1.
À retenir
L’identification du biomarqueur idéal se poursuit. Il sera aussi question de son accessibilité, sa reproductibilité et son coût. Néanmoins, cette analyse exploratoire de l’étude IMmotion010 semble démontrer l’intérêt pronostique et prédictif de réponse à un traitement adjuvant par immunothérapie de KIM-1. Cette protéine circulante pourrait donc potentiellement devenir un biomarqueur de routine dans le diagnostic et le suivi des patients atteints d’un carcinome rénal. Ces données devront être confirmées de manière prospective.
• Albiges L, Bex A, Suarez C et al. Circulating kidney injury molecule-1 (KIM-1) biomarker analysis in IMmotion010: A randomized phase 3 study of adjuvant (adj) atezolizumab (atezo) vs placebo (pbo) in patients (pts) with renal cell carcinoma (RCC) at increased risk of recurrence after resection.
J Clin Oncol 2024 ; 42 : abstr. 4506.
1. Choueiri TK, Tomczak P, Park SH et al. Overall survival with adjuvant pembrolizumab in renal-cell carcinoma. N Engl J Med 2024 ; 390 : 1359-71.
2. Motzer RJ, Russo P, Grünwald V et al. Adjuvant nivolumab plus ipilimumab versus placebo for localised renal cell carcinoma after nephrectomy (CheckMate 914): a double-blind, randomised, phase 3 trial. Lancet 2023 ; 401 : 821-32.
3. Pal SK, Uzzo R, Karam JA et al. Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2022 ; 400 : 1103-16.
TOP 2 – CYCLONE 2 (phase II) : pas de place pour l’abémaciclib en association avec l’acétate d’abiratérone au stade mCRPC !
Plusieurs voies de recherche sont actuellement en développement afin d’améliorer encore la prise en charge thérapeutique des patients atteints de cancer de la prostate métastatique en phase de résistance à la castration (mCRPC) (6 900 cas/an), dont les mécanismes sont multifactoriels et hétérogènes. Parmi elles, on note les thérapies ciblant la régulation du cycle cellulaire comme les inhibiteurs de CDK4/6. En effet, des preuves précliniques suggèrent un rôle clé de CDK4/6 dans la voie de signalisation aux récepteurs aux androgènes, la prolifération incontrôlée et la résistance hormonale dans le cancer de la prostate. Dans ce contexte, l’abémaciclib, un inhibiteur oral de CDK4/6, déjà validé dans le cancer du sein à haut risque à un stade précoce et métastatique, pouvait également trouver sa place chez l’homme avec la présentation des premières données de l’étude CYCLONE 2 au stade mCRPC.
L’étude CYCLONE 2
CYCLONE 2 était un essai adaptatif de phase II/III randomisé en double aveugle évaluant l’efficacité et la tolérance d’un traitement associant l’abémaciclib et acétate d’abiratérone + prednisone en comparaison avec l’abiratérone + prednisone et un placebo chez les patients atteints d’un mCRPC non préalablement traité par une hormonothérapie de nouvelle génération (NHT) à un stade plus précoce. L’utilisation d’une chimiothérapie par docétaxel au stade mHSPC était autorisée.
Le critère de jugement principal était la SSP radiographique évaluée par l’investigateur (selon RECIST v1.1 et PCWG3) en ITT. L’analyse était stratifiée en fonction de l’utilisation préalable d’une chimiothérapie par docétaxel, du caractère mesurable de la maladie et de progression radiographique au début de l’étude. Les critères secondaires étaient la SSP radiographique après une relecture centralisée indépendante en aveugle (BICR), la SG, le taux de réponse objective, la durée de réponse, le délai jusqu’à progression symptomatique, le délai jusqu’à progression du temps de PSA et les données de tolérance ou pharmacocinétiques.
Les résultats
Entre novembre 2018 et juillet 2022, 393 patients ont été randomisés (206 dans le bras abémaciclib et 187 dans le bras placebo) avec des caractéristiques homogènes dans les deux populations.
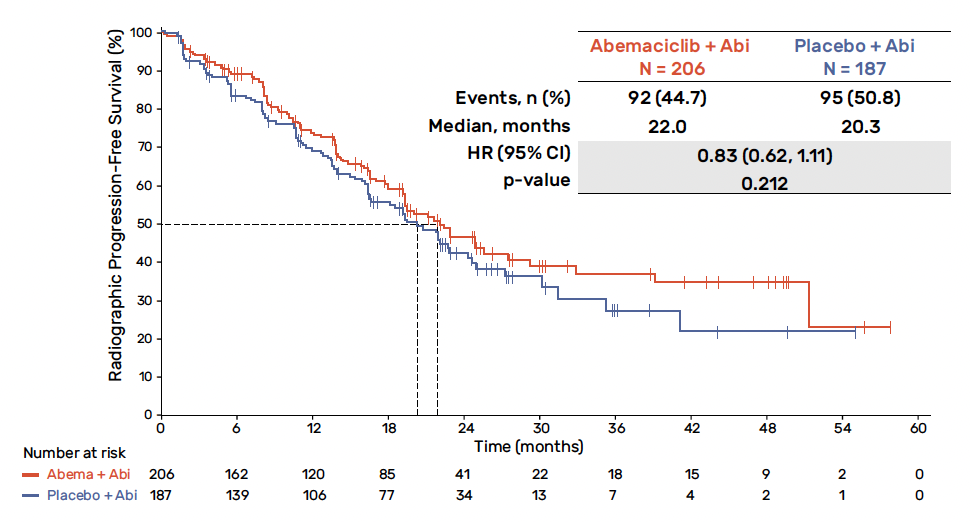
Il n’a pas été démontré d’amélioration significative de la SSP en ITT avec une médiane de SSP de 22 mois pour le groupe abémaciclib et abiratérone contre 20,3 mois dans le bras placebo et abiratérone (HR = 0,83 ; IC 95 % : 0,62-1,11 ; p = 0,212) (Fig. 2). L’analyse de la SSP radiographique après une relecture centralisée indépendante en aveugle était en conformité avec l’évaluation de l’investigateur (HR = 0,84 ; IC 95 % : 0,61-1,16). Aucun bénéfice n’a été observé en termes de SG (HR = 0,93 ; IC 95 % : 0,67-1,29 avec une maturité de 38,9 %), de taux de réponse objective (45 versus 55 %), de taux de réponse du PSA ou de délai jusqu’à progression symptomatique.
Figure 2 – CYCLONE 2 : données de survie sans progression radiographique en ITT.
Tolérance
Les événements indésirables de grades ≥ 3 les plus fréquemment rapportés dans le groupe abémaciclib + abiratérone étaient l’anémie (13,6 versus 4,3 %), la neutropénie (12,6 versus 0,5 %) et l’augmentation des transaminases (8,7 versus 6,5 %). Les taux d’arrêt des traitements de l’étude en raison de la survenue d’effets secondaires étaient de 13,1 % dans le bras abémaciclib et abiratérone contre 4,3 % dans le bras placebo et abiratérone avec un taux d’arrêt spécifique de l’abémaciclib de 5,8 contre 1,6 % pour le placebo seul.
À retenir
Cette étude démontre que le ciblage de CDK4/6 dans le cancer de la prostate métastatique résistant à la castration présente une efficacité limitée en l’absence de bénéfice significatif en termes de SSP radiographique. Les données d’efficacité de l’abémaciclib en monothérapie dans d’autres études préliminaires au stade mCRPC et mHSPC sont relativement similaires. Plusieurs mécanismes de résistance sont évoqués comme les amplifications de CDK6 ou la perte de Rb (par altérations ou délétions de deux copies de RB1) déjà mise en évidence dans le cancer du sein en progression sous inhibiteurs de CDK4/6 (10 % des cas) et qui pourrait concerner 30 à 60 % des cancers de la prostate métastatique. Les résultats de l’étude CYCLONE 3 avec l’abémaciclib et l’acétate d’abiratérone au stade mHSPC sont attendus. On peut craindre qu’elle connaisse le même sort…
• Smith MR, Piulats JM, Todenhöfer T et al. CYCLONE 2: A phase 3 study of abemaciclib with abiraterone in patients with metastatic castration-resistant prostate cancer. J Clin Oncol 2024 ; 42 : abstr. 5001.
TOP 3 – De nouvelles perspectives dans le cancer de la prostate métastatique !
L’identification de nouvelles cibles moléculaires a conduit au développement de nouvelles applications thérapeutiques, notamment dans le cadre du cancer de la prostate. Parmi elles, on note les thérapies ciblant les anomalies de réparation de l’ADN avec, comme chef de file, les inhibiteurs de PARP (PARPi) ou les thérapies ciblant le récepteur au PSMA avec la radiothérapie interne vectorisée au lutétium-PSMA, qui a récemment ouvert l’ère d’une approche théranostique dans le cancer de la prostate. Plusieurs molécules innovantes ont été présentées lors de la dernière journée du congrès de l’ASCO, offrant de nouvelles perspectives dans le cancer de la prostate métastatique, pour lequel il existe toujours un besoin impérieux de ressources thérapeutiques.
Le JNJ-69086420
À l’instar du PSMA, la kallicréine 2 humaine (hK2) (codée par le gène KLK2), fortement exprimée à la surface des cellules cancéreuses de la prostate, pourrait potentiellement faire l’objet d’un ciblage. Dans ce contexte, les premiers résultats d’escalade de doses d’une étude de phase I s’intéressant à l’utilisation du JNJ-69086420 (JNJ-6420), un anticorps marqué à l’actinium-225 (225Ac) ciblant la hK2 ont été présentés.
Les patients inclus étaient atteints d’un cancer de la mCRPC, souvent lourdement prétraités et recevaient des doses intraveineuses cumulatives de JNJ-6420 allant de 50 à 400 μCi toutes les 8 à
12 semaines. Les objectifs principaux de l’étude concernaient essentiellement les données de tolérance permettant de définir une dose recommandée pour une future phase II, mais les résultats préliminaires d’activité clinique ont également été recueillis.
Les résultats
Au cut-off, 75 patients ont pu bénéficier d’au moins une dose de JNJ-6420. 61,3 % (n = 46) d’entre eux ont présenté des événements indésirables de grades ≥ 3 survenus en cours de traitement (32,0 % d’événements indésirables graves) avec notamment des cas de thrombopénie (17,3 %), d’anémie (25,3 %) ou de pneumopathie interstitielle (5,3 % dont deux décès), ce qui nécessitera une surveillance attentive de la fonction pulmonaire.
Les données préliminaires d’efficacité étaient prometteuses avec une diminution du PSA > 50 % de 44 % et du PSA > 90 % de 9 % ainsi qu’un taux de réponse objective de 18 % (une réponse complète et deux réponses partielles) pour la dose de 250 μCi (n = 36).
L’ARV-766
Une seconde étude d’escalade de dose de phase I/II, présentée lors de la même session orale, s’intéressait cette fois à l’utilisation de l’ARV-766, un dégradeur oral de protéines PROTAC (PROteolysis Targeting Chimera) ciblant notamment le récepteur aux androgènes (AR) sauvages, mais également les variants mutés d’AR au niveau de ligand bindind domain (LBD), dont la présence permet le maintien d’une activation de la voie de signalisation des récepteurs aux androgènes malgré l’utilisation d’une ou plusieurs hormonothérapies, avec un pronostic généralement péjoratif.
Les patients éligibles étaient atteints d’un mCRPC en progression avec une première partie d’escalade de dose évaluant l’innocuité et la tolérance d’ARV-766 (20 à 500 mg une fois par jour) et une seconde partie d’expansion de cohorte évaluant l’activité clinique et l’innocuité de deux doses d’ARV-766 (100 ou 300 mg une fois par jour) chez des malades ayant déjà reçu un à trois NHT et ≤ deux chimiothérapies.
Les résultats
Cent vingt-trois patients ont pu recevoir de l’ARV-766, dont 53 étaient porteurs d’une mutation au niveau de LBD, avec une médiane de quatre traitements antérieurs.
Le profil de tolérance était plutôt correct, avec 96 % (n = 118) d’effets secondaires de tout grade et 37 % (n = 46) de grades ≥ 3 liés au traitement. Les événements indésirables les plus fréquents survenus sous traitement étaient la fatigue (33 % tout grade), des nausées (20 % tout grade) et des diarrhées (15 % tout grade).
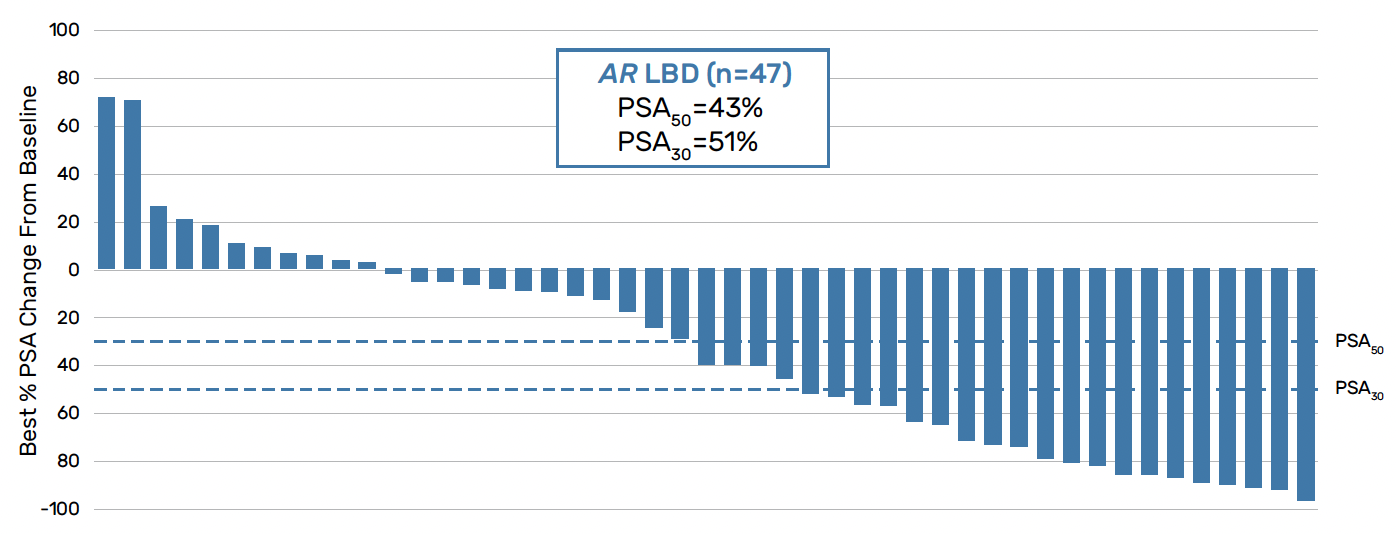
Parmi les malades présentant une mutation au niveau de LBD, on notait une réponse biologique intéressante (diminution du PSA > 50 % de 43 % et du PSA > 30 % de 51 %) avec un taux de réponse objective de 30 % (n = 20) (Fig. 3).
Figure 3 – Réponse biologique sous ARV-766 chez des patients présentant une mutation du récepteur aux androgènes au niveau de LBD.
Le tarlatamab
Une fois n’est pas coutume, le carcinome neuroendocrine de la prostate métastatique a également eu les honneurs d’une présentation avec les données préliminaires d’une étude de phase Ib (DeLLpro-300) s’intéressant à l’utilisation du tarlatamab, un anticorps bispécifique ciblant DLL3. Cette entité, pouvant être issue d’une transdifférenciation d’un adénocarcinome prostatique ou de novo, est une forme particulièrement agressive de cancer de la prostate avec un mauvais pronostic et sans réel standard thérapeutique. Elle présente la particularité d’une sur-expression de DLL3 pouvant faire l’objet d’un ciblage.
Quarante patients ont reçu au moins une injection de tarlatamab.
Les résultats
Les données de tolérance étaient rassurantes, avec essentiellement des cas de syndrome de relargage des cytokines (75,0 % des malades) et très peu d’interruption de traitement (7,5 %). Une analyse rétrospective d’immunohistochimie a montré que 18 des 32 (56,3 %) patients évaluables par biopsie présentaient une positivité tumorale DLL3 ≥ 1 % (DLL3+). Le taux de réponse objective était de 10,5 % pour l’ensemble de la population (avec une durée médiane de réponse de 7,3 mois) et de 22,2 % chez les patients DLL3+ avec une durée de traitement plus longue (3,6 versus 1,4 mois).
À retenir
Les données préliminaires de ces trois études sont prometteuses et mériteront d’être évaluées sur des effectifs plus larges. Le ciblage de hK2, spécifique des cellules cancéreuses de la prostate, et ne nécessitant pas d’imagerie morpho-métabolique au préalable (à la différence de la radiothérapie interne vectorisée au 177Lu-PSMA-617), va notamment faire l’objet d’autres thérapies innovantes (anticorps conjugués à un cytotoxique, radio-isotopes ou anticorps bispécifiques). L’étude DeLLpro-300 souligne la nécessité de nouvelles approches pour diagnostiquer le carcinome neuroendocrine de la prostate, une forme histologique agressive et identifier des cibles thérapeutiques exploitables dans une population avec des ressources thérapeutiques limitées.
• Morris MJ, Wong JYC, Nordquist L et al. A phase 1 study of JNJ-69086420 (JNJ-6420), an actinium-225 (225Ac) -labeled antibody targeting human kallikrein 2 (hK2), for metastatic castration-resistant prostate cancer (mCRPC). J Clin Oncol 2024 ; 42 : abstr. 5010.
• Petrylak DP, McKean M, Lang JM et al. ARV-766, a proteolysis targeting chimera (PROTAC) androgen receptor (AR) degrader, in metastatic castration-resistant prostate cancer (mCRPC): Initial results of a phase 1/2 study. J Clin Oncol 2024 ; 42 : abstr. 5011.
• Aggarwal RR, Rottey S, Bernard-Tessier A et al. Phase 1b study of tarlatamab in de novo or treatment-emergent neuroendocrine prostate cancer (NEPC). J Clin Oncol 2024 ; 42 :
abstr. 5012.
TOP 4 – Le sacituzumab govitécan, nouveau partenaire des stratégies péri-opératoires du carcinome urothélial ?
La prise en charge d’une tumeur vésicale infiltrant le muscle (TVIM) définie par la présence d’un envahissement du détrusor (pT2 au minimum) impose généralement une chirurgie radicale en raison d’un risque d’extension loco-régionale et métastatique. Celle-ci peut parfois être précédée d’une chimiothérapie néoadjuvante (MVAC accéléré ou cisplatine gemcitabine) si l’état général du patient et sa fonction cardio-rénale le permettent. La chimiothérapie néoadjuvante à base de cisplatine permet d’obtenir des réponses pathologiques complètes (pCR) chez environ 30 à 40 % des patients atteints d’un cancer de la vessie infiltrant le détrusor avec une survie significativement meilleure.
Afin d’améliorer encore le devenir des malades au décours de l’opération, d’autres molécules innovantes ont été évaluées dans le cadre d’une stratégie péri-opératoire. Elles pourraient potentiellement permettre de proposer un traitement néoadjuvant bien toléré et actif aux patients inéligibles à une chimiothérapie néoadjuvante et améliorer la réponse pathologique complète et la survie sans récidive de la maladie.
Dans ce contexte, l’immunothérapie a déjà été évaluée dans plusieurs études en monothérapie (PURE-01, ABACUS) ou en association (NEMIO, NABUCCO, SAKK 06/17…) avec des résultats prometteurs. Les anticorps conjugués à un cytotoxique commencent également à être étudiés dans le même cadre.
L’étude SURE-01/02
Le sacituzumab govitécan, un anticorps monoclonal couplé au SN-38 (inhibiteur de la topo-isomérase) et dirigé contre Trop-2, a fait l’objet d’une présentation lors du congrès de l’ASCO. SURE-01/02 était un essai multicohorte de phase II en ouvert évaluant le sacituzumab govitécan en situation néoadjuvante chez des patients atteints d’un carcinome urothélial infiltrant la vessie (cT2-4N0M0) et inéligibles à une chimiothérapie néoadjuvante à base de cisplatine (ou la refusant), en monothérapie (SURE-01) ou en association avec le pembrolizumab (SURE-02).
Les résultats préliminaires de la première cohorte ont été présentés dans une population de malades recevant quatre cycles (J1, J8 ; J1 = J21) de cet anticorps conjugué évalué en monothérapie à la dose de 10 mg/kg et bénéficiant d’une cystectomie au décours. Avant l’intervention chirurgicale, une évaluation de la réponse au traitement a été effectuée avec la réalisation d’un scanner TAP, d’un TEP/TDM au 18FDG et d’une IRM de la vessie. Le critère d’évaluation principal était le taux de réponse pathologique complète (ypT0N0), les autres critères secondaires étant le taux de ypT ≤ 1 N0, de survie sans événement ou de SG et les données en termes de tolérance ou de qualité de vie.
Les résultats
Les patients
Entre mars 2022 et mai 2024, 38 patients ont été screenés dans cette étude et 31 malades ont finalement reçu du sacituzumab govitécan en situation néoadjuvante. Parmi eux, 18 patients ont pu bénéficier d’une évaluation de la réponse cytologique au décours de leurs injections, 10 étaient toujours sous thérapie et trois sont décédés en cours de traitement. L’âge médian des patients était de 70 ans. Sur les 21 malades ayant reçu leur traitement ou étant décédés sous thérapie, 76 % avaient refusé une chimiothérapie à base de cisplatine et 24 % n’étaient pas éligibles. Près de la moitié des patients (48 %) présentaient un carcinome urothélial associé à d’autres variantes histologiques. Parmi les 18 patients ayant terminé leurs quatre cycles de sacituzumab, 11 ont finalement bénéficié d’une cystectomie radicale et sept ont refusé la chirurgie (dont six devant la preuve d’une réponse clinique complète).
Résultats
Une réponse pathologique complète a été observée chez quatre des 11 malades (36,4 %) ayant été opérés. Un patient a présenté une rechute/progression de la maladie.
Tolérance
Concernant les données de tolérance, la survenue d’effets indésirables sévères sous sacituzumab govitécan à 10 mg/kg (75 % de neutropénie grade ≥ 3, 50 % de diarrhées grades ≥ 3) et de deux décès (directement en lien avec le traitement ou non) chez les huit premiers patients traités a conduit à un amendement autorisant une adaptation posologique d’emblée à 7,5 mg/kg et l’usage de G-CSF. Parmi les 21 patients traités, 81 % ont présenté un événement indésirable de tout grade lié au traitement (avec 33,3 % de grade 3 et 19,1 % de grade 4). On notait finalement trois décès, dont un lié au traitement (septicémie consécutive à une neutropénie de grade 4 associée à une diarrhée de grade 3).
À retenir
Les données préliminaires de SURE-1 avec le sacituzumab govitécan utilisé en monothérapie en situation néoadjuvante dans une population non éligible à une chimiothérapie néoadjuvante sont intéressantes. Elles sont assez proches des résultats observés avec un autre anticorps conjugué (enfortumab) dans l’étude EV-103 (cohorte H) avec 36,4 % de réponse pathologique complète et 50 % de réponse tumorale (downstaging).
Le profil de tolérance (avec notamment trois décès !) imposera une sélection rigoureuse des patients les plus à même de recevoir cette thérapie dont l’utilisation en situation métastatique a récemment pris du plomb dans l’aile suite aux résultats annoncés négatifs sur un press release de l’étude TROPiCS-04 (sacituzumab versus chimiothérapie au choix du prescripteur après un sel de platine et une immunothérapie). La rédemption viendra peut-être des associations médicamenteuses avec une immunothérapie en traitement néoadjuvant (SURE-2) ou métastatique (TROPHY-U-01). On attend également avec impatience les données d’autres combinaisons avec l’enfortumab védotin et le pembrolizumab chez les patients éligibles à une chimiothérapie néoadjuvante par cisplatine (EV304/KEYNOTE-B15) ou non (EV303/KEYNOTE-905).
• Cigliola A, Moschini M, Tateo V et al. Perioperative sacituzumab govitecan (SG) alone or in combination with pembrolizumab (Pembro) for patients with muscle-invasive urothelial bladder cancer (MIBC): SURE-01/02 interim results. J Clin Oncol 2024 ; 42 : abstr. LBA4517.
TOP 5 – Les tumeurs urologiques rares sous les feux de la rampe à l’ASCO !
Après plusieurs congrès internationaux associés à des progrès et des espoirs considérables pour nos patients, l’actualité de l’ASCO en onco-urologie a paru s’installer dans une période de transition, entre sessions dédiées aux biomarqueurs et aux phases précoces prometteuses. Certaines tumeurs urologiques rares, souvent laissées au second plan ces dernières années, ont fait l’objet de plusieurs présentations orales avec de nouvelles approches thérapeutiques qui viendront peut-être bousculer la prise en charge de nos malades et répondre à un réel besoin de traitement.
Le cancer de l’ouraque
Le cancer de l’ouraque est une tumeur maligne rare représentant < 1 % des cancers de la vessie. Il s’agit d’une maladie agressive dont la SG en situation métastatique reste actuellement inférieure à 2 ans. Elle reste encore mal comprise, avec un manque d’essais cliniques prospectifs pour éclairer la prise de décision en matière de traitement, en particulier dans les formes avancées où il n’existe pas de standard thérapeutique. Les options de chimiothérapie actuelles reposent essentiellement sur l’extrapolation de données provenant d’autres sites pathologiques. Des schémas thérapeutiques à base de cisplatine utilisés pour le carcinome urothélial peuvent être envisagés sur la base du principe de la localisation anatomique. Compte tenu d’une histopathologie et d’un profil mutationnel génomique proches du cancer colorectal, le 5-FU, la capécitabine, l’oxaliplatine et l’irinotécan ont été envisagés pour la prise en charge du cancer de l’ouraque. Sur la base des données provenant de rapports/séries de cas et de revues systématiques, il semblerait que certains schémas thérapeutiques de chimiothérapie utilisés dans le cancer colorectal soient plus bénéfiques pour les patients atteints de cette tumeur rare que les schémas thérapeutiques traditionnellement proposés dans le carcinome urothélial.
L’étude ULTIMA
C’est donc dans ce contexte que l’étude ULTIMA évaluait l’efficacité et la tolérance d’une chimiothérapie par FOLFIRINOX modifié (5-FU/leucovorine, oxaliplatine et irinotécan) en première ligne métastatique dans le cancer de l’ouraque.
Entre avril 2021 et novembre 2023, 21 patients ont été inclus dans cette phase II et recevaient un traitement par FOLFIRINOX modifié, sous G-CSF, toutes les 2 semaines pour un total de 12 cy-cles au maximum.
Les résultats
Au cut-off, on notait un taux de réponse objective (critère d’évaluation principal) de 61,9 % (n = 13), dont 9,5 % de réponse complète (n = 2). Aucun malade ne présentait de maladie évolutive d’emblée. Après un suivi médian respectif de 23,3 et 24,7 mois, les médianes de SSP et de SG étaient de 9,3 mois (IC 95 % : 6,7-11,9) et 19,7 mois (IC 95 % : 14,3-25,1).
Tolérance
Le profil de tolérance était plutôt rassurant avec un seul cas de neutropénie grade 3, sans neutropénie fébrile et deux cas d’anémie grade 3. Les effets indésirables de grade 1-2 plus fréquents en lien avec le traitement étaient la neuropathie périphérique, les nausées ou douleurs abdominales, l’élévation des transaminases, la thrombopénie et la fatigue.
Le corticosurrénalome
Le cortisosurrénalome, une tumeur maligne endocrinienne rare (0,5 et 2 nouveaux cas par million de personnes par an) a également eu l’honneur d’une session orale. À ce jour, le mitotane reste le seul médicament approuvé par la FDA avec des options de traitements très limités et un pronostic sombre après progression de la maladie (< 15 % de SG à 5 ans). Les inhibiteurs de points de contrôle immunitaires et les thérapies ciblées ont montré une activité limitée en monothérapie.
L’étude
Dans ce contexte, une étude de phase II visait à évaluer l’efficacité et la tolérance du camrélizumab (un anti-PD-1) associé à l’apatinib (un inhibiteur de tyrosine kinase) chez des patients atteints d’un carcinome corticosurrénalien avancé en progression après une ou plusieurs lignes de traitement.
Les résultats
Dans cette petite cohorte de malades (n = 21), on notait un taux de réponse objective prometteur de 52 % et 43 % de stabilité de la maladie. Les médianes de SSP et de SG étaient respectivement de 12,6 mois (57,1 % de SSP à 1 an) et 20,9 mois (74,5 % de SG à 1 an).
Tolérance
Le profil de tolérance de cette combinaison était plutôt correct (24 % d’élévation des transaminases et 19 % de lymphopénie grades ≥ 3).
Le carcinome épidermoïde du pénis
Enfin, une troisième étude intéressante a été présentée, concernant cette fois le carcinome épidermoïde du pénis, une maladie rare (incidence de 38 000 nouveaux cas par an dans le monde) et agressive (SG de 6 à 7 mois en situation métastatique) pour laquelle les options thérapeutiques restent très restreintes au décours d’une première ligne métastatique à base de sels de platine, standard depuis plus de 50 ans.
L’étude HERCULES
L’étude de phase II HERCULES évaluait l’efficacité et la tolérance d’une première ligne de chimiothérapie à base de sel de platine (cisplatine 70 mg/m2 ou carboplatine AUC5 IV à J1 et 5-FU 1 000 mg/m²/jour IV J1 à J4 avec six cycles au maximum) associé au pembrolizumab (J1 = J21) chez des patients atteints d’un carcinome épidermoïde du pénis métastatique ou localement avancé. Le critère de jugement principal de l’étude était le taux de réponse objective évalué selon les critères RECIST par l’investigateur.
Les résultats
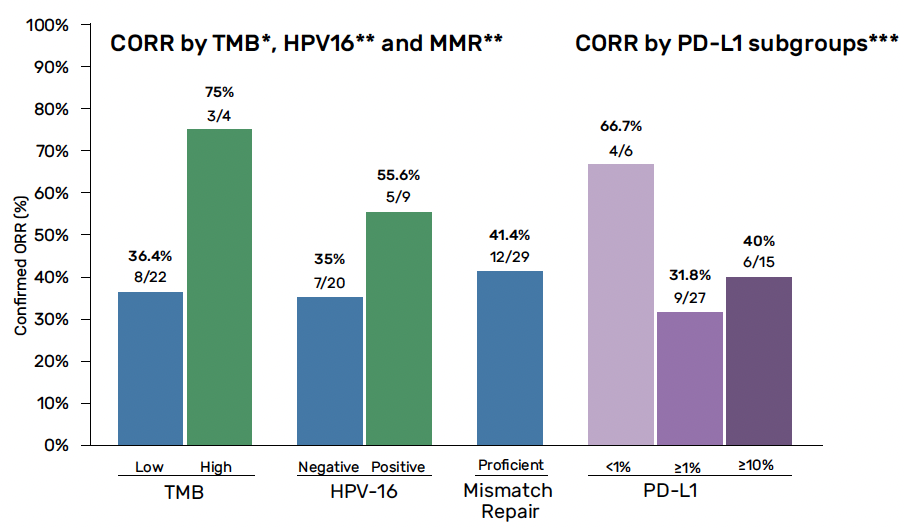
Entre août 2020 et décembre 2022, 37 patients ont été inclus avec des données analysables chez 33 malades. On notait un taux de réponse objective de 39,4 % (une réponse complète et 12 réponses partielles), confirmé sur une analyse centralisée (42,4 %) et un taux de réduction tumorale de 75,8 %. Avec un suivi médian de 24 mois, les médianes de SSP et de SG étaient de 5,4 et 9,6 mois. Dans une analyse exploratoire, le taux de réponse global confirmé par l’investigateur selon le statut PD-L1 était de 66,7 % chez les patients avec un score CPS 0 % contre 31,8 % avec score CPS ≥ 1 %. Le taux de réponse semblait plus important en fonction du taux de charge mutationnelle (75 % pour un statut TMB élevé contre 36,4 % pour un TMB faible) et du statut HPV16 (55,6 % pour HPV16+ versus 55,6 % pour HPV16-) (Fig. 4).
Figure 4 – HERCULES : taux de réponse objective en fonction du statut PD-L1, TMB et HPV-16.
Tolérance
Il n’existait pas de signal défavorable en termes de tolérance avec un taux d’événements indésirables liés au traitement, tous grades confondus, de 91,9 % et de grades ≥ 3 de 51,4 %. Dix patients ont toutefois présenté des événements indésirables de grade 5, même si aucun d’entre eux ne semblait lié au traitement.
À retenir
Ces différentes études présentées lors du congrès témoignent de la volonté d’enrichir l’arsenal thérapeutique pour des tumeurs urologiques pouvant être considérées comme des maladies orphelines. Elles concernent néanmoins de petites cohortes de patients et mériteraient d’être confrontées à des essais avec de plus larges effectifs ou, a minima, randomisés, qui seront difficiles à concevoir au vu de la rareté de ces entités tumorales. HERCULES est la première étude à démontrer l’efficacité d’une immunothérapie dans le carcinome épidermoïde du pénis avancé avec un profil d’innocuité acceptable et peut être considérée comme un nouveau standard thérapeutique de première ligne métastatique en association avec une chimiothérapie à base de sels de platine.
• Lee JL, Park I, Yoon S et al. A multicenter phase II study of modified FOLFIRINOX for first-line treatment for advanced urachal cancer (ULTMA; KCSG GU20-03). J Clin Oncol 2024 ; 42 : abstr. 4510.
• Wei Z, Zhu Y, Cai L et al. Camrelizumab plus apatinib for previously treated advanced adrenocortical carcinoma: A single-arm, open-label, phase 2 trial. J Clin Oncol 2024 ; 42 : abstr. 4511.
• Cotait Maluf F, Trindade K, Almeida DD et al. A phase II trial of pembrolizumab plus platinum-based chemotherapy as first-line systemic therapy in advanced penile cancer: HERCULES (LACOG 0218) trial. J Clin Oncol 2024 ; 42 : abstr. 5009. n
Benjamin Auberger déclare avoir des liens d’intérêt avec BMS, Sanofi, Ipsen, Janssen, Pfizer, Bayer, Novartis, Eisai, MSD, Astellas, Merck et AstraZeneca.