L’adénocarcinome pancréatique métastatique est une maladie grave dont l’incidence est en augmentation, les complications, nombreuses et potentiellement graves. Sa prise en charge multidisciplinaire repose sur des soins de support de qualité et la chimiothérapie systémique.
Résumé
L’adénocarcinome pancréatique (AP) est découvert à un stade métastatique chez près d’un patient sur deux. Son incidence est en constante augmentation et son pronostic reste parmi les plus sombres, justifiant une prise en charge urgente. Les complications sont nombreuses, fréquentes, et ont une incidence à la fois sur la survie et sur la qualité de vie des patients ; elles doivent être prévenues, cherchées et traitées à chaque étape du parcours de soin. La prise en charge des patients requiert une collaboration multidisciplinaire impliquant une expertise d’organe, une expertise oncologique et des soins de support performants. La polychimiothérapie (FOLFIRINOX, gemcitabine + (nab)-paclitaxel) permet d’améliorer la survie et de prolonger l’espérance de vie et est le traitement de référence chez les patients ayant un état général compatible, mais son efficacité est souvent de courte durée. L’inclusion des patients dans des essais cliniques doit être encouragée, notamment par l’identification d’anomalies moléculaires tumorales pouvant faire envisager une médecine de précision.
Abstract
Pancreatic adenocarcinoma: management of metastatic forms
Pancreatic ductal adenocarcinoma (PDAC) is discovered at a metastatic stage in nearly half of patients. Its incidence is constantly rising, and its prognosis remains among the poorest, justifying urgent treatment. Complications are numerous, frequent, and impact both patient survival and quality of life; they must be prevented, diagnosed, and treated at each stage of the management. Patient care requires multidisciplinary collaboration involving organ expertise, oncological expertise, and effective supportive care. Poly-chemotherapy (FOLFIRINOX, gemcitabine + (nab)-paclitaxel) improves survival and prolongs life expectancy and is the reference treatment in patients with a compatible general condition, but its effectiveness is often short. The inclusion of patients in clinical trials should be encouraged, particularly by identifying tumour molecular abnormalities that could lead to the consideration of precision medicine.
Introduction
L’adénocarcinome pancréatique (AP) est un cancer dont le pronostic est sombre en raison d’un diagnostic tardif chez la majorité des patients, qui se présentent à un stade localement avancé non résécable ou métastatique dans respectivement 25 et 50 % des cas environ. Son incidence est en augmentation, d’environ +4,5 % par an en France (1). L’AP est l’un des cancers associés au taux de létalité le plus élevé, avec un taux de survie à 5 ans tous stades confondus d’environ 7-8 %. Ainsi, l’AP est actuellement la septième cause de décès par cancer dans le monde, mais pourrait devenir la seconde cause en 2040.
L’objectif de cet article est de faire le point sur la prise en charge pratique des patients ayant un AP métastatique en 2023. Nous insisterons sur les principaux points constituant le parcours de soins oncologiques et de support.
Preuve histologique
L’obtention d’une preuve histologique doit être systématique avant tout traitement, afin de confirmer le diagnostic et de pouvoir offrir l’opportunité de tests moléculaires (2). La biopsie doit être réalisée sur le site le plus accessible et le moins à risque de complications :
1) biopsie hépatique guidée par imagerie (échographie le plus souvent) en cas de métastases hépatiques en l’absence de contre-indication (ascite, trouble de l’hémostase non corrigeable, geste à risque, car métastase mal située) ;
2) biopsie guidée par imagerie des lésions de carcinose péritonéale ou d’adénopathies si facilement accessible ;
3) biopsie pancréatique sous échoendoscopie, voire transpariétale sous contrôle scanographique.
Néanmoins, dans les cas exceptionnels de patients ayant une tumeur avancée, avec retentissement sur l’état général (PS 2) et indication de chimiothérapie urgente, après au moins une ou deux tentatives de biopsie diagnostique non contributives, un faisceau d’arguments cliniques, biologiques (CA 19-9 > 10N sans cholestase) et radiologiques (tumeur hypodense au scanner avec injection de produit de contraste) peut être suffisant pour initier une chimiothérapie rapidement après validation en RCP experte (2).
Évaluation clinique et mise en place des soins de support
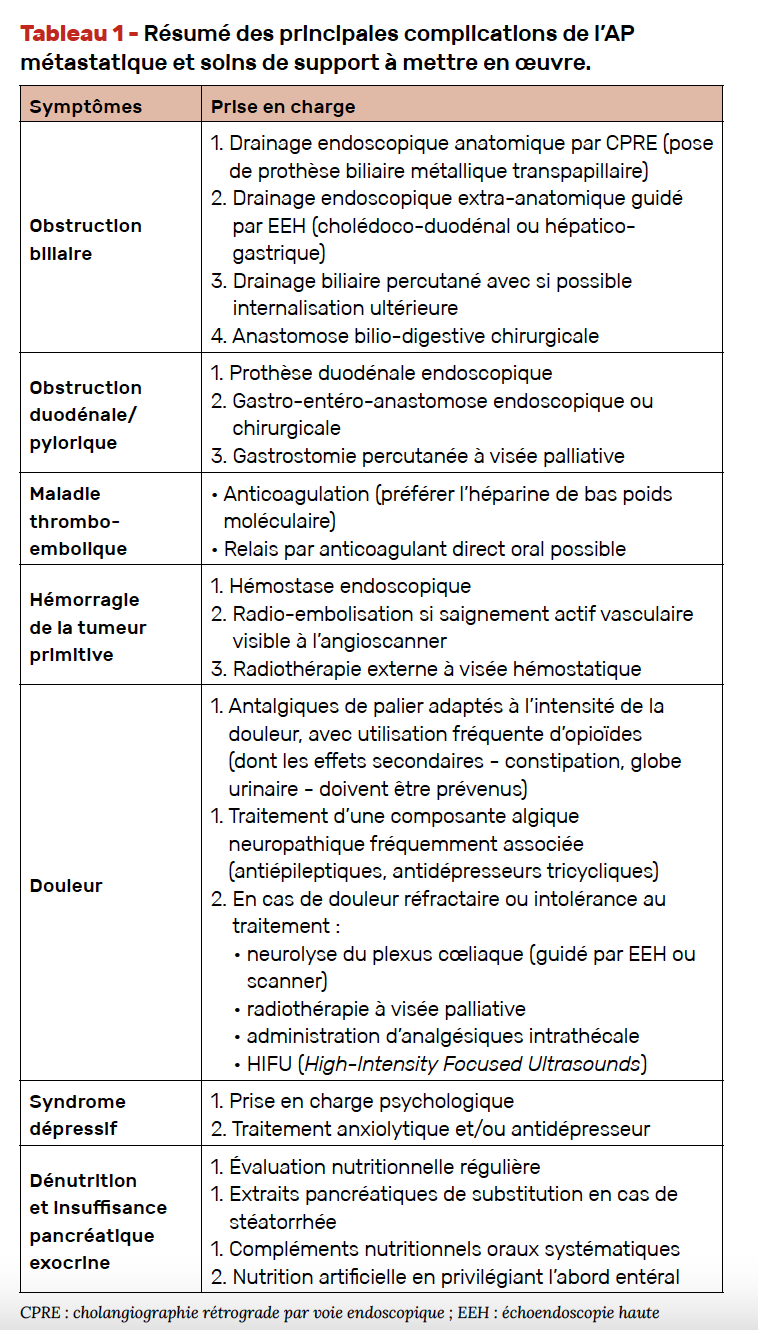
Une évaluation clinique précise initiale puis régulière est indispensable chez les patients atteints d’AP métastatique, car un nombre important de complications peut survenir, liées à l’évolution carcinologique, et/ou spécifiques de la localisation pancréatique de la tumeur primitive. Leur diagnostic précoce est primordial afin de pouvoir proposer les meilleurs soins de support possibles (Tab. 1) (3, 4).
Douleur pancréatique
La douleur pancréatique est typiquement épigastrique, transfixiante avec irradiation dorsale, souvent insomniante et anorexiante, car augmentée par la prise alimentaire. Elle est souvent très intense et nécessite alors une prise en charge multimodale incluant des morphiniques et des antalgiques ciblant une composante neuropathique (antiépileptiques, antidépresseurs tricycliques) (5). Une évaluation régulière par un spécialiste de la douleur est recommandée. Dans certains cas, l’obstruction du conduit pancréatique principal peut entraîner une pancréatite aiguë, qui peut être une manifestation révélatrice de l’AP.
Ictère
L’ictère est une complication fréquente en cas d’AP céphalique, témoignant d’une sténose tumorale de la voie biliaire principale avec rétro-dilatation des voies biliaires. Il entraîne une asthénie et expose à un risque d’angiocholite et de surdosage médicamenteux, notamment sous chimiothérapie (l’irinotécan est d’élimination biliaire). Un drainage biliaire est alors nécessaire, idéalement par voie endoscopique. L’ictère peut également être en rapport avec des métastases hépatiques, soit par compression extrinsèque hilaire, soit par envahissement hépatique diffus à un stade plus tardif.
Dénutrition
La dénutrition est quasi-constante, en rapport avec une anorexie par carence d’apports et à un état hypercatabolique. Sa prise en charge est fondamentale et repose sur une évaluation régulière par une diététicienne, et un support nutritionnel adapté au niveau de dénutrition (compléments alimentaires oraux, voire nutrition artificielle dont la voie entérale doit être favorisée en l’absence d’occlusion digestive ; activité physique adaptée).
Stéatorrhée
La stéatorrhée, témoin d’une insuffisance pancréatique exocrine, doit être cherchée et traitée (enzymes pancréatiques au milieu du repas) afin de limiter les carences micro-nutritionnelles et améliorer le transit intestinal.
Déséquilibre glycémique
Un déséquilibre glycémique, voire un diabète d’apparition récente, est fréquent et participe à l’état hypercatabolique.
Événements thromboemboliques
Les événements thromboemboliques (phlébite, thrombose veineuse profonde, embolie pulmonaire) surviennent chez au moins 20 % des patients, pouvant parfois justifier d’une anticoagulation préventive.
Occlusion digestive
Une occlusion digestive peut survenir en lien avec une sténose duodénale ou une carcinose péritonéale. Son traitement précoce spécifique (prothèse duodénale ou anastomose gastro-jéjunale ; traitement médicamenteux de l’obstruction sur carcinose) est nécessaire afin de limiter les conséquences sur l’état nutritionnel.
Hémorragie digestive
Une hémorragie digestive survient le plus souvent par envahissement tumoral de la paroi duodénale ou gastrique. Les techniques d’hémostase endoscopique ne sont le plus souvent que suspensives, le temps d’envisager une radio-embolisation ou une radiothérapie hémostatique.
Ascite
Une ascite est fréquemment présente en cas de carcinose péritonéale évoluée, et source d’altération de la qualité de vie. Elle marque souvent un tournant péjoratif dans l’évolution de la maladie.
Fièvre
La survenue d’une fièvre doit avant tout faire réaliser un bilan complet à la recherche d’un foyer infectieux, en particulier un dysfonctionnement de prothèse biliaire chez les patients qui en sont porteurs, et une infection de chambre implantable. Une fièvre tumorale paranéoplasique est possible, mais doit rester un diagnostic d’élimination, car son traitement (anti-inflammatoires non stéroïdiens et poursuite de la chimiothérapie) risque d’aggraver toute infection sous-diagnostiquée.
Évaluation biologique
Une évaluation biologique initiale et régulière est indispensable afin de prévenir ou dépister les complications de l’AP, vérifier les conditions de réalisation de chaque cure de chimiothérapie. Le bilan standard doit comprendre :
• une numération formule sanguine et un bilan d’hémostase (notamment en cas d’ictère) ;
• un bilan hépatique complet (indispensable en cas d’AP céphalique, et/ou de traitement par irinotécan ou (nab)-paclitaxel) ;
• un bilan nutritionnel avec dosage de la pré-albumine et dosage mensuel ou bimensuel de l’albumine, et bilan plus complet régulier (Ca, Ph, Mg, vitamines A, D, E) ;
• un bilan d’anémie en cas d’hémoglobine < 10 g/dl : réticulocytes, bilan martial, vitamines B9 et B12, TSH, voire bilan d’hémolyse ;
• une glycémie à jeun, et un dosage mensuel de l’HbA1c ;
• le CA 19.9 présente peu d’intérêt diagnostique en raison de ses nombreuses causes de faux positifs (cholestase, diabète déséquilibré, pancréatite chronique) et faux négatifs (groupe Lewis négatif), mais peut être parfois utile à l’évaluation de l’évolution de la maladie en complément des arguments cliniques et scanographiques – son dosage trop régulier n’a néanmoins démontré aucune utilité et peut être anxiogène ;
• l’uracilémie (ou phénotypage de la dihydropyrimidine déshydrogénase), indispensable avant toute prescription de chimiothérapie par fluoropyrimidine (5-fluorouracile (5-FU), capécitabine) ;
• la recherche de polymorphismes du gène UGTA1 est indispensable en cas de suspicion de maladie de Gilbert (hyperbilirubinémie libre, antécédent d’ictère néonatal, antécédents familiaux), car celui-ci doit faire adapter la dose d’irinotécan.
Caractérisation et suivi par imagerie
Scanner thoraco-abdomino-pelvien
Le scanner thoraco-abdomino-pelvien en coupes fines avec injection de produit de contraste et épaisseur de coupes < 0,5-1 mm est l’imagerie de référence pour le bilan d’extension et le suivi évolutif des patients ayant un AP métastatique. Le compte-rendu doit préciser la taille et la localisation de la tumeur primitive et des lésions secondaires à distance, en sachant que la sensibilité du scanner est incomplète pour l’évaluation des petites métastases hépatiques et de la carcinose péritonéale (6). Chaque examen de scanner doit également chercher d’éventuelles complications, qui peuvent modifier la prise en charge immédiate du patient : aspect d’obstruction digestive et/ou biliaire, épanchement intra-abdominal et/ou pleural, foyer infectieux…
Les scanners de suivi sous traitement doivent évaluer l’évolution tumorale selon les critères RECIST 1.1
en fonction de l’évolution de la somme des plus grands diamètres de la tumeur primitive et de deux ou trois cibles métastatiques par organe. La réponse tumorale est évaluée en comparant un scanner à celui réalisé avant le début du traitement (l’évaluation peut être faussée si l’examen date de plus de 1 mois avant le début de traitement du fait de l’évolution potentiellement rapide de l’AP). La progression tumorale est évaluée en comparant un scanner à celui correspondant à la meilleure réponse (nadir).
IRM hépatique
Une IRM hépatique comprenant des séquences de diffusion, et au mieux injectée avec un produit de contraste hépato-spécifique, est recommandée en cas de maladie oligo-métastatique ou en cas de doute sur des métastases hépatiques, afin de préciser l’extension hépatique.
Tomographie
La tomographie par émission de positrons au 18FDG n’est pas une imagerie de référence pour la caractérisation de l’AP et n’est pas recommandée en routine.
Évaluation moléculaire
Génétique somatique (tumorale)
La réalisation d’un profil moléculaire tumoral n’est pas recommandée en routine, mais peut être effectuée chez les patients ayant un AP métastatique aptes à recevoir un traitement anticancéreux, et potentiellement éligibles à une inclusion dans un essai clinique, à la recherche de mutations ou d’altérations moléculaires ciblables (7). Les principales anomalies à chercher incluent :
• l’instabilité des microsatellites (MSI), présente dans 1-2 % des AP, à confirmer par immunohistochimie. Cette anomalie, qui s’accompagne généralement d’une charge mutationnelle tumorale élevée, peut inciter à prescrire une immunothérapie par anti-PD-(L1), qui sont déjà recommandés dans cette situation par l’ASCO ;
• des mutations des gènes de la recombinaison homologue BRCA2 et BRCA1 (voire PALB2) (5-10 % des AP), qui doivent faire orienter le patient vers une consultation d’oncogénétique et peuvent faire envisager un ciblage par inhibiteur de PARP dans le cadre d’un essai clinique ;
• des mutations de KRAS, dont les mutations KRASG12C (1-2 % des AP) qui pourraient bénéficier d’un ciblage par inhibiteur spécifique (sotorasib ou adagrasib) dans le cadre d’un essai clinique ;
• en l’absence de mutation KRAS (10-15 % des AP), la recherche d’anomalies de fusion (1-2 % des AP), dont certaines (notamment impliquant ALK, NRG1, NTRK1/2, ROS1, ou FGFR2) peuvent faire l’objet d’un ciblage dans le cadre d’un essai clinique ;
• d’autres mutations éventuellement ciblables, comme BRAF ou des amplifications de HER2.
Génétique constitutionnelle
Il est nécessaire d’adresser le patient en consultation d’onco-
génétique en cas d’AP associé à une possible prédisposition héréditaire (8).
Indications d’une consultation oncogénétique
Chez les patients atteints d’AP, les principales indications sont :
• AP multifocal (synchrone ou métachrone), ou de survenue très précoce (< 51 ans), ou se manifestant chez un patient d’origine ashkénaze (mutations plus fréquentes et spécifiques de BRCA2) ;
• antécédents personnels (et/ou familiaux) évocateurs d’une forme syndromique : mélanome, cancer du sein, de l’ovaire, de la prostate, de l’intestin, ou du spectre du syndrome de Lynch, de la polypose adénomateuse familiale ou du syndrome de Peutz-Jeghers ;
• agrégation familiale de cas d’AP : trois apparentés atteints d’AP quel que soit le degré, ou apparenté au premier degré atteint d’AP ayant lui-même un apparenté au premier degré atteint d’AP ;
• identification au niveau somatique (tumoral) d’un variant pathogène d’un gène de prédisposition présentant une fréquence allélique élevée au sein de l’ADN tumoral.
Recherche d’un variant pathogène
Après information adaptée et recueil du consentement du patient, la consultation d’oncogénétique peut aboutir à la recherche d’un variant pathogène des gènes de prédisposition à l’AP, dont les principaux identifiés à ce jour sont ATM, BRCA1, BRCA2, CDKN2A, MLH1, MSH2, MSH6, PALB2, PMS2, STK11, et TP53. Néanmoins, une mutation de l’un de ces gènes n’est identifiée que chez environ 15-20 % des patients présentant un AP dans un contexte évocateur de prédisposition.
Conséquences de la démarche d’oncogénétique
La démarche d’oncogénétique a de multiples conséquences :
• à la suite de l’identification d’un variant pathogène d’un gène de prédisposition chez un patient ayant un AP, réaliser une enquête généalogique afin d’identifier les apparentés à tester au plan génétique (dépistage présymptomatique) ;
• chez les porteurs d’un variant pathogène, prendre en charge le risque d’autres cancers (sein, ovaire, colon, mélanome…) par des conseils de prévention et des examens de surveillance réguliers, voire par chirurgie prophylactique ;
• identifier les apparentés relevant du dépistage pancréatique, en fonction de l’identification du variant pathogène chez eux et/ou en fonction des antécédents familiaux d’AP ;
• en cas d’identification d’un variant pathogène d’un gène de la recombinaison homologue (BRCA2, BRCA1, PALB2), proposer un traitement par inhibiteur de PARP, aujourd’hui indiqué en maintenance après contrôle tumoral sous FOLFIRINOX.
Traitement oncologique
Traitement de première ligne
Chimiothérapie par gemcitabine
La chimiothérapie par gemcitabine a été établie comme traitement de référence de l’AP métastatique en 1997, suite à une étude de phase II randomisée ayant montré un bénéfice clinique supérieur au 5-FU (9). Par la suite, de multiples essais cliniques ont tenté d’améliorer les résultats de la gemcitabine seule, soit par modulation de sa pharmacocinétique, soit par association avec d’autres agents. Ni la perfusion de gemcitabine à un débit optimisé (fixed dose rate, FDR) ni le CO-101, sa forme conjuguée à un lipide, n’ont montré de supériorité (10). De même, les tentatives d’association à d’autres chimiothérapies ou thérapies ciblées ont été décevantes, bien que plusieurs méta-analyses regroupant ces essais ont montré un bénéfice des doublets de chimiothérapie (en particulier, gemcitabine avec dérivés de platine ou capécitabine) chez les patients en bon état général (PS 0-1) (11). Seule l’association de la gemcitabine à l’erlotinib a montré un bénéfice de survie statistiquement significatif en comparaison à la gemcitabine seule, mais cliniquement très modeste (< 1 mois) et non retrouvé en population de patients ayant un AP localement avancé (12, 13).
FOLFIRINOX
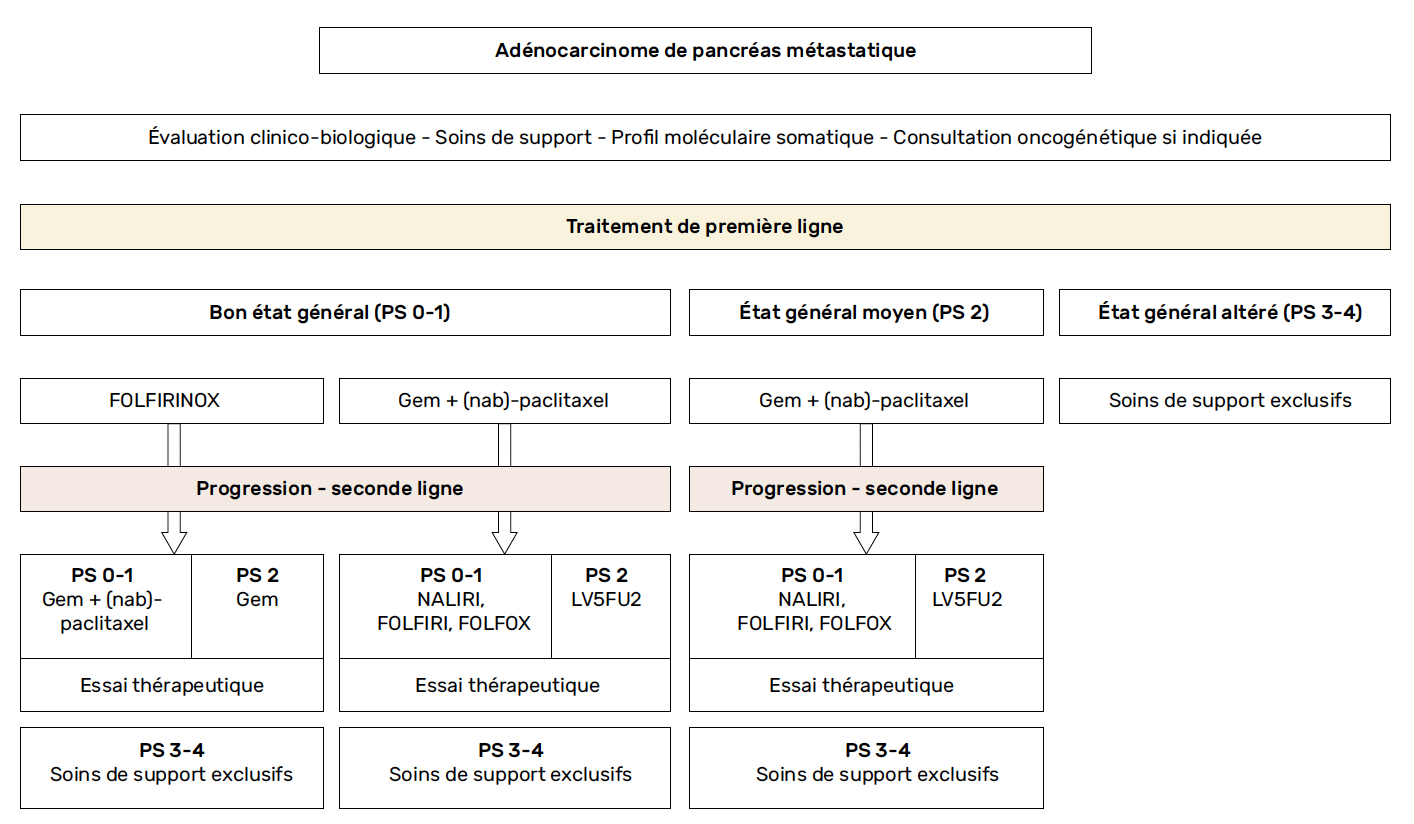
En 2011, l’étude de phase III PRODIGE-4/ACCORD-11 a démontré la supériorité du FOLFIRINOX (LV5-FU2, oxaliplatine et irinotécan) en comparaison à la gemcitabine seule (survie médiane de 11,1 versus 6,8 mois, p < 0,001) chez des patients âgés de moins de 75 ans avec un PS 0-1 et taux de bilirubine < 1,5 fois la limite supérieure de la normale (14). La polychimiothérapie par FOLFIRINOX est alors devenue la chimiothérapie de référence chez les patients ayant un AP métastatique en bon état général (Fig. 1). Le FOLFIRINOX modifié (sans bolus de 5-FU ± irinotécan diminué à 150 mg/m2) semble avoir un meilleur profil de tolérance et une efficacité similaire. De plus, l’étude PANOPTIMOX/PRODIGE-35 a montré qu’une maintenance par LV5-FU2 après huit cycles de FOLFIRINOX avait une efficacité similaire à la réalisation de 12 cycles de FOLFIRINOX, en permettant de retarder la dégradation de la qualité de vie (15).
Figure 1 – Algorithme de prise en charge du cancer pancréatique métastatique (adapté d’après 9).
Gem, gemcitabine ; PS : performance status
Maintenance par olaparib
Chez les patients porteurs d’un variant pathologique constitutionnel de BRCA2 ou BRCA1 et n’ayant pas progressé après 4 mois de chimiothérapie à base de platine, l’étude POLO a montré qu’une maintenance par olaparib (inhibiteur de PARP) permettait de prolonger la survie sans progression (médiane 7,4 versus 3,8 mois, p = 0,004) sans toutefois prolonger la survie globale (médiane 18,9 versus 16,1 mois, p = 0,68) (16).
Association gemcitabine + nab-paclitaxel
En 2013, l’association de la gemcitabine au nab-paclitaxel a montré une augmentation significative de la survie globale en comparaison à la gemcitabine seule (médiane 8,5 versus 6,7 mois, p < 0,001) (17). Le bénéfice de l’association gemcitabine et nab-paclitaxel semblait plus marqué dans le sous-groupe des patients en moins bon état général et, du fait d’une tolérance globalement meilleure, cette chimiothérapie est devenue une alternative pertinente au FOLFIRINOX chez des patients plus fragiles (PS 2, patients plus âgés) (Fig. 1) (18).
Association gemcitabine + paclitaxel
Le nab-paclitaxel se heurte à un problème de remboursement et de disponibilité en France, et l’étude GEMPAX a récemment rapporté la faisabilité de l’association gemcitabine-paclitaxel, qui représente donc une alternative plus facilement accessible (19). Dans cette étude de phase III, l’association gemcitabine-paclitaxel prolongeait la survie sans progression en comparaison à la gemcitabine seule (médiane 3,1 versus 2 mois, p = 0,007) et augmentait le taux de réponse (19 versus 5 %, p = 0,008), mais n’allongeait pas la survie globale (médiane 6,4 versus 5,9 mois, p = 0,41), potentiellement du fait de l’utilisation fréquente de taxanes à progression dans le groupe gemcitabine.
NALIRIFOX
Il n’existe pas d’étude comparant directement ces deux associations ni de marqueur prédictif de réponse validé pour l’un ou l’autre de ces schémas. Toutefois, l’étude NAPOLI-3 a récemment montré que le NALIRIFOX (LV5-FU2, oxaliplatine et irinotécan liposomal) prolongeait la survie globale en comparaison à l’association gemcitabine + nab-paclitaxel (médiane 11,1 versus 9,2 mois, p = 0,04) ainsi que la survie sans progression (médiane 7,4 versus 5,6 mois, p = 0,0001) (20). Bien que l’irinotécan liposomal n’ait pas (encore ?) obtenu d’AMM dans cette indication en France, et se heurte donc à un problème de remboursement et de disponibilité, cette étude incite à privilégier une tri-chimiothérapie (FOLFIRINOX, ou NALIRIFOX si disponible) en comparaison à une bi-chimiothérapie par gemcitabine + (nab)-paclitaxel lorsque cela est possible, notamment du fait d’un bon état général.
Traitement de seconde ligne
Seule la moitié environ des patients atteints d’AP métastatique sont en mesure de recevoir une ou plusieurs ligne(s) ultérieure(s) après progression sous une première ligne de chimiothérapie. Seuls les patients restant dans un bon état général (PS 0-1) semblent en tirer un bénéfice (Fig. 1). Les données concernant les traitements de seconde ligne chez les patients atteints d’AP métastatique progressant sous FOLFIRINOX ou gemcitabine + nab-paclitaxel sont principalement des études rétrospectives (21, 22).
Après progression sous gemcitabine, les principales associations rapportées sont les combinaisons du LV5-FU2 avec un platine (oxaliplatine ou carboplatine) ou l’irinotécan (forme standard ou liposomale) qui ont été principalement étudiées (23).
NALIRI
En particulier, le NALIRI (LV5-FU2 et irinotécan liposomal) a montré une amélioration de la survie globale en comparaison au LV5-FU2 (médiane 6,1 versus 4,2 mois, p = 0,012), ainsi que de la survie sans progression (médiane 3,1 versus 1,5 mois, p < 0,001) dans une étude de phase III (24) (Fig. 1).
Association LV5-FU2 + platine
Les données concernant l’association LV5-FU2 et platine sont plus controversées : l’essai de phase III CONKO-003 avait montré une amélioration de la survie globale (médiane 5,9 versus 3,3 mois, p = 0,010) de l’association 5-FU-oxaliplatine en comparaison au 5-FU seul, mais ce bénéfice n’était pas retrouvé avec le FOLFOX dans l’étude PANCREOX (25).
Conclusion
La prise de charge des patients ayant un AP métastatique doit être multidisciplinaire et globale, et nécessite la prévention, la recherche et le traitement des complications en lien avec la tumeur primitive et des métastases à chaque étape du parcours de soins. Elle implique la coopération de multiples spécialistes (gastro-entérologues, oncologues digestifs, radiologues, endoscopistes, radiothérapeutes, chirurgiens, oncogénéticiens, équipe de soins palliatifs, psychologues, oncogériatres…). Les soins de support doivent occuper une place centrale afin d’améliorer la tolérance des traitements antitumoraux, la qualité de vie, mais également la survie globale. Au vu des possibilités thérapeutiques limitées, l’inclusion des patients dans des essais cliniques doit être encouragée lorsque l’état général du patient le permet. L’identification des anomalies moléculaires ciblables à un stade précoce dans la prise en charge peut permettre de ne pas méconnaitre les rares patients ayant des anomalies moléculaires ciblables.
Ali Allouch et Anne-Laure Védie déclarent ne pas avoir de liens d’intérêt. Louis de Mestier déclare avoir des liens d’intérêt avec Servier et Viatris.
Bibliographie
1. Huang J, Lok V, Ngai CH et al. Worldwide burden of, risk factors for, and trends in pancreatic cancer. Gastroenterology 2021 ; 160 : 744-54.
2. Neuzillet C, Gaujoux S, Williet N et al. Pancreatic cancer: French clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC). Dig Liver Dis 2018 ; 50 : 1257-71.
3. Moffat GT, Epstein AS, O’Reilly EM. Pancreatic cancer-A disease in need: Optimizing and integrating supportive care. Cancer 2019 ; 125 : 3927-35.
4. Neuzillet C, Anota A, Foucaut A-M et al. Nutrition and physical activity: French intergroup clinical practice guidelines for diagnosis, treatment and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, ACHBT, AFC, SFP-APA, SFNCM, AFSOS). BMJ Support Palliat Care 2021 ; 11 : 381-95.
5. Coveler AL, Mizrahi J, Eastman B et al. Pancreas cancer-associated pain management. Oncologist 2021 ; 26 : e971-82.
6. Al-Hawary MM, Francis IR, Chari ST et al. Pancreatic ductal adenocarcinoma radiology reporting template: consensus statement of the society of abdominal radiology and the american pancreatic association. Gastroenterology 2014 ; 146 : 291-304.e1.
7. Pishvaian MJ, Blais EM, Brody JR et al. Overall survival in patients with pancreatic cancer receiving matched therapies following molecular profiling: a retrospective analysis of the Know Your Tumor registry trial. Lancet Oncol 2020 ; 21 : 508-18.
8. Hammel P, de Mestier L, Palazzo L et al. Formes familiales de cancer du pancréas. Onko+ 2022 ; 14 : 339-46.
9. Burris HA 3rd, Moore MJ, Andersen J et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 1997 ; 15 : 2403-13.
10. Poplin E, Wasan H, Rolfe L et al. Randomized multicenter, phase II study of CO-101 versus gemcitabine in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) and a prospective evaluation of the of the association between tumor hENT1 expression and clinical outcome with gemcitabine treatment. J Clin Oncol 2013 ; 31 : 4007.
11. Ciliberto D, Botta C, Correale P et al. Role of gemcitabine-based combination therapy in the management of advanced pancreatic cancer: A meta-analysis of randomised trials. Eur J Cancer 2013 ; 49 : 593-603.
12. Moore MJ, Goldstein D, Hamm J et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007 ; 25 : 1960-6.
13. Hammel P, Huguet F, van Laethem J-L et al. Effect of chemoradiotherapy vs chemotherapy on survival in patients with locally advanced pancreatic cancer controlled after 4 months of gemcitabine with or without erlotinib: the LAP07 randomized clinical trial. JAMA 2016 ; 315 : 1844.
14. Conroy T, Desseigne F, Ychou M et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011 ; 364 : 1817-25.
15. Dahan L, Williet N, Le Malicot K et al. Randomized phase II trial evaluating two sequential treatments in first line of metastatic pancreatic cancer: results of the PANOPTIMOX-PRODIGE 35 trial. J Clin Oncol 2021 ; 39 : 3242-50.
16. Golan T, Hammel P, Reni M et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. N Engl J Med 2019 ; 381 : 317-27.
17. Von Hoff DD, Ervin T, Arena F et al. Results of a randomized phase III trial (MPACT) of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone for patients with metastatic adenocarcinoma of the pancreas with PET and CA19-9 correlates. J Clin Oncol 2013 ; 31 : 4005.
18. Pignon F, Turpin A, Hentic O et al. Efficacy and tolerance of gemcitabine and nab-paclitaxel in elderly patients with advanced pancreatic ductal adenocarcinoma. Pancreatology 2021 ; S1424-3903(21)00157-5.
19. de la Fouchardiere C, Hammel P, Launay S et al. 1566TiP PRODIGE 65 – UCGI 36 – GEMPAX : A unicancer phase III randomized study evaluating gemcitabine and paclitaxel versus gemcitabine alone after FOLFIRINOX failure or intolerance in metastatic pancreatic ductal adenocarcinoma. Ann Oncol 2020 ; 31 : S954-5.
20. Wainberg ZA, Melisi D, Macarulla T et al. NAPOLI-3: A randomized, open-label phase 3 study of liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naïve patients with metastatic pancreatic ductal adenocarcinoma (mPDAC). J Clin Oncol 2023 ; 41 : LBA661.
21. Portal A, Pernot S, Tougeron D et al. Nab-paclitaxel plus gemcitabine for metastatic pancreatic adenocarcinoma after Folfirinox failure: an AGEO prospective multicentre cohort. Br J Cancer 2015 ; 113 : 989-95.
22. Taieb J, Prager GW, Melisi D et al. First-line and second-line treatment of patients with metastatic pancreatic adenocarcinoma in routine clinical practice across Europe: a retrospective, observational chart review study. ESMO Open 2020 ; 5 : e000587.
23. Yoo C, Hwang JY, Kim J-E et al. A randomised phase II study of modified FOLFIRI.3 vs modified FOLFOX as second-line therapy in patients with gemcitabine-refractory advanced pancreatic cancer. Br J Cancer 2009 ; 101 : 1658-63.
24. Wang-Gillam A, Li C-P, Bodoky G et al. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet 2016 ; 387 : 545-57.
25. Gill S, Ko Y-J, Cripps C et al. PANCREOX: a randomized phase III study of fluorouracil/leucovorin with or without oxaliplatin for second-line advanced pancreatic cancer in patients who have received gemcitabine-based chemotherapy. J Clin Oncol 2016 ; 34 : 3914-20.