Comme chaque année, Onko+ vous partage les moments forts des Rencontres scientifiques du GINECO afin de mettre en lumière les dernières avancées dans les cancers gynécologiques et du sein ainsi que les actualités du groupe. Au programme de cette édition : les recommandations de Saint-Paul-de-Vence dans les cancers de l’ovaire, du col de l’utérus et de l’endomètre, l’apport des inhibiteurs de PARP dans le cancer de l’ovaire, les nouveautés dans la prise en charge des cancers de l’ovaire séreux de haut grade, le débat autour de la prise en charge des cancers de l’endomètre pMMR métastatiques et un focus sur ChatGPT. Ce dossier est introduit par la nouvelle présidente du groupe, le Pr Alexandra Leary, la nouvelle vice-présidente, le Dr Laurence Gladieff, ainsi que par le nouveau directeur général d’ARCAGY-GINECO, Sébastien Armanet, et par le Pr Isabelle Ray-Coquard (past-présidente). Pour finir, Coralie Marjolet fait le bilan de l’année de l’association IMAGYN dont elle est présidente.
1 – 19es Rencontres 2025 : une belle édition tant au niveau de la qualité des topos scientifiques que de la super ambiance
Pr Alexandra Leary, Dr Laurence Gladieff, Pr Isabelle Ray-Coquard, Sébastien Armanet
Quels ont été les moments forts de ces rencontres ?
AL : Une très belle édition 2025 avec un nombre d’inscrits record et un amphithéâtre plein, témoignant de l’enthousiasme des investigateurs et équipes de recherche du GINECO ! Nous avons célébré comme il se devait le départ de Bénédicte Votan, qui quitte ARCAGY-GINECO après l’avoir dirigé pendant 22 ans !
LG : Ces journées sont, je crois, toujours très attendues et sont toujours un moment important de l’année en onco-gynécologie, par la qualité de leur contenu, mais également par leur convivialité. Cette année a été particulière et chargée d’une certaine émotion avec le départ de Bénédicte, mais le relais est assuré !
SA : Cette 19e édition des Rencontres scientifiques du GINECO fut une réussite ! Nous avons pu assister à de très belles présentations dans une ambiance toujours formidable. Ce fut également l’occasion d’un “passage de flambeau” après le renouvellement de la présidence. Nous avons déjà hâte de célébrer les 20 ans de ces Rencontres scientifiques l’an prochain.
Quel est le bilan du GINECO pour 2024 ?
LG : Toujours très positif, avec un “portefeuille” d’essais qui s’enrichit de plus en plus pour des situations qui nécessitent vraiment de progresser, comme les cancers de l’ovaire en rechute platino-résistante ou les cancers de l’endomètre métastatiques.
SA : Le bilan est très bon, avec plus de 1 800 patientes qui ont participé à une des 22 études du GINECO en France, dont 266 à l’international dans 17 pays ! Également une année record, puisque pas moins de 38 articles ont été publiés !
AL : En effet, ces chiffres témoignent de la dynamique très positive du GINECO en 2024 !
Quels sont les faits marquants de l’année ?
SA : Tout d’abord la fin du recrutement de Senticol III, qui aura inclus plus de 1 000 patientes et qui montre que la recherche académique peut réaliser des essais de grande envergure. Et puis le démarrage de SALVOVAR, un essai pragmatique soutenu par un financement européen qui s’adresse aux patientes de mauvais pronostic.
LG : La fin du recrutement d’un autre essai chirurgical académique, l’étude CHRONO, qui était un véritable défi pour le groupe, et nous sommes arrivés à le faire ! C’est maintenant avec impatience que nous attendons les résultats, qui, combinés à ceux de l’étude TRUST, qui seront présentés à l’ASCO cette année, pourraient redessiner le paysage chirurgical des cancers de l’ovaire en première ligne.
AL : Sans oublier les résultats de notre essai FIRST, promu par GSK et entièrement conçu avec le GINECO avec un design adaptatif novateur, qui ont été présentés en oral à l’ASCO début juin 2025, une phase III internationale évaluant l’intérêt d’une immunothérapie par dostarlimab en première ligne.
Quels sont les prochains enjeux et défis pour l’avenir ?
AL : La vague des ADC arrive en onco-gynécologie. Cette classe thérapeutique pourrait apporter de nouvelles options pour nos patientes, mais le défi sera de sélectionner le meilleur ADC pour chaque patiente.
LG : Pour continuer dans la métaphore “Haute Couture”, apprendre à travailler la dentelle ! De plus en plus de biomarqueurs vont devenir indispensables pour caractériser une tumeur gynécologique et adapter les ressources thérapeutiques en fonction de cette “carte d’identité” biologique. L’exemple le plus flagrant de cette évolution est très certainement celui des cancers de l’endomètre.
SA : Le recrutement de l’étude de désescalade DOMENICA, qui évalue la chimiothérapie seule versus dostarlimab en première ligne, doit se terminer prochainement. Comme le soulignent Alexandra et Laurence, nous voyons également arriver de nombreuses options thérapeutiques nouvelles qui nous demanderont de nous adapter aux contraintes de la réglementation sur les tests compagnons.
L’ENGOT
Pr Isabelle Ray-Coquard
En tant que présidente de l’ENGOT et past-présidente du groupe GINECO, il était important de vous illustrer le rôle de l’ENGOT et celui que le GINECO joue au sein de ce réseau rassemblant 21 groupes coopérateurs issus de 33 pays européens qui collaborent pour mener des essais cliniques coopératifs.
L’ENGOT est un réseau de recherche de la Société européenne d’oncologie gynécologique (ESGO) fondé en 2007 par Andreas Du Bois et Ignace Vergote. Son objectif est d’apporter le meilleur traitement aux patientes atteintes de cancer gynécologique grâce aux meilleures données scientifiques et de permettre à chaque patiente européenne d’accéder à un essai clinique.
• Depuis 2007, 151 essais ont été débutés, dont 74 de sponsor académique (par exemple PAOLA-1 ou DOMENICA) et 76 sponsorisés par les industriels (comme FIRST), ayant donné lieu à plus de 91 publications dans des journaux internationaux avec comité de relecture.
• Au-delà des essais thérapeutiques de phase III, l’ENGOT, ce sont également plusieurs sous-groupes comme le groupe de travail « early development », le groupe « translationnel » pour développer des biomarqueurs d’intérêt (projet tests HRD conduit par le GINECO), le groupe « tumeurs rares », mais aussi l’organisation du rendez-vous biennal du GCA (Gynecologic Cancer Academy) pour aider les plus jeunes experts à se former à la recherche clinique internationale.
• L’un des atouts majeurs réside également dans l’implication des groupes opérationnels, qui, à chaque étape des avancées de la recherche clinique, mettent sur pied des modes opératoires pour homogénéiser les pratiques et simplifier la vie de la recherche clinique internationale.
• Enfin, l’association de patientes IMAGYN participe à l’ENGOT via le groupe européen ENGAGE.
Bref, le GINECO par sa force et son dynamisme joue un rôle pivot au sein de l’ENGOT qui le lui rend bien en lui confiant cette présidence actuelle.
Pour plus d’informations : engot.esgo.org
2 – Cancer du col de l’utérus : highlights des recommandations de Saint-Paul-de-Vence
Dr Brunhilde Hanvic
D’après la présentation du Dr Cyrus Chargari (Paris)
Le cancer du col : une pathologie évitable, encore trop fréquente
Le cancer du col de l’utérus reste une maladie évitable, grâce au dépistage régulier et à la vaccination prophylactique. Le message est clair : la vaccination HPV est fortement recommandée chez les filles et les garçons dès l’âge de 11 ans. Une couverture vaccinale élevée est indispensable pour espérer une éradication à long terme.
Comment conduire le bilan initial ?
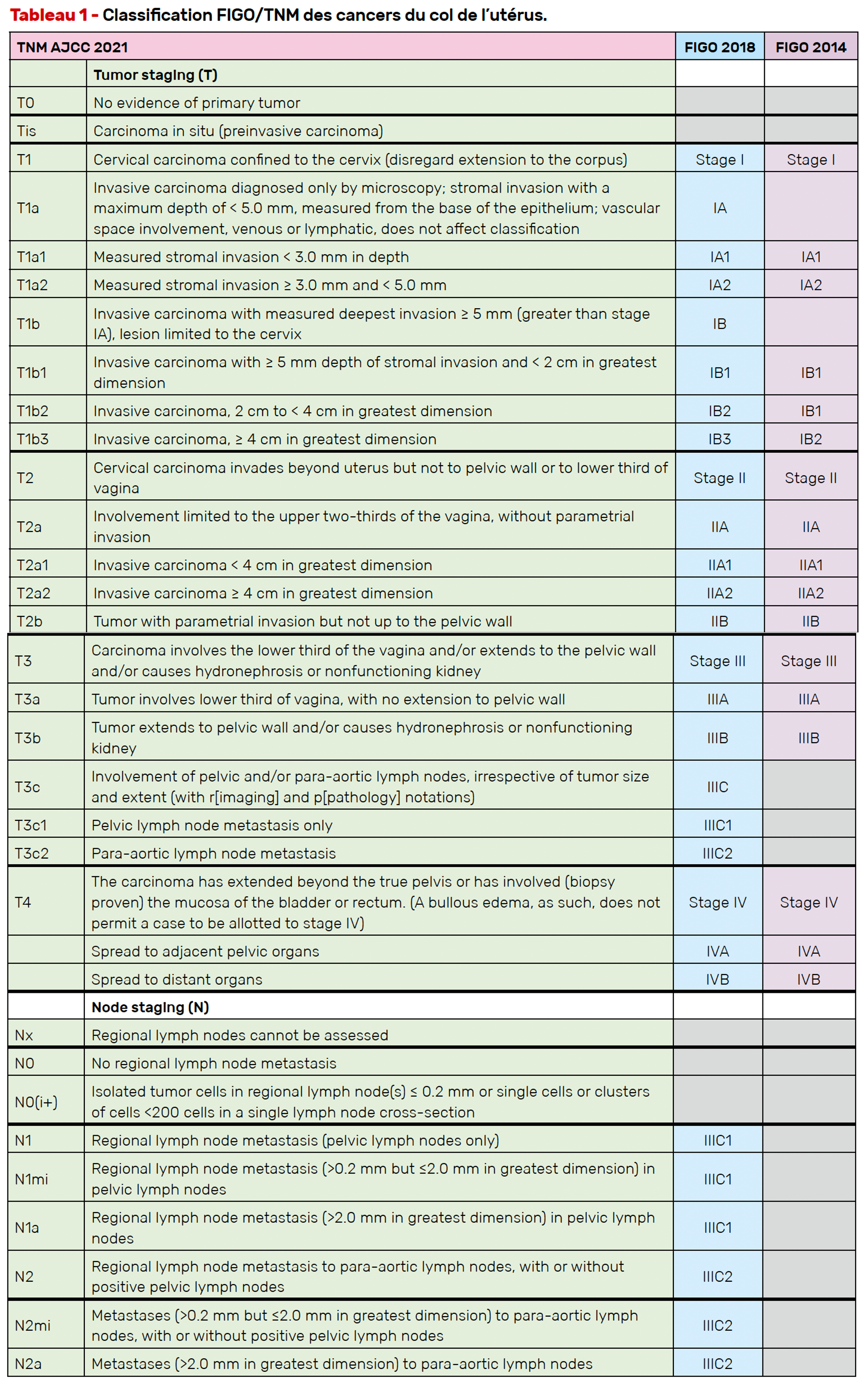
Le bilan d’extension repose sur l’IRM pelvienne et lombo-aortique ainsi que sur le TEP-scanner, recommandés dès les stades IB2 à IVA. Le staging doit suivre la classification TNM, en complément de la classification FIGO 2018, qui tient compte désormais de l’atteinte ganglionnaire (stade IIIC1/2) (Tab. 1). Il est également recommandé de rechercher des localisations secondaires de cancers liés à l’HPV, notamment ORL et ano-génitales.
Quelle place pour la conisation pré-thérapeutique et le ganglion sentinelle ?
La conisation pré-thérapeutique est indiquée :
• en cas d’échec de la biopsie ;
• pour affiner le stade FIGO dans les stades IA2 à IB1, en évaluant la profondeur d’infiltration, la présence d’emboles vasculaires, le statut des marges ;
• avant toute chirurgie mini-invasive si la tumeur est < 2 cm.
Concernant le ganglion sentinelle, sa réalisation bilatérale est recommandée par des équipes entraînées. En cas d’échec unilatéral, un curage homolatéral est requis.
Quelles adaptations en cas de chirurgie mini-invasive ?
Dans cette approche, certaines précautions sont nécessaires :
• absence de manipulateur ;
• fermeture vaginale ;
• extraction protégée ;
• conisation pré-opératoire pour les tumeurs ≤ 2 cm ;
• curiethérapie pré-opératoire pour les tumeurs > 2 cm.
Comment définir le risque chez les patientes N- localisées (FIGO 2018 IA2 à IB1) ?
Deux groupes de risque sont distingués selon les critères de l’étude SHAPE :
• bas risque (SHAPE-) : tumeur ≤ 2 cm, infiltration stromale < 50 % à l’IRM et < 1 cm sur la conisation ;
• risque intermédiaire (SHAPE+) : tumeur > 2 cm ou infiltration ≥ 50 % à l’IRM ou ≥ 1 cm sur la conisation.
Ces critères permettent d’adapter l’extension du geste chirurgical et l’éventuel traitement adjuvant.
Quand proposer une radiothérapie post-opératoire ?
La radiothérapie post-opératoire est réservée aux patientes avec facteurs de risque intermédiaires, tandis que la radio-chimiothérapie post-opératoire s’adresse aux formes à haut risque : atteinte ganglionnaire, berges positives ou atteinte des paramètres.
Quel schéma pour les stades localement avancés ?
Pour les stades IB3 à IVA, la chirurgie n’a plus sa place. Le traitement repose sur une radio-chimiothérapie concomitante, suivie d’une curiethérapie. En l’absence de résidu tumoral, une chirurgie de clôture n’est pas indiquée.
Quelles nouveautés thérapeutiques en 2025 ?
Immunothérapie en concomitance et maintenance
L’étude KEYNOTE-A18 évalue l’ajout du pembrolizumab à la radio-chimiothérapie, suivi d’une maintenance pour une durée maximale de 24 mois. Depuis février 2025, un accès précoce est disponible en France pour les patientes correspondant aux stades FIGO 2018 IIIA, IIIB, IIIC (si stade T3 de la TNM), IVA (1).
Chimiothérapie d’induction
L’étude INTERLACE a démontré un bénéfice en survie pour les patientes traitées par carboplatine AUC2 + paclitaxel 80 mg/m² hebdomadaire pendant 6 semaines, suivis d’une radio-chimiothérapie à partir de la 7e semaine, si les critères d’inclusion sont respectés (grade B niveau 2) : FIGO (2018) IB1-2N+ ou IB3-IVA, exclusion des N2 (IIIC2) (2).
Pour les patientes candidates à une immunothérapie, la chimiothérapie d’induction n’est pas recommandée.
Essai en cours
L’essai thérapeutique COLIBRI-2, actuellement ouvert en France, évalue la radio-chimiothérapie associée au nivolumab ± inhibiteur de LAG-3. Il permet l’inclusion de patientes à un stade plus précoce, du stade FIGO (2018) II à IV, quel que soit le statut ganglionnaire.
Faut-il discuter la préservation ovarienne ?
Oui, elle doit être envisagée chez les femmes jeunes, atteintes de tumeurs
< 4 cm, localisées au col, sans atteinte ganglionnaire, et d’histologie liée à l’HPV (épidermoïde ou adénocarcinome). Dans ce contexte, une transposition ovarienne doit être proposée avant tout traitement par radiothérapie.
À retenir
• Le dépistage et la vaccination restent les piliers de la prévention.
• La radio-chimiothérapie reste le standard des formes localement avancées, sans indication de chirurgie de clôture en cas de réponse complète.
• KEYNOTE-A18 ouvre la voie à l’immunothérapie en première ligne chez les patientes à haut risque locorégional.
Les arbres décisionnels actualisés sont disponibles en ligne sur le site de l’ARCAGY-GINECO, dans les recommandations issues des Rencontres de Saint-Paul-de-Vence 2025.
Bibliographie
1. Lorusso D, Xiang Y, Hasegawa K et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, high-risk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): a randomised, double-blind, phase 3 clinical trial. Lancet 2024 ; 403 : 1341-50.
2. McCormack M, Eminowicz G, Gallardo D et al. Induction chemotherapy followed by standard chemoradiotherapy versus standard chemoradiotherapy alone in patients with locally advanced cervical cancer (GCIG INTERLACE): an international, multicentre, randomised phase 3 trial. Lancet 2024 ; 404 : 1525-35. [published correction in Lancet 2025 ; 405 : 468].
3 – Cancer de l’ovaire : highlights des recommandations de Saint-Paul-de-Vence
Dr Brunhilde Hanvic
D’après la présentation du Dr Manuel Rodrigues (Paris)
La stratégie de prise en charge varie selon le stade FIGO. Il est rappelé que toute chirurgie carcinologique ovarienne doit être réalisée dans un établissement disposant de soins continus et d’une autorisation chirurgicale de type B5 avec PTS ovaire. Le scanner TAP injecté reste l’examen de référence, quel que soit le stade FIGO. L’IRM et le TEP-scan ne sont pas recommandés de manière systématique.
Dans les formes localisées (FIGO I-II)
Curage
Le curage pelvien et lombo-aortique reste recommandé, même en l’absence d’adénopathies suspectes à l’imagerie ou de découverte en per-opératoire. Environ 15 % des patientes présentent une atteinte ganglionnaire, ce qui modifie la prise en charge avec une indication de traitement de maintenance.
Préservation de la fertilité
La préservation de la fertilité est possible pour les stades IA avec atteinte unilatérale. Elle n’est pas indiquée en cas d’atteinte bilatérale (IB) et se discute au cas par cas en cas d’unilatéralité avec rupture tumorale (IC1/2).
Dans les stades avancés (FIGO III-IV)
Curage
En l’absence d’adénopathie suspecte, il n’y a pas d’indication de curage. Si des adénomégalies étaient visibles au diagnostic puis disparues après chimiothérapie, la réalisation d’un curage reste discutée, car ces patientes n’étaient pas incluses dans les essais LION ou CARACO.
CHIP
La CHIP est réservée aux patientes de stade III initialement non résécables devenues opérables (CC0) après trois cycles de chimiothérapie, selon l’étude OVHIPEC-1. Hors essai, elle n’a pas de place lors d’une chirurgie première.
Chirurgie
Pour les stades IVB, la chirurgie n’est à discuter qu’après régression partielle ou complète sous chimiothérapie des lésions définissant le stade IVB.
Le délai entre chirurgie et reprise de la chimiothérapie doit être court (4 à 6 semaines), voire immédiat après une cœlioscopie diagnostique sans chirurgie possible.
Maintenance
La stratégie de maintenance en première ligne, guidée par le statut BRCA/HRD et l’éligibilité au bévacizumab, est abordée plus en détail dans la présentation du Dr Frédéric Selle (voir pages dédiées).
Dans les situations de rechute platine sensible
Chirurgie
La chirurgie est à envisager si elle peut être complète selon les critères AGO (chirurgie initiale R0, ascite < 500 ml, bon état général). Elle peut être réalisée d’emblée (Desktop III) (1) ou après chimiothérapie et associée à une CHIP (CHIPOR) (2).
En cas de rechute sous iPARP, un intervalle > 6 mois ne reflète pas nécessairement une véritable platino-sensibilité : ces tumeurs peuvent être chimio-résistantes, à prendre en compte avant d’envisager une chirurgie.
Maintenance
En termes de maintenance, pas de nouvelle ligne de iPARP si la patiente a déjà été traitée. Le rechallenge par bévacizumab peut être discuté selon les résultats de l’étude MITO-16 (3) (Encadré 1), ce qui justifie son ajout dans les recommandations, à discuter avec la pharmacie de son établissement. Il n’y a en revanche pas d’indication à combiner PARPi et bévacizumab à ce stade.
Encadré 1 – Étude MITO 16 (3)
• Étude de phase III chez des patientes avec cancer de l’ovaire récidivant sensible au platine après un premier traitement contenant du bévacizumab.
• L’ajout de bévacizumab à une chimiothérapie à base de carboplatine a significativement amélioré la survie sans progression (SSP) : 11,8 versus 8,8 mois (HR = 0,51 ; IC 95 % : 0,41-0,65 ; p < 0,0001).
Dans les situations de rechute platine résistante
La chirurgie n’a pas sa place dans cette situation sauf à visée palliative.
La nouveauté majeure est l’accès au mirvétuximab soravtansine (Elahere®), validé selon les résultats de l’étude de phase III MIRASOL (Encadré 2) (4), avec bénéfice en survie globale (SG) et sans progression (SSP). Il est indiqué chez les patientes avec expression FOLR1 élevée (> 75 % en IHC) et au maximum trois lignes de chimiothérapie préalables.
Encadré 2 – Étude MIRASOL (4)
• Le mirvétuximab soravtansine est un anticorps conjugué (ADC) ciblant FOLR1.
• Population : patientes atteintes de cancer de l’ovaire platino-résistant avec expression FOLR1 ≥ 75 %.
• SSP : 5,6 versus 4,0 mois (p < 0,001).
• SG : 16,5 versus 12,8 mois (HR = 0,67 ; IC 95 % : 0,50-0,89).
• Taux de réponse objectif (TRO) : 42 versus 16 % sous chimiothérapie.
Les arbres décisionnels actualisés sont disponibles en ligne sur le site de l’ARCAGY-GINECO, dans les recommandations issues des Rencontres de Saint-Paul-de-Vence 2025.
Bibliographie
1. Harter P, Sehouli J, Vergote I et al. Randomized trial of cytoreductive surgery for relapsed ovarian cancer. N Engl J Med 2021 ; 385 : 2123-31. [published correction in N Engl J Med 2022 ; 386 : 704].
2. Classe JM, Meeus P, Hudry D et al. Hyperthermic intraperitoneal chemotherapy for recurrent ovarian cancer (CHIPOR): a randomised, open-label, phase 3 trial. Lancet Oncol 2024 ; 25 : 1551-62.
3. Pignata S, Lorusso D, Joly F et al. Carboplatin-based doublet plus bevacizumab beyond progression versus carboplatin-based doublet alone in patients with platinum-sensitive ovarian cancer: a randomised, phase 3 trial. Lancet Oncol 2021 ; 22 : 267-76.
4. Moore KN, Angelergues A, Konecny GE et al. Mirvetuximab soravtansine in frα-positive, platinum-resistant ovarian cancer. N Engl J Med 2023 ; 389 : 2162-74.
ChatGPT : un outil utile pour la recherche clinique ?
Dr Brunhilde Hanvic
D’après la présentation du Dr Thomas Gaillard (Paris)
L’essor des modèles de langage (LLM) comme ChatGPT ouvre des perspectives intéressantes pour la recherche clinique, à condition d’en connaître les limites.
Ces outils génèrent des réponses plausibles en se fondant sur des prédictions statistiques. Cela implique un risque d’“hallucinations”, en particulier dans les références bibliographiques, parfois inventées de toutes pièces. Il est donc essentiel de vérifier les contenus générés et de les réserver à des domaines que l’on maîtrise. Le prompt – c’est-à-dire la consigne donnée au modèle – doit être précis, structuré et contextualisé pour produire des résultats fiables.
Pour la rédaction scientifique, les LLM se révèlent très efficaces : synthèse de textes, abstracts, lettres de motivation, réponses aux reviewers… Ils permettent aussi d’extraire rapidement des informations de protocoles ou de générer des trames de projets.
Des outils spécialisés comme Elicit, bien que moins puissants, sont plus fiables pour la bibliographie, en classant les articles selon la qualité des études. Pour les statistiques, les LLM peuvent générer du code et en expliquer les étapes de manière pédagogique.
Mais la question de la protection des données reste centrale : à ce jour, aucune garantie n’est apportée sur l’usage ou la conservation des données saisies. Il est donc exclu d’y intégrer des informations sensibles ou des dossiers patients.
Un enjeu majeur à venir concerne la constitution de bases de données cliniques à partir des dossiers patients, qu’ils soient rétrospectifs ou prospectifs via l’intégration sécurisée de ces technologies en interne, au sein des hôpitaux, pour concilier performance et respect des exigences de confidentialité.
4 – Les inhibiteurs de PARP en maintenance seuls ou en combinaison avec le bévacizumab peuvent-ils changer la survie globale dans le cancer de l’ovaire ?
Dr Brunhilde Hanvic
D’après la présentation du Dr Frédéric Selle (Paris)
Une efficacité modulée par l’hétérogénéité des patientes
Les essais d’iPARP ont inclus des populations très différentes : chirurgie d’emblée, chirurgie intervalle, patientes avec ou sans résidu tumoral. À cela s’ajoute l’hétérogénéité biologique : mutation BRCA, statut HRD ou HRP. Ces éléments influencent fortement les résultats, en particulier la SG.
D’autres facteurs compliquent l’analyse :
• le choix du bras contrôle, un placebo ou une maintenance active ;
• des critères de jugement centrés sur la SSP, la SG étant souvent secondaire ;
• la sélection des patientes ;
• le traitement en monothérapie ou combinaison avec un anti-angiogénique ;
• le test HRD utilisé ;
• et la durée de traitement (2 ou 3 ans).
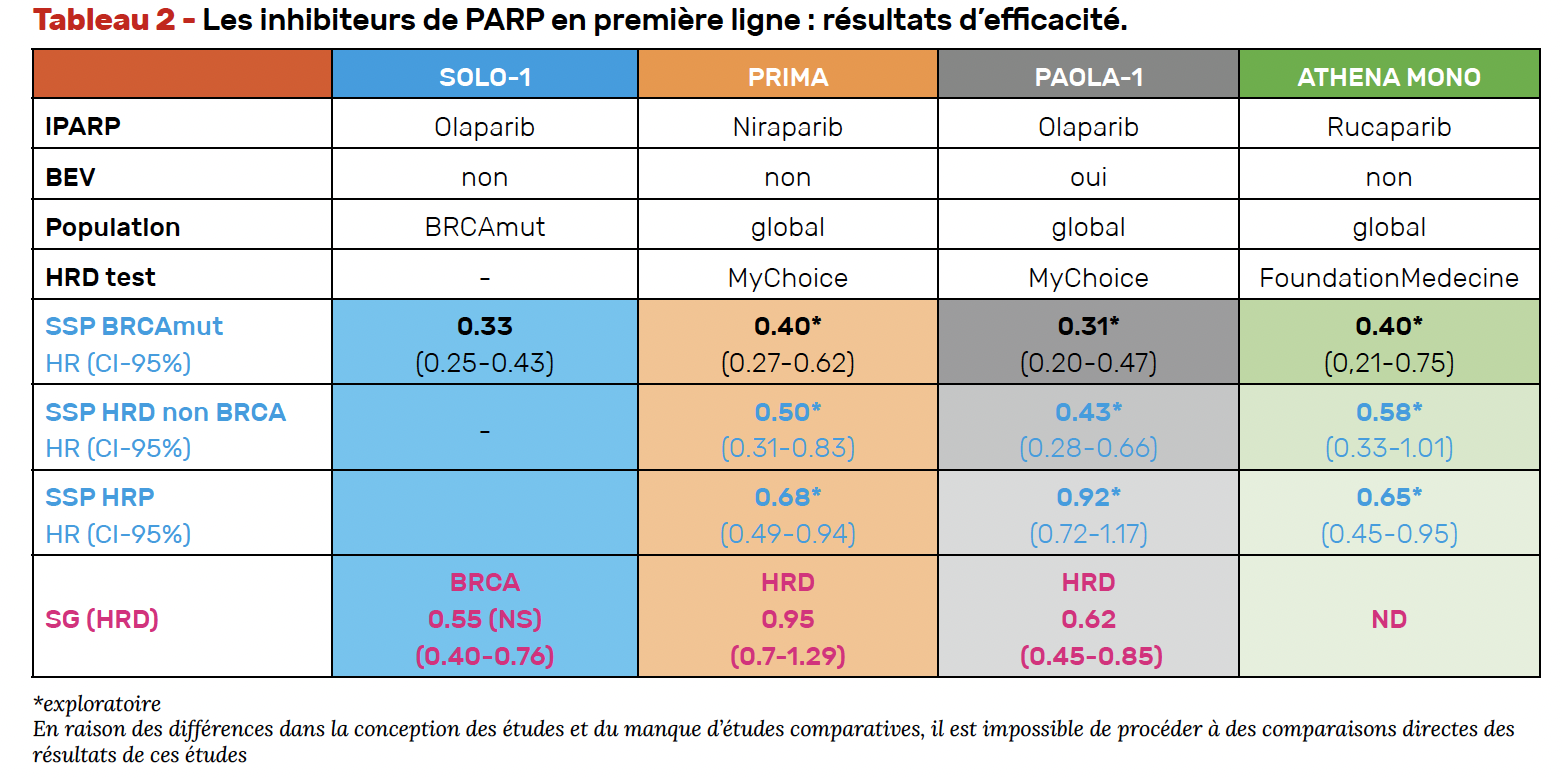
Ce que nous apprennent les grands essais (Tab. 2)
• Dans SOLO-1, le bénéfice en SG est net : les patientes BRCA mutées opérées R0 bénéficient d’un allongement de la survie sans rechute (SSR) et de la SG cliniquement significatif après plus de 7 ans de recul (1, 2).
• PAOLA-1 (olaparib + bévacizumab) montre une amélioration nette de la SSP à 6 ans (46 versus 19 %). En intention de traiter, le gain de SG n’est pas statistiquement significatif, mais il l’est dans la population HRD (HR : 0,62 ; IC 95 % : 0,45-0,85) à 5 ans (3, 4).
• À l’inverse, l’étude PRIMA (niraparib), bien que positive sur la SSP, même chez les HRP, ne montre aucune amélioration de SG, même en population HRD (56 versus 55 % à 5 ans) (5, 6).
• Enfin, ATHENA (rucaparib) montre une SSP prolongée, mais les données de SG sont encore immatures. Les sous-groupes sont trop restreints pour conclure, notamment chez les patientes non opérées R0 (7).
Pourquoi PRIMA ne montre-t-elle pas de bénéfice en survie globale ?
• La sélection des patientes, à haut risque (35 % de stade IV, 47 % avec résidu post-chirurgical), mais également très chimio-sensibles, avec une excellente survie dans le bras placebo.
• La durée de traitement de 3 ans soulève des questions : une exposition prolongée aux iPARP pourrait induire une résistance secondaire, rendant les rechutes moins sensibles aux sels de platine (8).
• Les traitements de rechute peuvent avoir affecté la seconde SSP : 38% des patientes du bras placebo ont reçu un iPARP à la rechute (mais comme dans PAOLA), 38 % des patientes ont reçu du bévacizumab à la rechute, et 15 % ont bénéficié d’une chirurgie secondaire. Ces interventions sont potentiellement incidentes sur la SG (6).
• Le profil pharmacocinétique du niraparib serait à explorer plus en détail : des interruptions précoces fréquentes et des réductions de doses de 50 % (200 mg, palier suivant 100 mg).
• Enfin, l’une des hypothèses avancées repose sur l’absence, dans PRIMA, de l’effet combiné du bévacizumab, qui dans PAOLA, via l’hypoxie induite, pourrait renforcer le phénotype HRD et potentialiser l’efficacité de l’iPARP.
Cependant, il ne faut pas oublier que le bénéfice en SG est un bénéfice difficile à mettre en évidence, tant les traitements suivants, le recueil de données prolongé, les patients perdus de vue sont des facteurs difficiles à contrôler.
Bibliographie
1. Moore K, Colombo N, Scambia G et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2018 ; 379 : 2495-505.
2. DiSilvestro P, Banerjee S, Colombo N et al. Overall survival with maintenance olaparib at a 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA Mutation: the SOLO1/GOG 3004 trial. J Clin Oncol 2023 ; 41 : 609-17.
3. Ray-Coquard I, Pautier P, Pignata S et al. Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. N Engl J Med 2019 ; 381 : 2416-28.
4. Ray-Coquard I, Leary A, Pignata S et al. Olaparib plus bevacizumab first-line maintenance in ovarian cancer: final overall survival results from the PAOLA-1/ENGOT-ov25 trial. Ann Oncol 2023 ; 34 : 681-92.
5. González-Martín A, Pothuri B, Vergote I et al. Niraparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2019 ; 381 : 2391-402.
6. Monk BJ, Barretina-Ginesta MP, Pothuri B et al. Niraparib first-line maintenance therapy in patients with newly diagnosed advanced ovarian cancer: final overall survival results from the PRIMA/ENGOT-OV26/GOG-3012 trial. Ann Oncol 2024 ; 35 : 981-92.
7. Monk BJ, Parkinson C, Lim MC et al. A randomized, phase III trial to evaluate rucaparib monotherapy as maintenance treatment in patients with newly diagnosed ovarian cancer (ATHENA-MONO/GOG-3020/ENGOT-ov45). J Clin Oncol 2022 ; 40 : 3952-64.
8. Harter P, Marth C, Mouret-Reynier MA et al. Efficacy of subsequent therapies in patients with advanced ovarian cancer who relapse after first-line olaparib maintenance: results of the PAOLA-1/ENGOT-ov25 trial. Ann Oncol 2025 ; 36 : 185-96.
5 – Quelles nouveautés dans la prise en charge des cancers de l’ovaire séreux de bas grade ?
Dr Brunhilde Hanvic
D’après la présentation des Drs Diana Bello Roufai et Enora Laas (Paris)
Les cancers de l’ovaire séreux de bas grade (LGSC) représentent moins de 10 % des cancers de l’ovaire. Ils se distinguent des formes de haut grade par une évolution plus lente, une survie globale meilleure, mais une faible chimio-sensibilité (taux de réponse à la chimiothérapie à base de platine < 25 %) (1). Ils touchent généralement des femmes jeunes, avec des symptômes tardifs et un diagnostic souvent à un stade avancé.
Profil anatomo-pathologique et biologique
Ces tumeurs présentent une architecture papillaire, micro-papillaire ou glandulaire, avec peu d’atypies et une faible activité mitotique. Elles sont souvent précédées de tumeurs border-
line. Elles expriment fortement les récepteurs hormonaux (ER+++ et PR++). Sur le plan moléculaire, on note l’absence de mutation de TP53 et des altérations de la voie MAPK dans 50 % des cas (KRAS, BRAF, NRAS), ainsi que des anomalies comme la perte de CDKN2A et d’ATM.
Prise en charge initiale : quelle stratégie ?
Chirurgie, chimiothérapie et hormonothérapie
La prise en charge repose avant tout sur la chirurgie, y compris en cas de stade avancé. La chimiothérapie première doit être discutée en RCP dédiée (tumeurs rares gynécologiques – TMRG www.ovaire-rare.org) dans ce contexte de tumeurs peu chimio-sensibles. La chimiothérapie adjuvante peut être proposée à partir du stade IC2 (rupture tumorale per-opératoire). À partir du stade III, une association puis une maintenance par bévacizumab sont recommandées notamment dans les cas de chirurgie complexe. En cas de contre-indication, une hormonothérapie en maintenance peut être proposée.
Maintenance
Le traitement de maintenance repose pour l’instant sur des analyses rétro-spectives en sous-groupes provenant d’études de phase III incluant plusieurs sous-types histologiques.
Les essais en cours
Plusieurs essais de phase III (MATAO, NRG-GY019, LEPRE) sont en cours pour mieux définir la place de l’hormonothérapie en post-opératoire après chirurgie première. Ils comparent une hormonothérapie à la chimiothérapie ou à un placebo, en situation de maintenance ou de première ligne. Si positifs, ces essais pourraient redéfinir la place de l’hormonothérapie.
Enjeux chirurgicaux et spécificités
En l’absence de données solides sur la valeur du résidu tumoral, la priorité reste une résection R0. Le choix entre une chirurgie d’emblée, même incomplète (R1), et une chimiothérapie néoadjuvante n’est pas tranché.
Une étude rétrospective portant sur 255 patientes a montré une meilleure survie avec chirurgie première par rapport à la stratégie de chimiothérapie d’induction, sans permettre de conclure sur la supériorité d’une chirurgie R1 versus une chimiothérapie première (2).
Focus préservation de la fertilité
Une étude rétrospective (3) suggère l’absence d’atteinte utérine dans les stades précoces (FIGO I), ouvrant la voie à une conservation utérine sélective à discuter en RCP TMRG.
Quelle stratégie ganglionnaire en précoce ?
Dans les stades précoces, un curage ganglionnaire est actuellement recommandé dans le cadre de la stadification chirurgicale. Chez certaines patientes, iI peut conduire à un changement de stade, initialement considéré comme précoce. Une méta-analyse montre que 12,6 % des patientes étaient en réalité N+ (4). Néanmoins, une autre méta-analyse nuance ces résultats, ne retrouvant pas de gain en SSP dans cette situation (5). Pour le moment, le curage ganglionnaire reste indiqué selon les recommandations afin d’adapter la stratégie adjuvante, mais sa pertinence pourrait être réévaluée à l’avenir.
Récidive et traitements innovants
En cas de récidive, une résection chirurgicale complète doit être envisagée en priorité, en centre expert. En l’absence de chirurgie possible, l’hormonothérapie et la chimiothérapie restent les options disponibles. Mais plusieurs études montrant l’efficacité d’autres classes thérapeutiques sont prometteuses.
Thérapies ciblées
• Des inhibiteurs de MEK ont montré des taux de réponse prometteurs (jusqu’à 50 % chez les patientes MAPK mutées) dans plusieurs essais (GOG-281, MILO, BOUQUET) (6-9).
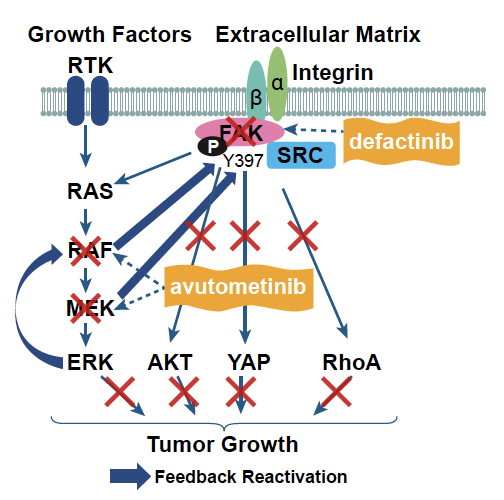
• L’association avutométinib + défactinib, évaluée dans l’étude RAMP-201, a démontré un taux de réponse global de 31 %, avec une efficacité marquée selon le statut KRAS : 44 % chez les patientes présentant une mutation KRAS, contre 17 % chez celles ayant un KRAS sauvage. La durée médiane de réponse atteignait 31 mois dans le groupe KRAS muté, contre 9,2 mois dans le groupe KRAS sauvage (10).
L’avutométinib est un double inhibiteur de MEK et RAF. Ce blocage peut entraîner une activation compensatoire de la voie FAK, un mécanisme d’échappement. L’ajout de défactinib, inhibiteur de FAK, vise à contrer ce contournement et à prolonger l’efficacité du traitement (Fig. 1). La phase III (RAMP-301) contre traitement standard (chimiothérapie ou hormonothérapie), avec cross-over possible, est en cours de recrutement avec plusieurs centres ouverts en France.
Figure 1 – Mécanisme d’action de l’association avutométinib + défactinib.
• Une autre stratégie testée est l’association inhibiteur de CDK4/6 + anti-aromatase. Elle repose sur le rationnel biologique d’une activation de la voie CDK4/6 via la perte de CDKN2A (souvent présente dans ces tumeurs), qui code pour p16, un régulateur de l’interaction entre la cycline D et CDK4/6. L’essai associant ribociclib + létrozole a montré un taux de réponse de 23 %, avec un bénéfice clinique de 79 % (GOG 3026, SGO 2023). L’essai ALEPRO évalue actuellement abémaciclib + létrozole dans les tumeurs ovariennes séreuses de bas grade, endométrioïdes de bas grade et tumeurs à cellules de la granulosa adulte.
Et l’immunothérapie ?
• Explorée dans l’essai BOUQUET (atézolizumab + bévacizumab) en situation platine résistante, elle a montré des résultats encourageants (14 % de réponse, 71 % de contrôle de maladie) (8).
• L’essai PERCEPTION évalue actuellement l’ajout du pembrolizumab à la chimiothérapie dans les formes platino-sensibles.
Le développement de nouvelles options thérapeutiques dans ces tumeurs rares repose sur l’accès à des bases de données robustes et sur le renforcement des efforts de recherche translationnelle. Les réseaux dédiés aux tumeurs rares jouent un rôle clé pour centraliser les données, structurer les essais et accélérer les avancées dans ces pathologies peu fréquentes.
Bibliographie
1. Grabowski JP, Harter P, Heitz F et al. Operability and chemotherapy responsiveness in advanced low-grade serous ovarian cancer. An analysis of the AGO Study Group metadatabase. Gynecol Oncol 2016 ; 140 : 457-62.
2. Madar A,Hotton J, Bats AS et al. Surgical outcomes in low-grade serous ovarian cancer: comparing primary debulking surgery with neoadjuvant chemotherapy. Int J Gynecol Cancer 2025 ; 35 : 100316.
3. Petiot F, Descargues P, Devouassoux-Shisheboran M et al. Retrospective analysis of uterine involvement in low grade serous ovarian carcinoma. Eur J Obstet Gynecol Reprod Biol 2024 ; 294 : 191-7.
4. Viveros-Carreño D, Rodriguez J, Pareja R. Incidence of lymph node metastasis in early-stage low-grade serous ovarian cancer: a systematic review. Int J Gynecol Cancer 2022 ; 32 : 1283-8.
5. Montero-Macías R, Segura-Sampedro JJ, Rigolet P et al. The role of systematic lymphadenectomy in low-grade serous ovarian cancer: a systematic review and meta-analysis. Cancers 2024 ; 16 : 955.
6. Farley J, Brady WE, Vathipadiekal V et al. Selumetinib in women with recurrent low-grade serous carcinoma of the ovary or peritoneum: an open-label, single-arm, phase 2 study. Lancet Oncol 2013 ; 14 : 134-40.
7. Gershenson DM, Miller A, Brady WE et al. Trametinib versus standard of care in patients with recurrent low-grade serous ovarian cancer (GOG 281/LOGS): an international, randomised, open-label, multicentre, phase 2/3 trial. Lancet 2022 ; 399 : 541-53.
8. Ray-Coquard I, Pignata S, Lee JY et al First results from the ENGOT-GYN2/GOG-3051/BOUQUET phase 2 biomarker-directed platform study: cobimetinib (cobi) or atezolizumab (atezo) + bevacizumab (bev) for persistent/recurrent rare epithelial ovarian cancer (eOC). Ann Oncol 2023 ; 34 : abst. 747MO.
9. Monk BJ, Grisham RN, Banerjee S et al. MILO/ENGOT-ov11: binimetinib versus physician’s choice chemotherapy in recurrent or persistent low-grade serous carcinomas of the ovary, fallopian tube, or primary peritoneum. J Clin Oncol 2020 ; 38 : 3753-62.
10. Banerjee SN, Ring KL, Van Niewenhuysen ELS et al. Initial efficacy and safety results from ENGOT-ov60/GOG-3052/RAMP 201: A phase 2 study of avutometinib (VS-6766) ± defactinib in recurrent low-grade serous ovarian cancer (LGSOC). Int J Gyn Cancer 2024 ; 33 : abst. 523.
6 – Cancer de l’endomètre : highlights des recommandations de Saint-Paul-de-Vence
Dr Brunhilde Hanvic
D’après la présentation du Dr Jérôme Alexandre (Paris)
Quels tests rechercher en anatomopathologie et biologie moléculaire en première intention ?
Les analyses IHC et NGS doivent être réalisées sur le curetage initial plutôt que sur la pièce d’hystérectomie, souvent moins bien fixée. En situation métastatique, on privilégiera la biopsie la plus récente, en évitant les biopsies osseuses.
Plusieurs marqueurs sont discutés :
• panel NGS : à titre systématique non recommandé (mutations de POLE exceptionnelles au stade avancé 1 %, de plus ciblées par l’immunothérapie). Mais indiqué si résultat p53 et MMR douteux en IHC et si accès à essais thérapeutiques ;
• récepteurs hormonaux : à rechercher systématiquement avec un score quantitatif ;
• HER2 : pas encore d’AMM, mais pourrait avoir une valeur théranostique à l’avenir ;
• PD-L1 : non validé dans l’endomètre, inutile en pratique ;
• tests HRD actuellement disponibles : non recommandés, car non transposables depuis le cancer de l’ovaire ;
• BRCA : pas de recherche systématique, sauf contexte familial.
Quelle prise en charge en première ligne avancée dans le cancer de l’endomètre ?
dMMR
L’association chimiothérapie (carboplatine paclitaxel) + anti-PD-1 puis maintenance par anti-PD-1 améliorent la SSP et la SG.
Trois anti-PD-1 disposent d’une AMM européenne : dostarlimab, durvalumab, pembrolizumab. En France, seul le dostarlimab bénéficie d’un accès précoce.
pMMR
La même association améliore la SSP, avec des données favorables, mais plus incertaines sur la SG. La chimiothérapie seule reste une option, notamment en cas de contre-indication à l’immunothérapie, ou si la patiente est éligible à un traitement par lenvatinib en 2e ligne en association au pembrolizumab.
AMM européenne pour pembrolizumab et dostarlimab, seul ce dernier est accessible en France.
L’hormonothérapie peut être proposée en cas de maladie RH+, de bas grade et à évolution lente.
Cas particuliers et situations limites
Les patientes stade III ou IVA non réséquées complètement étaient incluses dans les essais de 1re ligne, et peuvent recevoir une immunothérapie. La radiothérapie pelvienne ± lombo-
aortique reste recommandée.
• En cas de récidive > 6 mois après la chimiothérapie adjuvante, l’association chimiothérapie + immunothérapie peut être rediscutée.
• Si la rechute survient < 6 mois, un traitement par pembrolizumab + lenvatinib est recommandé, étant donné que ces patientes n’étaient pas incluses dans les essais de chimio-immunothérapie.
Inhibiteurs de PARP : où en est-on ?
Pas de place en monothérapie de maintenance après une 1re ligne de chimiothérapie. En revanche, la combinaison iPARP + immunothérapie montre un bénéfice en SSP par rapport à la chimiothérapie seule.
L’association durvalumab + olaparib dispose d’une AMM européenne et d’un avis favorable de la HAS chez ces patientes pMMR, mais le remboursement n’est pas encore accessible en France.
Pratique de l’immunothérapie
Les antécédents de maladie auto-immune ne sont pas une contre-indication absolue : une discussion collégiale est nécessaire si la maladie est bien contrôlée. La durée du traitement suit celle des essais :
• 3 ans pour dostarlimab (RUBY),
• 2 ans pour pembrolizumab.
Des études (MOIO) sont en cours pour évaluer des durées plus courtes.
Traitement de deuxième ligne
Il dépend de la stratégie initiale.
• En l’absence d’immunothérapie en 1re ligne, on proposera pembrolizumab + lenvatinib.
• En cas d’immunothérapie déjà reçue en 1re ligne, une chimiothérapie par doublet (si intervalle libre long) ou mono-chimiothérapie (doxorubicine, paclitaxel) est indiquée. Contrairement au cancer de l’ovaire, il n’existe pas encore de seuil bien défini pour réintroduire une chimiothérapie à base de sels de platine. L’hormonothérapie est une option en cas de tumeur RH+.
L’inclusion dans un essai thérapeutique est à privilégier, notamment pour les patientes déjà traitées par immunothérapie.
Les arbres décisionnels actualisés sont disponibles en ligne sur le site de l’ARCAGY-GINECO, dans les recommandations issues des Rencontres de Saint-Paul-de-Vence 2025.
7 – Cancers de l’endomètre pMMR métastatiques : quelles stratégies en 2025 ?
Dr Brunhilde Hanvic
D’après la présentation du Pr Alexandra Leary (Villejuif) et du Dr Coriolan Lebreton (Bordeaux)
Le traitement des cancers de l’endomètre métastatiques a récemment connu une évolution importante avec l’arrivée des combinaisons de chimiothérapie et d’immunothérapie. Alors que les bénéfices sont aujourd’hui bien établis dans les tumeurs dMMR/MSI-H, la question reste ouverte pour la population pMMR, plus hétérogène et représentant 75 % des cas.
Faut-il proposer une immunothérapie en première ligne chez les patientes pMMR ?
Quatre grandes études de phase III randomisées (RUBY, DUO-E, NRG-GY018, ATTEND) ont montré qu’associer une immunothérapie par anti-PD-(L)1 à une chimiothérapie de type carboplatine-paclitaxel améliorait significativement la SSP et la SG dans les cancers de l’endomètre dMMR (1-4).
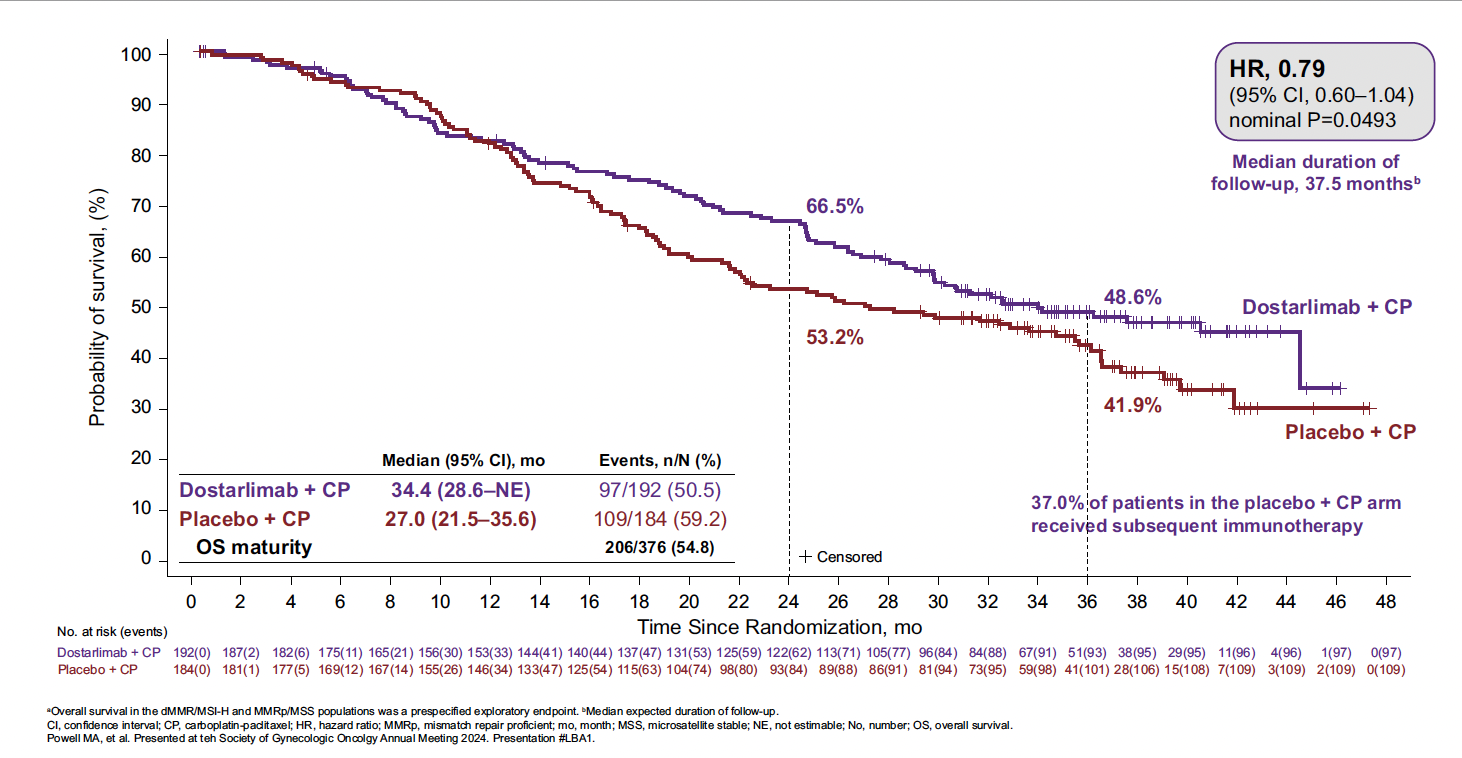
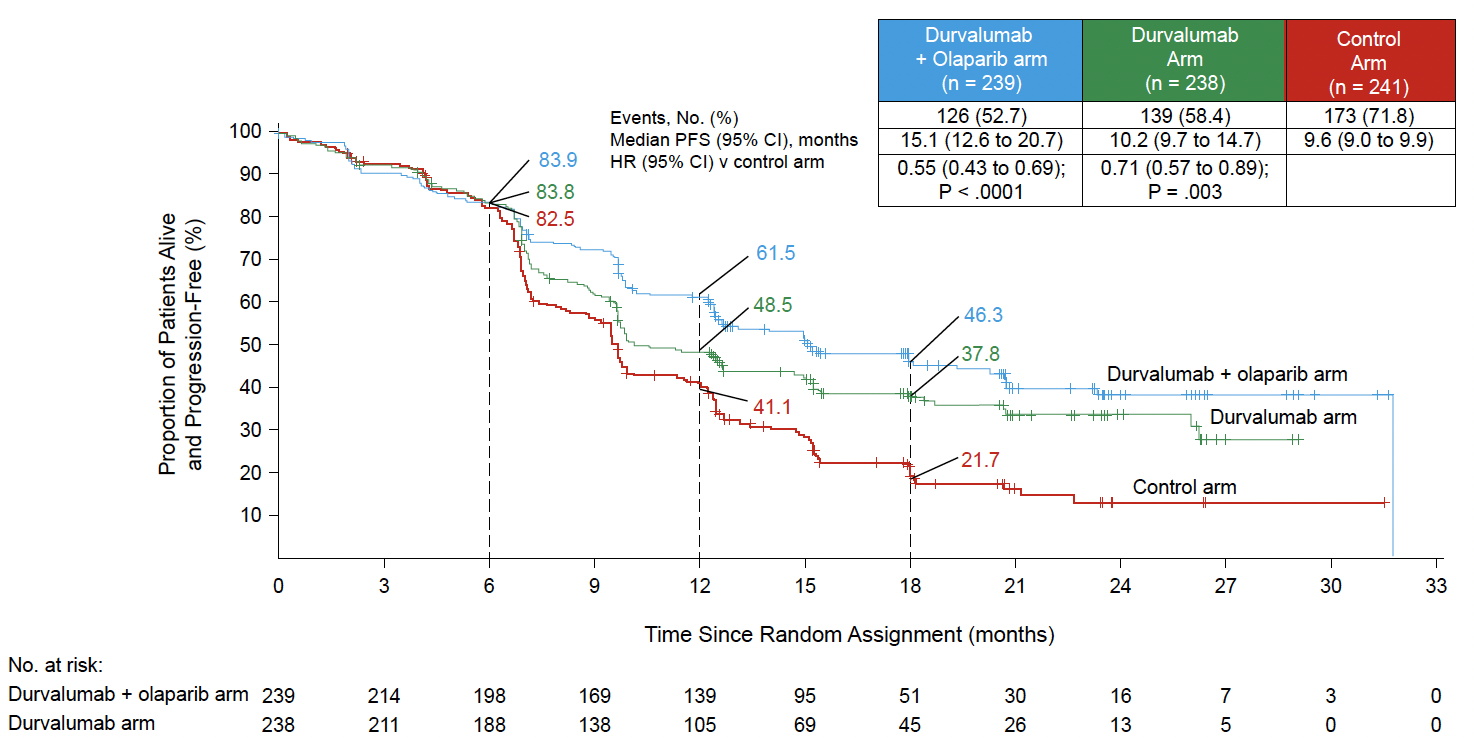
• Chez les patientes pMMR, ce bénéfice est moins évident. Dans l’étude RUBY, si un bénéfice en SSP est observé (HR : 0,76 ; IC 95 % : 0,59-0,98), malgré une tendance favorable, la SG n’est pas significativement améliorée (HR : 0,79 ; IC 95 % : 0,60-1,04) (Fig. 2) (5).
Figure 2 – RUBY : survie globale dans la population pMMR (5).
• DUO-E, de son côté, ne montre pas non plus de bénéfice en SG chez les patientes pMMR. Ainsi, l’ajout systématique d’un anti-PD-1 à la chimiothérapie en première ligne dans cette population reste un choix à nuancer selon les profils.
Actuellement en France, seule l’association dostarlimab et chimiothérapie bénéficie d’un accès précoce, indépendamment du statut MMR
Peut-on renforcer l’efficacité avec une maintenance par inhibiteur de PARP ?
L’essai DUO-E a évalué une séquence avec chimiothérapie sans maintenance ou suivie d’un traitement de maintenance par durvalumab seul, ou en combinaison avec l’olaparib. Les résultats suggèrent un bénéfice en SSP dans la population pMMR, en particulier pour les tumeurs TP53 mutées (Fig. 3), ce qui paraît cohérent, ces tumeurs étant souvent instables génétiquement, séreuses de haut grade et plus sensibles aux iPARP. En revanche, l’ajout d’un iPARP n’apporte pas de bénéfice dans les cancers dMMR (4).
Figure 3 – DUO-E : survie sans progression dans la population pMMR (4).
Ces données ont conduit la HAS à émettre un avis favorable pour le remboursement de la combinaison durvalumab + olaparib en maintenance pour les cancers de l’endomètre pMMR. Cette option n’est cependant pas encore disponible à ce jour, en attente de fixation du prix.
Que sait-on réellement de la population pMMR ?
La population pMMR est très hétérogène : tumeurs séreuses de haut grade (souvent TP53 mutées), endométrioïdes de haut ou bas grade (plutôt RH+), carcinosarcomes, cellules claires, voire quelques rares tumeurs POLE mutées. Cette diversité complique l’identification d’un biomarqueur unique.
Plusieurs analyses de sous-groupes ont tenté d’identifier les profils les plus répondeurs à l’immunothérapie.
• Dans RUBY, un bénéfice plus important était observé chez les patientes TP53 mutées.
• À l’inverse, dans DUO-E, aucune supériorité n’était retrouvée dans ce sous-groupe, avec même une tendance favorable chez les TP53 sauvages.
• Une étude de phase II rapporte même un effet délétère potentiel de l’immunothérapie chez les TP53 mutées (6).
Au total, ces analyses contradictoires ne permettent pas aujourd’hui d’identifier un biomarqueur fiable permettant de sélectionner les patientes pMMR qui bénéficieront d’un schéma à base d’immunothérapie.
L’association pembrolizumab + lenvatinib a-t-elle un rôle en première ligne ?
Dans l’étude KEYNOTE-775, l’association pembrolizumab + lenvatinib a montré un bénéfice en SG en 2e ligne, y compris chez les patientes pMMR. Cela a conduit à son AMM dans cette indication (7).
En première ligne, l’étude LEAP-001 comparait l’association lenvatinib + pembrolizumab à la chimiothérapie standard. L’essai n’a pas atteint ses critères principaux (SSP et SG), ni dans la population globale ni dans le sous-groupe pMMR. Toutefois, une analyse exploratoire suggère un intérêt potentiel chez les patientes en rechute précoce après un traitement adjuvant (8).
Quand privilégier une chimiothérapie seule en première ligne, suivie de pembrolizumab + lenvatinib en deuxième ligne ?
Chez certaines patientes, il peut être préférable de proposer initialement une chimiothérapie seule (carboplatine + paclitaxel), en réservant l’association pembrolizumab + lenvatinib à la ligne suivante. Cette approche peut se justifier dans plusieurs situations : chez les patientes atteintes d’une maladie lentement évolutive, pour lesquelles une 2e ligne sera probablement accessible. Les patientes atteintes de carcinosarcome reçoivent le plus souvent une chimiothérapie en adjuvant. En cas de rechute précoce, reprendre une chimiothérapie à base de carboplatine-paclitaxel associée à l’immunothérapie n’est pas une option thérapeutique appropriée. Une immunothérapie seule peut alors être envisagée. À noter que les carcinosarcomes n’étaient pas inclus dans KEYNOTE-775. Un essai en cours, ROCSAN, évalue l’association niraparib + dostarlimab dans cette population.
Et la place de l’hormonothérapie ?
Chez les patientes atteintes de tumeurs de bas grade, RH+, sans crise viscérale, appartenant au groupe des NSMP, l’hormonothérapie (progestatifs, inhibiteurs de l’aromatase) reste une option thérapeutique à ne pas négliger, notamment chez les patientes âgées ou fragiles. Elle permet un contrôle prolongé avec un bon profil de tolérance.
À retenir
• Chez les patientes pMMR, l’ajout d’un anti-PD-(L)1 à la chimiothérapie montre un bénéfice modeste, sans amélioration claire de la SG.
• L’association durvalumab + olaparib en maintenance (étude DUO-E) pourrait bénéficier aux patientes pMMR, en attente de disponibilité en France.
• Aucun biomarqueur validé ne permet aujourd’hui de sélectionner de manière fiable les patientes pMMR pour une stratégie d’immunothérapie.
• L’hormonothérapie conserve sa place chez les patientes RH+, bas grade, non agressives.
Bibliographie
1. Mirza MR, Chase DM, Slomovitz BM et al. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med 2023 ; 388 : 2145-58.
2. Eskander RN, Sill MW, Beffa L et al. Pembrolizumab plus chemotherapy in advanced endometrial cancer. N Engl J Med 2023 ; 388 : 2159-70.
3. Colombo N, Biagioli E, Harano K et al. Atezolizumab and chemotherapy for advanced or recurrent endometrial cancer (AtTEnd): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2024 ; 25 : 1135-46.
4. Westin SN, Moore K, Chon HS et al. Durvalumab plus carboplatin/paclitaxel followed by maintenance durvalumab with or without olaparib as first-line treatment for advanced endometrial cancer: the phase III DUO-E trial. J Clin Oncol 2024 ; 42 : 283-99. [published correction in J Clin Oncol 2024 ; 42 : 3262.
5. Powell MA, Bjørge L, Willmott L et al. Overall survival in patients with endometrial cancer treated with dostarlimab plus carboplatin-paclitaxel in the randomized ENGOT-EN6/GOG-3031/RUBY trial. Ann Oncol 2024 ; 35 : 728-38.
6. Pignata S, Califano D, Lorusso D et al. MITO END-3: efficacy of avelumab immunotherapy according to molecular profiling in first-line endometrial cancer therapy. Ann Oncol 2024 ; 35 : 667-76.
7. Makker V, Colombo N, Casado Herráez A et al. Lenvatinib plus pembrolizumab in previously treated advanced endometrial cancer: updated efficacy and safety from the randomized phase III study 309/KEYNOTE-775. J Clin Oncol 2023 ; 41 : 2904-10.
8. Marth C, Moore RG, Bidziński M et al. First-Line Lenvatinib plus pembrolizumab versus chemotherapy for advanced endometrial cancer: a randomized, open-label, phase III trial. J Clin Oncol 2025 ; 43 : 1083-100.
8 – Les actions d’IMAGYN en 2025
Coralie Marjollet
En quoi cette année a été particulière pour IMAGYN ?
CM : Nous nous sommes retrouvés le 7 juin 2024 où, après une journée de partages et d’échanges, nous avons pu fêter tous ensemble, avec nos partenaires, les 10 ans d’IMAGYN. Moment intense d’émotions durant lequel nous avons retracé le chemin parcouru, un parcours incroyable pour la dizaine d’entre nous qui ont mis en place les fondations de cette aventure folle qui nous nourrit et nous porte depuis toutes ces années.
Quelles sont les actions réalisées pendant cette année anniversaire ?
CM : Nous avons continué à accompagner les patientes dans la maladie en enrichissant notre collection de brochures, notamment avec la parution d’un nouveau livret consacré à la gestion de la douleur. Comme pour chacune de nos publications, ce lancement a été accompagné d’un webinaire, organisé en partenariat avec Oncostream, afin de répondre en direct aux questions des patientes, des médecins et des professionnels de santé. Ces webinaires, visionnés régulièrement au fil des années, sont devenus de véritables outils d’accompagnement, certains cumulant aujourd’hui plusieurs dizaines de milliers de vues. Nous avons également diversifié nos supports d’information avec de nouveaux formats, tels que des vidéos d’activité physique adaptée et les “Cookinaires”, réalisés en collaboration avec Philippe Pouillart, expert en nutrition et spécialiste en cancérologie. Notre chaîne YouTube est ainsi devenue une ressource complémentaire essentielle à notre site internet, www.imagyn.org, entièrement refondu cette année. Ce dernier offre un accès libre à l’ensemble de notre documentation en la téléchargeant gratuitement, et permet également aux centres de soins, médecins et professionnels de santé la possibilité de commander des versions papier à destination des patientes, pour un accompagnement toujours au plus près de leur parcours.
Et Septembre turquoise, le mois de sensibilisation aux cancers gynécologiques pelviens ?
CM : Ce mois phare de notre activité a été intense avec plus de 85 actions partout en France organisées et portées par nos bénévoles, stands de sensibilisation ou de soutien, ateliers nutrition, activité physique ou même ateliers floraux, nous avons été sur tous les fronts. Sans parler du COCON et de son village reparti sur les routes depuis mai et qui a fait escale à Besançon, Créteil, Plérin puis Montpellier pour aller au plus près des patientes et les accompagner pour vivre pleinement leur vie de femme dans la maladie.
Nous avons aussi initié un partenariat avec France Télévisions et TF1. Les spots d’information sur le dépistage du cancer du col de l’utérus ont ainsi été diffusés gratuitement. Et plusieurs émissions comme le magazine de la Santé, Télématin ou Les maternelles ont fait des sujets sur la vaccination contre les virus HPV, le dépistage ou encore les symptômes du cancer de l’endomètre.
Qu’en est-il des actions de plaidoyer d’IMAGYN ?
CM : Les avancées en matière d’accès au dépistage du cancer du col de l’utérus ont progressé cette année, notamment avec la publication en juillet du décret autorisant les laboratoires d’analyses médicales à réaliser le dépistage sans ordonnance. Parallèlement, le ministère de la Santé s’est mobilisé pour déployer les auto-prélèvements dans le cadre du dépistage organisé, afin de faciliter l’accès au test HPV pour toutes les femmes. Nous avons aussi poursuivi nos actions en faveur d’un accès précoce aux nouvelles thérapeutiques et continué à interpeller députés, sénateurs et institutions pour une mise en œuvre effective du décret d’avril 2022, conformément aux recommandations de l’INCa.
Nous avons également continué à porter avec le Collectif Demain sans HPV notre demande de la vaccination pour tous, filles et garçons, quelle que soit l’orientation sexuelle de 11 à 26 ans. En effet, non seulement plusieurs centaines de milliers de jeunes hommes et de jeunes femmes n’ont pu bénéficier de cette prévention essentielle pour les protéger de ces cancers évitables, mais aussi, il est essentiel pour venir à bout de la défiance vaccinale de porter un message clair : de 11 à 26 ans, vaccinons les filles et les garçons, le plus tôt est le mieux, mais il n’est pas trop tard !
Avec le soutien de tous, médecins, chercheurs, professionnels de santé, bénévoles, nous entamons cette nouvelle décennie d’actions pour continuer à porter la parole des patientes, agir pour la prévention et accompagner au mieux les femmes partout sur le territoire dans la maladie.