Le San Antonio Breast Cancer Symposium (SABCS) 2024 a été riche en présentations et échanges scientifiques qui marqueront sans doute l’avenir de la prise en charge du cancer du sein. Voici une synthèse des études phares et des actualisations présentées lors de cette édition.
En bonus, le TOP 5 des cinq études qui pourraient changer les pratiques : de l’ambre, du platine et quelques autres pépites !
TOP 1 – EMBER-3 : un nouveau standard en 2e ligne d’hormonothérapie ?
L’étude EMBER-3 a été présentée en plénière et directement paru dans le New England Journal of Medicine.
L’étude
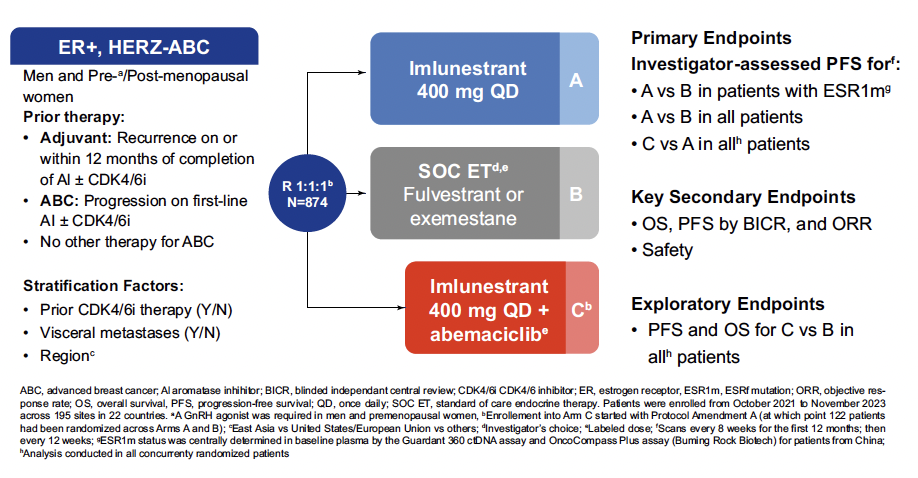
Il s’agit d’une étude de phase III randomisée qui a évalué l’efficacité et la tolérance d’un nouveau sélecteur d’œstrogènes oral (SERD), l’imlunestrant, seul ou en combinaison avec un inhibiteur de cycline CDK4/6, l’abémaciclib, versus hormonothérapie au choix de l’investigateur chez des patientes ayant déjà bénéficié d’une 1re ligne d’hormonothérapie (Fig. 1).
Figure 1 – EMBER-3 : schéma de l’étude.
874 patientes ont été randomisées, ratio 1:1:1, seulement 213 dans le bras imlunestrant-abémaciclib ce dernier ayant fait l’objet d’un amendement en cours d’étude. Un tiers des patientes ont été incluses après progression sous hormonothérapie adjuvante. Seulement environ 60 % ont reçu préalablement un inhibiteur de CDK4/6, essentiellement en 1re ligne métastatique. Entre 32 et 42 % des patientes, selon les bras, présentaient une mutation ESR1 circulante, et 40 % environ une mutation de la voie Pi3k.
Le critère de jugement principal était la survie sans progression (SSP) entre imlunestrant seul et traitement standard dans la population ESR1 mutée.
Les résultats
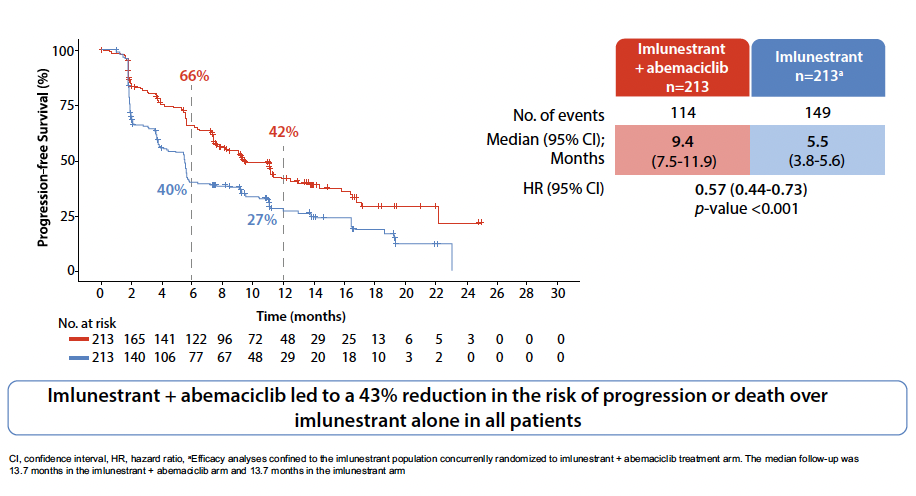
La SSP médiane est de 5,5 mois bras imlunestrant contre 3,8 mois (0,62 (0,46-0,82) ; p < 0,001). Les résultats les plus impressionnants sont retrouvés dans le bras combinaison avec une SSP médiane de 9,4 contre 5,5 mois pour l’imlunestrant seul (HR : 0,57 (0,44-0,73) ; p < 0,001) (Fig. 2), voire 11,1 mois versus 5,5 mois dans la population ESR1 mutée. Le taux de réponse est de 27 % dans le bras combinaison, contre 12 % dans le bras imlunestrant seul et 5 % dans le bras standard.
Figure 2 – EMBER-3 : survie sans progression médiane.
Les analyses biologiques parallèles ont également mis en évidence une modulation favorable des gènes impliqués dans la signalisation hormonale et la prolifération cellulaire.
Côté tolérance, les toxicités de grade 3 et plus restent faibles : 17,1 % avec l’imlunestrant, 20,7 % avec le traitement standard et 48,6 % avec la combinaison.
Au final, la combinaison imlunestrant-abémaciclib pourrait devenir un nouveau standard de traitement après une ligne d’hormonothérapie, particulièrement en cas de mutation ESR1 circulante, repoussant l’initiation d’une chimiothérapie systémique.
• Jhaveri K et al. GS1-01: Imlunestrant, an oral selective estrogen receptor degrader (serd), as monotherapy & combined with abemaciclib, for patients with ER+, HER2- advanced breast cancer (ABC), pretreated with endocrine therapy (ET): results of the phase 3 EMBER-3 trial. SABCS 2024 : SESS-3617.
NSABP B-59/GBG-96-GeparDouze : une étape majeure pour le cancer HER2+ ?
L’étude NSABP B-59/GBG-96-GeparDouze a évalué l’ajout de l’anticorps monoclonal anti-PD-1, l’atézolizumab, à une chimiothérapie standard dans le traitement néoadjuvant et adjuvant des patientes atteintes de cancer du sein HER2+. Les résultats préliminaires ont montré une augmentation significative du taux de pCR, atteignant 68,5 % dans le groupe traité par atézolizumab contre 54,4 % dans le bras contrôle (IC 95 % : 60,1-76,3 ; p < 0,001). En termes de survie sans événement (EFS), une amélioration de 18 % a été observée à 3 ans (HR : 0,72 ; IC 95 % : 0,56-0,92).
Ces données confirment le rôle prometteur de l’immunothérapie dans ce sous-type de cancer agressif.
• Geyer C et al. GS2-05: NSABP B-59/GBG-96-GeparDouze: A randomized double-blind phase III clinical trial of neoadjuvant chemotherapy with atezolizumab or placebo followed by adjuvant atezolizumab or placebo in patients with Stage II and III triple-negative breast cancer. SABCS 2024 : SESS-3629.
COMET : quel bénéfice de la surveillance active des lésions mammaires indéterminées ?
L’étude COMET (Comparison of Operative to Monitoring and Endocrine Therapy) a testé la viabilité de la surveillance active pour les patientes ayant des lésions mammaires telles que le DCIS (ductal carcinoma in situ). Les données ont révélé que 75 % des patientes n’ont pas évolué vers une maladie invasive au bout de 5 ans, avec une différence de 3 % (IC 95 % : -2-+8) par rapport aux patientes ayant subi une chirurgie immédiate. Les taux de satisfaction des patientes étaient également plus élevés dans le groupe de surveillance active.
• Hwang ES et al. GS2-05: Imlunestrant, an Oral Selective Estrogen Receptor Degrader (SERD), as Monotherapy & Combined with Abemaciclib, for Patients with ER+, HER2- Advanced Breast Cancer (ABC), Pretreated with Endocrine Therapy (ET): Results of the Phase 3 EMBER-3 trial. SABCS 2024 : SESS-3481.
BWEL : le poids a-t-il une incidence sur la survie sans récidive ?
Le Breast Cancer Weight Loss Study (BWEL) a examiné l’effet d’un programme intensif de réduction de poids sur la survie sans récidive. Les patientes obèses ayant perdu au moins 10 % de leur poids corporel ont présenté une réduction de 30 % du risque de récidive (HR : 0,70 ; IC 95 % : 0,55-0,89) à 3 ans.
Ces données mettent en lumière le lien crucial entre le métabolisme et la progression tumorale.
• Ligibel J et al. RF1-01: Effect of a weight loss intervention (WLI) on metabolic and inflammatory biomarkers in women with obesity and breast cancer: Results from the Breast Cancer Weight Loss (BWEL) Trial (Alliance). SABCS 2024 : SESS-3409.
Quelle stratégie pour préserver la fertilité ?
Le Dr Lambertini a présenté des travaux centrés sur les stratégies de préservation de la fertilité, notamment l’utilisation d’agonistes de la GnRH pendant la chimiothérapie. Une méta-analyse actualisée a confirmé une réduction du risque d’insuffisance ovarienne de 38 % (IC 95 % : 30-46). Les taux de grossesses post-traitement ont également été augmentés de manière significative dans le groupe utilisant des agonistes de la GnRH.
• Lambertini M et al. GS1-08: Association between risk-reducing surgeries and survival in young BRCA carriers with breast cancer: results from an international cohort study. SABCS 2024 : SESS-1627.
NATALEE : quelle efficacité du ribociclib chez les patientes à risque intermédiaire à élevé dans les cancers ER+/HER2- ?
L’étude NATALEE a présenté des données actualisées lors du SABCS 2024 sur l’utilisation de ribociclib, un inhibiteur de CDK4/6, en traitement adjuvant prolongé (jusqu’à 3 ans) chez des patientes atteintes de cancers ER+/HER2-. Les résultats ont montré une réduction significative de 25 % du risque de récidive invasive (HR : 0,75 ; IC 95 % : 0,62-0,91), avec une SSP à 3 ans atteignant 92,2 % (IC 95 % : 90,5-93,9) dans le groupe ribociclib contre 88,3 % (IC 95 % : 86,2-90,4) dans le groupe standard. En termes de tolérance, les effets secondaires les plus fréquents comprenaient des neutropénies (58 %) et des nausées (24 %), qui étaient gérés efficacement par des ajustements de dose.
Les patientes incluses étaient majoritairement à risque intermédiaire à élevé, ce qui confirme l’efficacité du traitement dans cette sous-population.
• Hamilton E et al. P1-11-16: Impact of ribociclib dose reduction on efficacy in patients with hormone receptor– “positive/human epidermal growth factor receptor 2–negative (HR+/HER2−) early breast cancer (EBC) in NATALEE”. SABCS 2024 : SESS-3542.
TOP 2 – PATINA : intérêt des inhibiteurs de CDK4/6 en maintenance 1re ligne pour les cancers RH+/HER2+ ?
Rajoutée en dernière minute au programme de ce SABCS 2024, l’étude PATINA a été présentée en plénière suite aux résultats sans précédent en 1re ligne métastatique des cancers du sein “double/triple positifs”.
L’étude
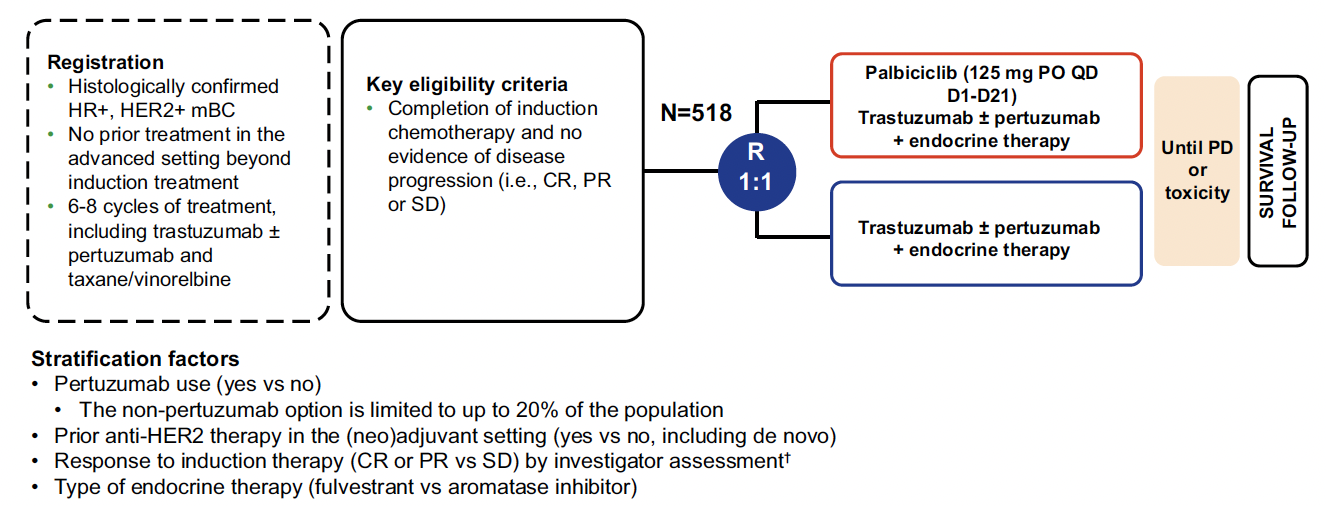
Il s’agit d’une étude de phase III randomisée, internationale, incluant des patientes avec un cancer du sein métastatique de novo ou récidivant, présentant une surexpression HER2 (3+ ou 2+ FISH positive) et également positive aux récepteurs aux œstrogènes ± progestérone (RE+/RP+), stable ou en réponse partielle ou complète, après un traitement de 1re ligne d’induction standard par six à huit cycles de chimiothérapie type taxanes et double blocage HER2 par trastuzumab et pertuzumab (TP). Les patientes étaient randomisées 1:1 à l’issue du traitement d’induction, entre maintenance standard par TP + hormonothérapie (tamoxifène, anti-aromatase ou fulvestrant) et un bras expérimental avec le même régime associé à un inhibiteur de CDK4/6, le palbociclib jusqu’à progression ou intolérance (Fig. 3).
Figure 3 – PATINA : schéma de l’étude.
Le critère de jugement principal était la SSP médiane, et, en critères secondaires principaux, la SG et le taux de réponse.
Les résultats
Au total, 518 patientes ont été incluses et randomisées, dont moins de 30 % de patientes de novo métastatique, et près de 70 % de patients en réponse partielle ou complète après traitement d’induction.
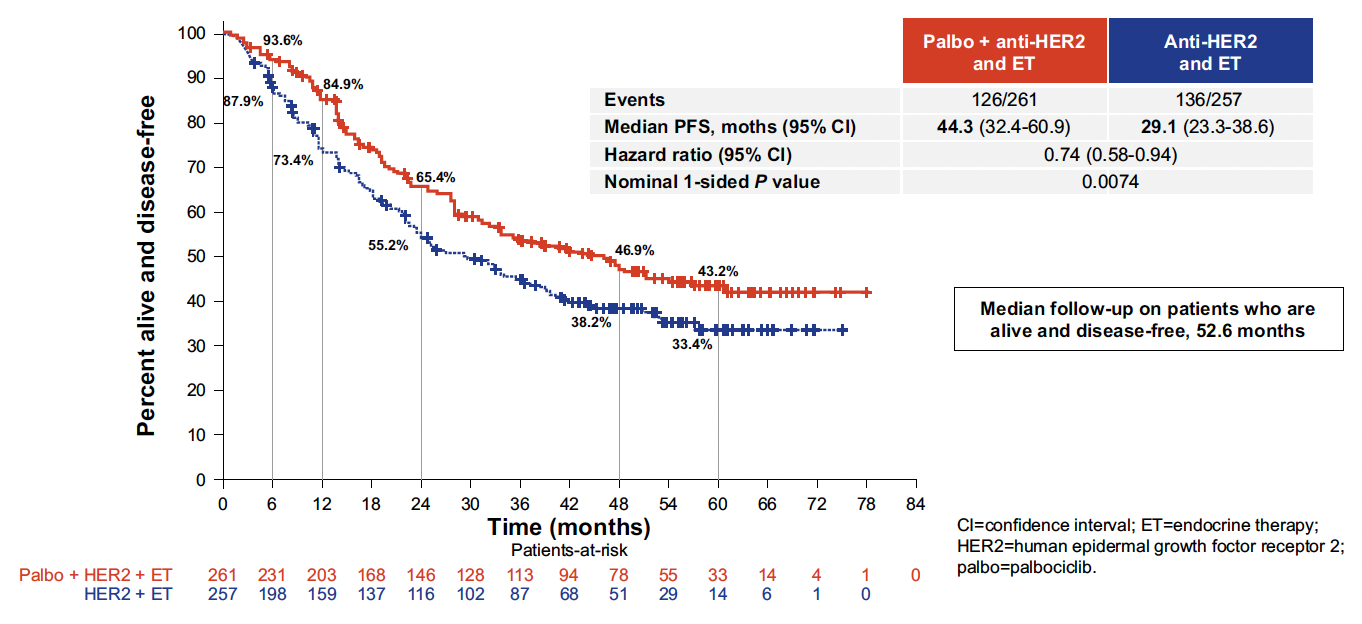
Après une médiane de suivi de 52, 6 mois, la SSP médiane était de 44,3 mois dans le bras investigateur contre 29,1 mois dans le bras standard (HR : 0,74 (0,58-0,94) ; p = 0,0074), résultats similaires dans tous les sous-groupes stratifiés (Fig. 4). En termes de taux de réponse, la combinaison avec le palbociclib obtenait 29,9 contre 22,2 % dans le bras standard (p = 0,046), correspondant à une réponse supplémentaire à celle qui avait pu être observée dans la phase d’induction. La SG n’est pas du tout mature à ce point.
Figure 4 – PATINA : survie sans progression.
La tolérance de la combinaison était essentiellement marquée par des neutropénies (grade 3 : 63,2 %) sans décès reporté et des diarrhées (grade 3 : 11,1 %), avec un taux d’arrêt de seulement 7,5 % dans le bras palbociclib.
Ce gain de 15 mois de SSP montre donc un réel bénéfice pour la population de patientes RH+/HER2+, cliniquement pertinent, avec une toxicité connue et gérable des anti-CDK4/6 qui posera très certainement de nombreuses questions à l’aune de l’arrivée des anticorps conjugués comme le trastuzumab déruxtécan en 1re ligne et les résultats à venir de l’étude DESTINY-Breast09.
• Metzger O et al. GS2-12: AFT-38 PATINA: a Randomized, Open Label, Phase III Trial to Evaluate the Efficacy and Safety of Palbociclib + Anti-HER2 Therapy + Endocrine Therapy vs. Anti-HER2 Therapy after Induction Treatment for Hormone Receptor-Positive (HR+)/HER-Positive Metastatic Breast Cancer. SABCS 2024.
SOLTI Valentine : les promesses des combinaisons thérapeutiques sont-elles tenues ?
L’étude SOLTI Valentine a été conçue pour analyser l’efficacité des combinaisons de thérapies ciblées, incluant des inhibiteurs de checkpoint immunitaire (pembrolizumab) et des anticorps conjugués (sacituzumab govitécan), dans le TNBC (triple negative breast cancer). Les résultats présentés lors du SABCS 2024 ont démontré une augmentation de 25 % des réponses complètes pathologiques (pCR), avec un taux global atteignant 60 % (contre 35 % pour le bras contrôle, IC 95 % : 50-70). Parmi les patientes ayant un sous-type basal, les taux de réponse étaient encore plus marquants, atteignant 72 % (IC 95 % : 65-78). L’analyse des biomarqueurs a mis en évidence une corrélation positive entre les niveaux élevés de PD-L1 et l’amélioration de la pCR, renforçant le rôle de l’immunothérapie. Les données de SSP à 2 ans montrent une amélioration significative, avec un HR de 0,65 (IC 95 % : 0,50-0,80), confirmant l’intérêt des stratégies combinées pour les TNBC à mauvais pronostic.
Ces stratégies suggèrent une synergie élevée entre l’immunomodulation et les agents cytotoxiques ciblés.
• Oliviera M et al. LB1-06: Primary results of SOLTI VALENTINE: neoadjuvant randomized phase II trial of HER3-DXd alone or in combination with letrozole for high-risk hormone receptor positive (HR+)/HER2-negative (neg) early breast cancer (EBC). SABCS 2024 : SESS-3562.
ZEST : des biomarqueurs peuvent-ils prédire la réponse aux thérapies ciblées ?
L’essai de phase III ZEST a comparé le niraparib à un placebo chez des patientes atteintes d’un cancer du sein triple négatif ou HER2- avec mutations BRCA après un traitement complet. Des tests de l’ADN tumoral circulant (ADNct+) permettaient d’identifier une maladie moléculaire résiduelle (MRD) pour une détection précoce des récidives.
Parmi les 2 746 patientes dépistées, 8 % présentaient un ADNct+, la plupart des détections étant survenues dans les 6 mois suivant la fin du traitement. En raison des faibles taux d’ADNct+, les inscriptions ont pris fin prématurément. ADNct+ était lié à une plus grande taille de tumeur et à des ganglions lymphatiques positifs. L’étude s’est concentrée sur l’innocuité du niraparib et son potentiel à améliorer la survie sans maladie.
• Turner N et al. GS3-01: Circulating tumor DNA surveillance in ZEST, a randomized, phase 3, double-blind study of niraparib or placebo in patients w/ triple-negative breast cancer or HER2+ BRCA-mutated breast cancer with molecular residual disease after definitive therapy. SABCS 2024 : SESS-2027.
TOP 3 – INSEMA : peut-on se passer complètement de chirurgie axillaire ?
Autre étude présentée en plénière et autre publication synchrone dans le New England Journal of Medicine.
L’étude
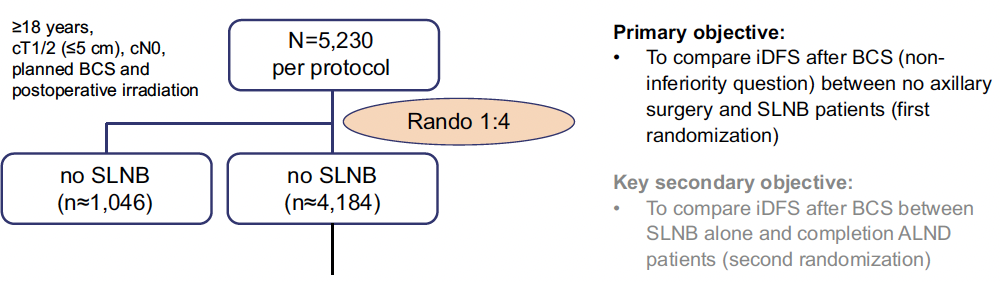
L’étude INSEMA, présentée par le German Breast Group, est une étude prospective de désescalade chirurgicale axillaire, randomisée, de non-infériorité. Chez les patientes présentant une tumeur du sein de moins de 5 cm (cT1/ T2), sans preuve clinique et/ou radiologique d’envahissement ganglionnaire (cN0), les patientes étaient randomisées 4:1, 4 pour chirurgie standard avec procédure de ganglion sentinelle, 1 pour chirurgie sans geste axillaire, sans modifier par ailleurs les autres traitements adjuvants (Fig. 5).
Figure 5 – INSEMA : schéma de l’étude.
Le critère de jugement principal était la non-infériorité du bras expérimental sur la survie sans rechute (SSR).
Les résultats
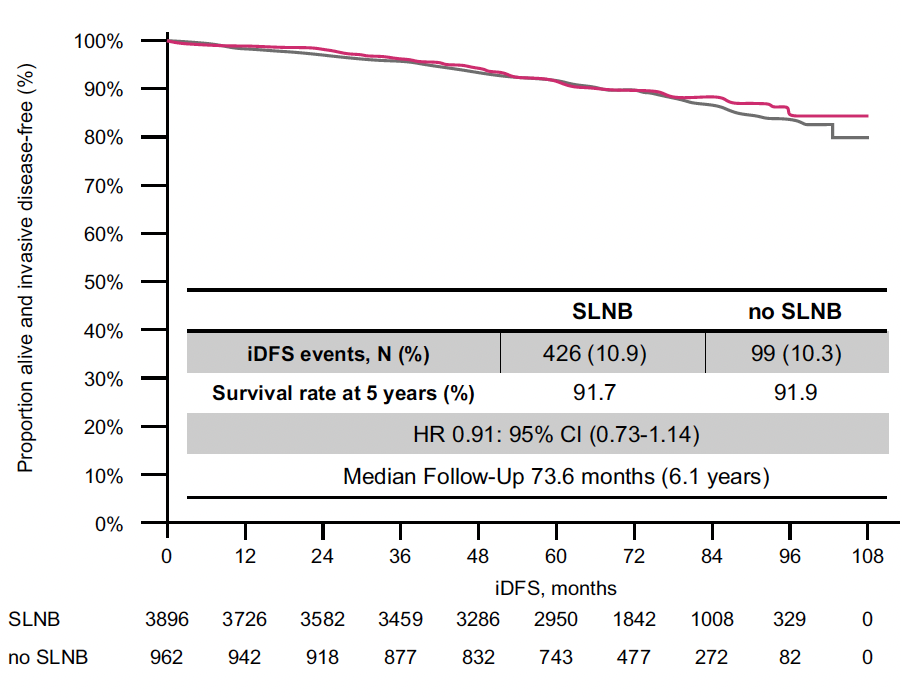
Entre 2015 et 2019, 5 230 patientes ont été incluses et randomisées, correspondant à 89,8 % de patientes de plus de 50 ans, 90,5 % de tumeurs de moins de 2 cm (cT1), près de 96 % de tumeurs grade SBR 1 et 2 et 95,2 % de tumeurs luminales RH+/HER2-. Dans le bras standard, seules 11,5 % des chirurgies ont retrouvé un envahissement ganglionnaire axillaire, très majoritairement de 1 à 3 ganglions envahis (pN1).
Après un suivi médian de 73,6 mois, il n’y a pas de différence significative entre les deux bras, avec 91,7 % de SSR dans le bras standard et 91,9 % dans le bras expérimental sans ganglion sentinelle, (HR : 0,91 (0,73-1,14)) et l’étude est donc positive (Fig. 6) ! Pas de différence non plus en SG (96,9 % en vie à 5 ans dans le bras standard, 98,2 % dans le bras sans curage, HR : 0,69 (0,46-1,02)).
Figure 6 – INSEMA : survie sans rechute.
Ces résultats sont concordants avec d’autres études déjà publiées, dont SOUND, allant vers une abstention chirurgicale axillaire chez les patientes à bas risque clinique : cT1 cN0, SBR1/2, RH+/HER2, ménopausées… Résultats à manier avec précaution quant à la désescalade des autres traitements adjuvants.
• Reimer T et al. GS2-07: No axillary surgery versus axillary sentinel lymph node biopsy in patients with early invasive breast cancer and breast-conserving surgery: Final primary results of the Intergroup-Sentinel-Mamma (INSEMA) trial. SABCS 2024 : SESS-3619.
KEYNOTE-522 : quel est l’apport de l’analyse des biomarqueurs ?
L’étude KEYNOTE-522 a confirmé que l’ajout du pembrolizumab à une chimiothérapie augmentait la pCR de 15 % (60 contre 45 % ; IC 95 % : 55-65 %), avec une amélioration notable de la SSE de 8 mois (HR : 0,72 ; IC 95 % : 0,60-0,85) à 3 ans. Les analyses approfondies des biomarqueurs effectuées au SABCS 2024 ont mis en évidence plusieurs indicateurs prédictifs de réponse. Le TMB (tumor mutational burden) élevé a été associé à une amélioration significative de la pCR et de la SSE, suggérant son rôle clé dans l’identification des patientes les plus susceptibles de bénéficier de l’immunothérapie. De plus, une expression accrue de PD-L1 (≥ 10 %) s’est également révélée fortement corrélée avec des réponses optimales, renforçant la pertinence de ce biomarqueur dans le traitement des TNBC localement avancés.
Ces résultats soulignent l’importance d’intégrer ces analyses dans la pratique clinique pour optimiser la sélection et le suivi des patientes.
• O’Shaughnessy J et al. LB1-07: Exploratory Biomarker Analysis of the Phase 3 KEYNOTE-522 Study of Neoadjuvant Pembrolizumab or Placebo Plus Chemotherapy Followed by Adjuvant Pembrolizumab or Placebo for Early-Stage TNBC. SABCS 2024 : SESS-3647.
SERENA-1 : une nouvelle stratégie dans la modulation des récepteurs hormonaux ?
L’étude SERENA-1 a présenté des données sur le camizestrant, un antagoniste sélectif des récepteurs aux œstrogènes. Chez les patientes atteintes de cancers ER+/HER2- avancés, le camizestrant a amélioré la SSP à 7,2 mois (IC 95 % : 6,4-8,0) par rapport au fulvestrant (5,7 mois ; IC 95 % : 5,0-6,4).
Ces résultats renforcent son potentiel dans les cancers résistants aux traitements hormonaux standard.
• Baird R et al. PS7-08: Results from SERENA-1 Parts K/L: A Phase 1 study of the next-generation oral selective estrogen receptor degrader (SERD) camizestrant (AZD9833) in combination with ribociclib in women with ER-positive, HER2 negative advanced breast cancer. SABCS 2024 : SESS-1686.
RIGHT Choice : quelles efficacité et tolérance du ribociclib chez les patientes pré/périménopausées atteintes de cancer HR+ /HER2- avancé et cliniquement agressif ?
L’étude RIGHT Choice a comparé l’efficacité du ribociclib associé à une hormonothérapie (ET) à celle d’une chimiothérapie combinée en première ligne chez des femmes pré/périménopausées atteintes de cancer du sein HR+/HER2- avancé et cliniquement agressif. Les résultats finaux ont montré un bénéfice significatif en termes de SSP pour le ribociclib et ET par rapport à la chimiothérapie combinée, avec une SSP médiane atteignant 24 mois (IC 95 % : 22-26) contre 12,5 mois (IC 95 % : 11-14) pour la chimiothérapie. Les analyses exploratoires présentées au SABCS 2024 ont évalué les sous-groupes à mauvais pronostic, notamment les patientes avec des sous-types intrinsèques luminal B ou HER2- enrichi, ainsi que celles identifiées par des signatures géniques.
Ces données ont confirmé que le ribociclib avec ET offre une meilleure tolérance et une efficacité constante dans ces sous-populations difficiles.
• Lu YS et al. PS2-06:First-line (1L) ribociclib (RIB) + endocrine therapy (ET) vs combination chemotherapy (combo CT) in clinically aggressive HR+/HER2- advanced breast cancer (ABC): a subgroup analysis of RIGHT Choice by intrinsic subtype & gene & signature expression. SABCS 2024 : SESS-566.
DESTINY-Breast06 : peut-on conjuguer thérapie ciblée et précision ?
Cette étude a exploré l’efficacité du trastuzumab déruxtécan chez les patientes avec un cancer du sein HER2-low. Les résultats ont démontré un TRO de 52 % (IC 95 % : 45-59) et une SSP de 9,9 mois (IC 95 % : 8,6-11,2), comparés à 6,7 mois avec la chimiothérapie standard (IC 95 % : 5,8-7,6).
• Bardia A et al. LB1-04: Efficacy and safety of trastuzumab deruxtecan (T-DXd) vs physician’s choice of chemotherapy (TPC) by pace of disease progression on prior endocrine-based therapy: additional analysis from DESTINY-Breast06. SABCS 2024 : SESS-3676.
TOP 4 – PADMA : y-a-t-il encore une place pour la chimiothérapie en 1re ligne des tumeurs RH+ ?
La place des inhibiteurs de CDK4/6 n’est plus à discuter comme traitement standard de 1re ligne métastatique des cancers du sein luminaux, avec les recommandations internationales de l’ESMO et du NCCN. Toutefois, en cas de maladie agressive avec forte charge tumorale ou crise viscérale, la question reste (partiellement) posée de la place d’une chimiothérapie en 1re intention dans cette situation.
L’étude
L’étude PADMA, également promue par le German Breast Group, était une étude pragmatique, prospective, ayant randomisé 120 patients avec une maladie RH+/HER2- métastatique de novo ou en récidive, avec atteinte viscérale, non oligométastatique, candidate à une mono-chimiothérapie. La randomisation 1:1 se faisait entre hormonothérapie (anti-aromatase ou fulvestrant) + palbociclib, et chimiothérapie (paclitaxel, capécitabine, épirubicine ou vinorelbine) au choix de l’investigateur.
Le critère de jugement principal était le temps jusqu’à l’échec du traitement (TTF), correspondant soit à la progression soit à l’arrêt du traitement pour toxicité (choix du patient ou décès).
Les résultats
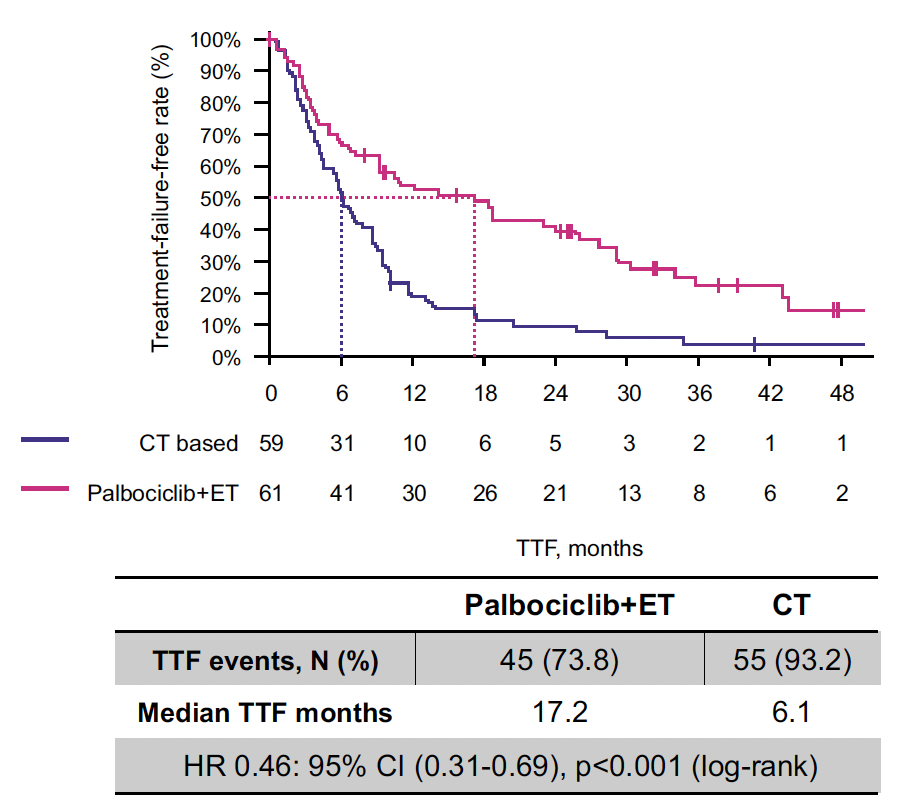
Les patientes âgées, de 62 ans en moyenne, présentaient des métastases hépatiques dans 41,7 %, résistantes à l’hormonothérapie dans 31 % et traitées par chimiothérapie en situation (néo)adjuvante dans 45 %.
Au final, après 36,8 mois de suivi médian, le TTF est de 17,2 mois dans le bras palbociclib contre 6,1 mois en cas de chimiothérapie (HR : 0,46 (0,31-0,69) ; p < 0,001)) (Fig. 7) et une tendance non significative en termes de SG (46,1 versus 36,8 mois).
Figure 7 – PADMA : temps jusqu’à l’échec du traitement.
La toxicité est essentiellement hématologique avec des neutropénies non fébriles des anti-CDK4/6, gérables par ajustement de doses.
Même s’il ne s’agit pas d’une population stricto sensu avec crise viscérale, ces résultats sont concordants avec les études RIGHT CHOICE, (Young-)PEARL et ABIGAIL sur l’intérêt d’une combinaison hormonothérapie et inhibiteur de CDK4/6 en 1re ligne métastatique, à réévaluer évidemment au vu du développement de cette classe thérapeutique en situation (néo)adjuvante.
• Loibl S et al. LB1-03: Primary results of the randomised Phase III trial comparing first-line ET plus palbociclib vs standard mono-chemotherapy in women with high risk HER2-/HR+ metastatic breast cancer and indication for chemotherapy – PADMA study. SABCS 2024 : SESS-3616.
TOP 5 – OlympiA : l’essai est-il transformé à 10 ans ?
Cet essai de phase III randomisé testant l’ajout d’un an olaparib en traitement adjuvant des patients avec cancer du sein avec mutation BRCA1/2 germinale, sans surexpression HER2 à haut risque de récidive après traitement (néo)adjuvant a permis l’AMM de cet inhibiteur de PARP en France depuis mars 2022 en accès précoce et depuis septembre 2024 en accès standard.
Les données présentées au SABCS 2024 concernaient l’actualisation de la SSM et de la SG, 10 ans après l’inclusion du premier patient dans l’essai.
Les résultats
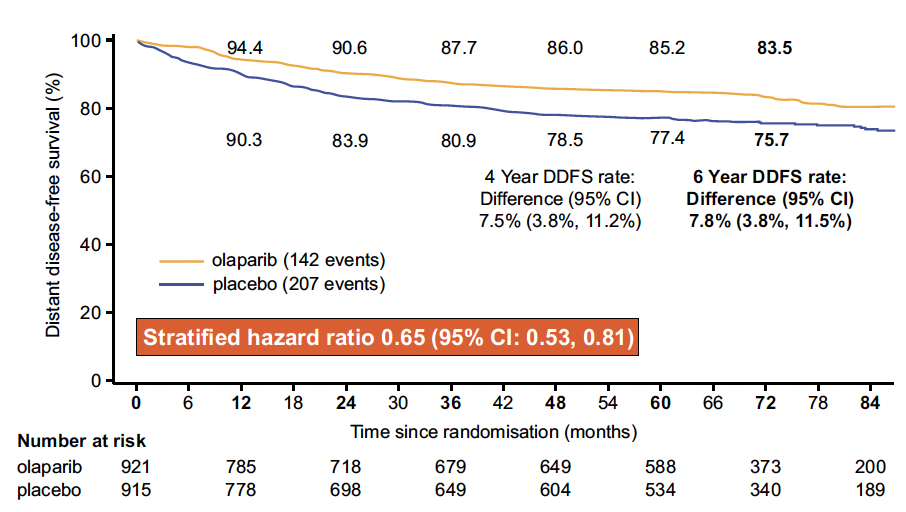
Avec un suivi médian de 6,1 ans, la SSM était de 79,6 % dans le bras olaparib contre 70,3 % dans le bras placebo (HR : 0,65 (0,53-0,78)). En SG, 87,5 % des patientes traitées par olaparib étaient en vie à 6 ans contre 83,2 % dans le bras placebo (0,72 (0,56-0,93) (Fig. 8).
Figure 8 – OlympiA : survie sans maladie.
Ces résultats confirment l’intérêt majeur de ce traitement chez les patientes mutées BRCA à haut risque et donc du diagnostic onco-génétique dans cette population.
• Garber J et al. GS1-09: OlympiA: A phase 3, multicenter, randomized, placebo-controlled trial of adjuvant olaparib after (neo)adjuvant chemotherapy in patients w/ germline BRCA1 & BRCA2 pathogenic variants & highrisk HER2-negative primary breast cancer. SABCS 2024 : SESS-1568.
neoHIP : quelle efficacité des traitements multimodaux en situation néoadjuvante ?
L’étude neoHIP est un essai de phase II qui a examiné l’ajout du pembrolizumab, un anti-PD-1, au traitement néoadjuvant standard du cancer du sein HER2+ à un stade précoce. L’étude visait à déterminer si l’association améliore les taux de pCR par rapport au traitement standard seul.
Les résultats montrent que le taux de pCR était significativement plus élevé dans le groupe pembrolizumab que dans le groupe de traitement standard. Des améliorations ont également été observées dans la SSE et les TRO. L’ajout du pembrolizumab a été associé à une augmentation des événements indésirables d’origine immunitaire, notamment la thyroïdite et la colite, mais ceux-ci étaient généralement gérables.
Les résultats suggèrent que le pembrolizumab pourrait améliorer l’efficacité du traitement néoadjuvant dans le cancer du sein HER2+, mais des études supplémentaires sont nécessaires pour confirmer les résultats et l’innocuité à long terme.
• McArthur H et al. RF3-05: A phase 2 study of neoadjuvant HER2-targeted therapy ± immunotherapy with pembrolizumab (neoHIP). SABCS 2024 : SESS-2436.
ELEVATE : l’élacestrant est-il une option de traitement dans les cancers ER+/HER2- avancés et résistants aux thérapies hormonales ?
L’étude ELEVATE a évalué l’élacestrant, un SERD oral (Selective Estrogen Receptor Degrader), chez les patientes atteintes de cancers du sein ER+/HER2- avancés et résistants aux thérapies hormonales. Les résultats ont montré une prolongation de la SSP médiane à 8,6 mois (IC 95 % : 7,8-9,4) dans le groupe élacestrant par rapport à 5,3 mois (IC 95 % : 4,6-6,0) dans le groupe contrôle. Le taux de SG à 18 mois était de 73 % (IC 95 % : 66-80) pour l’élacestrant contre 61 % (IC 95 % : 54-68) dans le bras standard.
Ces données confirment le rôle de l’élacestrant comme une option de traitement préférable dans cette population de patientes.
• Rugi HS et al. PS7-06: Elacestrant combinations in patients with estrogen receptor-positive (ER+), HER2-negative (HER2-) locally advanced or metastatic breast cancer (mBC): Update from ELEVATE, a phase 1b/2, open-label, umbrella study. SABCS 2024 : SESS-1889.
Conclusion
Le SABCS 2024 a mis en lumière des avancées considérables dans divers aspects de la prise en charge du cancer du sein. Ces études ouvrent des perspectives prometteuses pour l’amélioration des traitements, la personnalisation des soins et le bien-être global des patientes. Les oncologues médicaux auront un rôle clé dans l’intégration de ces données dans la pratique clinique.
Alessandro Viansone déclare avoir des liens d’intérêt avec Lilly, Pfizer, Seagen, Gilead, Novartis, AstraZeneca, Samsung, Eisai.
Philippe Toussaint déclare avoir des liens d’intérêt avec Pfizer, Novartis, Lilly, AstraZeneca, GSK, MSD, Daiichi Sankyo, Roche, Gilead.