1/ 2023 : une édition particulière avec les 30 ans d’ARCAGY-GINECO !
Pr Isabelle Ray-Coquard, Dr Anne-Claire Hardy-Bessard, Bénédicte Votan
Quels ont été les moments forts de ces rencontres ?
Dr Anne-Claire Hardy-Bessard : Clairement, le bilan de 30 ans montre une collaboration étroite d’oncologues issus de structures différentes, une force de recrutement remarquable, une grande qualité de notre équipe opérationnelle ARCAGY, la reconnaissance au premier plan international et de nombreuses études ayant changé les pratiques et le pronostic de nos patientes.
Pr Isabelle Ray-Coquard : Je rajouterais le partage des connaissances, des résultats des études promues par le GINECO, des succès, des échecs, dont on apprend toujours plus, et l’arrivée très en force des plus jeunes.
Bénédicte Votan : Cette année était particulière, car nous fêtions nos 30 ans et il y a eu beaucoup de moments forts, mais, incontestablement, la rétrospective sur les 30 ans du groupe était un des moments forts ! Voir comment le groupe a évolué et voir tout ce qu’il a construit est impressionnant et donne une certaine fierté !
Quel est le bilan du GINECO pour 2022 ?
Bénédicte Votan : Le bilan est très bon, avec 1 300 inclusions, 106 centres actifs, 24 études ouvertes aux inclusions et 18 publications. Une année record en termes de publications !
Pr Isabelle Ray-Coquard : Ce fut une belle année de travail et de succès objectivés par les chiffres et le sourire des participants.
Dr Anne-Claire Hardy-Bessard : Le bilan 2022, au-delà des chiffres, est l’implication et le partage avec une nouvelle génération d’oncologues, très motivés et très impliqués.
Quels sont les faits marquants de l’année ?
Bénédicte Votan : Le lancement de nos deux grandes études internationales, NIRVANA-1, dans le cancer de l’ovaire, et DOMENICA, dans le cancer de l’endomètre, ont été très certainement deux des faits marquants de l’année.
Pr Isabelle Ray-Coquard : Je pense aux données de survie globale positive pour les HRD+ avec le traitement PAOLA-1 qui nous a montré plus de 50 % des patientes vivantes à plus de 5 ans (publié dans Annals of Oncology) avec cette combinaison et à l’arrivée de l’immunothérapie dans les cancers utérins qui ont fait l’objet de deux publications dans The New England Journal of Medicine auxquelles le GINECO était bien sûr associé.
Dr Anne-Claire Hardy-Bessard : Après l’importance des résultats de PAOLA-1, l’arrivée de l’immunothérapie dans les cancers du col de l’utérus et de l’endomètre sont les événements marquants de 2022
Quels sont les prochains enjeux et challenges pour l’avenir ?
Bénédicte Votan : Le challenge pour cette année sera de réussir à faire démarrer dans tous les pays prévus les deux études internationales NIRVANA-1 et DOMENICA. Pour l’instant, seuls quelques pays sont ouverts et l’objectif est d’ouvrir tous les pays dans les tout prochains mois, ce qui, avec la nouvelle réglementation européenne, est aussi un nouveau challenge !
Pr Isabelle Ray-Coquard : Il s’agit de toujours maintenir la gynécologie au cœur des innovations, d’inviter les ADC dans la prise en charge de ces patientes qui ont besoin de plus d’options pour améliorer leur devenir et bien sûr de transmettre nos valeurs aux plus jeunes pour la suite.
Dr Anne-Claire Hardy-Bessard : Nous devons rester au premier plan scientifique international, assurer la continuité et la transmission de nos valeurs.
Isabelle Ray-Coquard déclare ne pas avoir de liens d’intérêt en rapport avec cet article. Anne-Claire Hardy Bessard déclare avoir des liens avec AstraZeneca, Clovis, GSK, MSD, Novartis, Pfizer, Roche.
2/ Le GINECO à l’heure des tests HRD
Dr Romane Gille – D’après la présentation du Dr Manuel Rodrigues (Paris)
L’importance de la détermination du statut HRD (Homologous Recombination Deficiency) par un test HRD ne fait plus débat depuis les résultats de l’étude PAOLA-1 présentés à
l’ESMO 2019 (1), et leur réalisation de manière systématique chez les patientes atteintes d’un cancer de l’ovaire avancé fait notamment partie des récentes recommandations de Saint-Paul-de-Vence 2023 (2).
Qu’est-ce que l’HRD ?
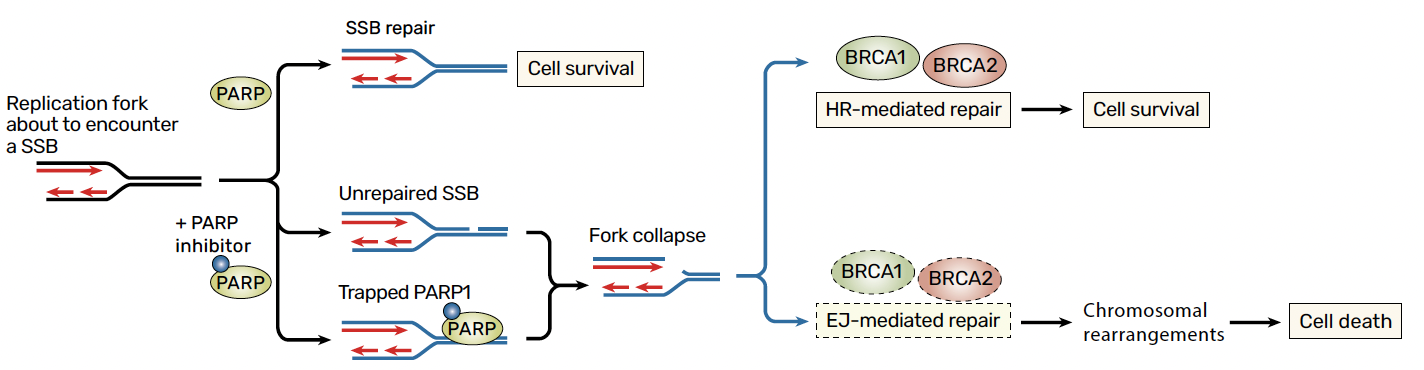
En présence d’une cassure simple brin (single-strand break, SSB), les enzymes PARP marquent la lésion afin de déclencher le processus de réparation de l’ADN, permettant ainsi la mitose sans accumulation de lésions et, in fine, la survie de la cellule. Lorsque ces enzymes sont inhibées par des médicaments tels que les inhibiteurs de PARP (iPARP), la cassure simple brin n’est pas réparée et aboutit à une cassure double brin durant la réplication lorsque la fourche de réplication arrive à cette lésion (Fig. 1). Un système de réparation des cassures double brin va alors s’activer. Le système de réparation par recombinaison homologue est le seul de ces mécanismes à être fidèle, c’est-à-dire capable de réparer sans erreur, sans induire de mutation. Cela permet la survie de la cellule avec un génome indemne. En cas de système déficient, c’est à dire HRD, d’autres systèmes de réparation sont alors activés, mais ces systèmes sont moins efficaces et responsables d’erreurs, aboutissant à des mutations, voire à la mort cellulaire.
Figure 1 – Schéma simplifié du fonctionnement des inhibiteurs de PARP (3).
Les protéines BRCA1 et 2 font partie du système de recombinaison homologue, et leur déficience est la cause la plus courante d’HRD, mais il existe en fait de très nombreuses protéines qui interviennent autour de BRCA1 et 2, dont les rôles ne sont pas tous définis. De plus, rechercher seulement les mutations de chacune de ces protéines détermine mal le statut HRD et le bénéfice d’un iPARP.
Comment diagnostiquer HRD ?
Il existe quatre manières de diagnostiquer une déficience de la recombinaison homologue.
• Chercher la cause : rechercher des mutations dans les gènes de la voie de la recombinaison homologue, comme BRCA1 et BRCA2, en tissu tumoral et en constitutionnel, ou d’autres gènes.
• Chercher un défaut fonctionnel :
– en recherchant des altérations de l’expression des gènes ;
– en recherchant en temps réel un déficit de la recombinaison homologue, par exemple, par la mise en évidence d’absence de formation de foci RAD51.
• Chercher les cicatrices des événements génétiques passés : il s’agit de rechercher les conséquences de l’HRD lors de la tumorigenèse. La recherche de ces cicatrices génomiques est la base des tests HRD.
Principe des signatures HRD
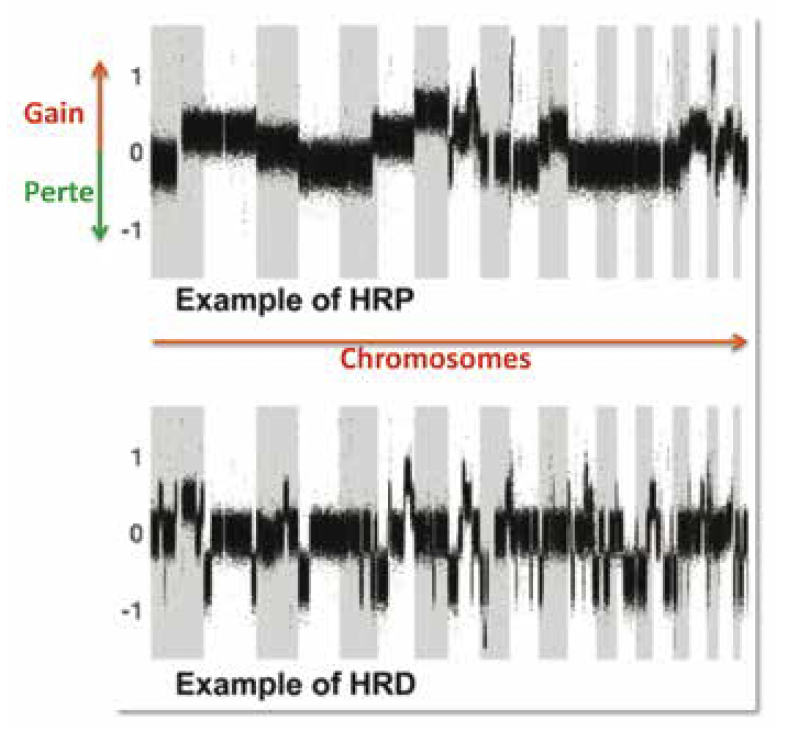
Bien qu’il semble qu’il y ait un plus grand nombre de cassures dans les HRD, en réalité il n’en existe pas plus que dans les HRP (Fig. 2).
Figure 2 – Exemple d’une signature HRP (Homologous Recombination Proficient) et d’une signature HRD.
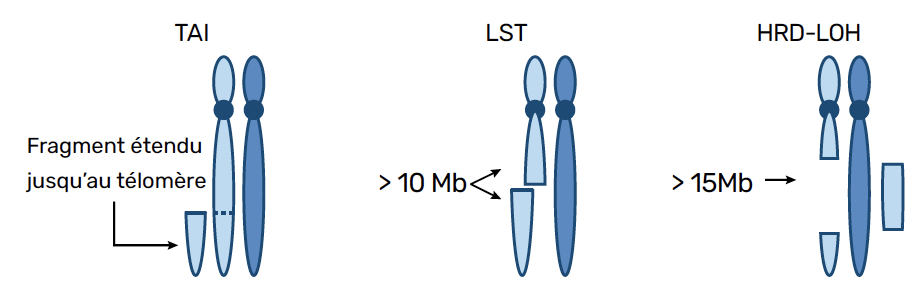
Pour cette raison, les tests HRD évaluent plusieurs caractéristiques phénotypiques de la tumeur HRD, et les pondèrent en un score. Il existe trois types de caractéristiques phénotypiques (Fig. 3) :
• test TAI : si la cassure s’étend jusqu’au télomère, il y a plus de probabilités qu’il s’agisse d’un cancer HRD ;
• test LST : si la cassure est un gain ou une perte de plus de 10 Mb, il y a plus de chance qu’il s’agisse d’un cancer HRD ;
• test HRD-LOH : s’il y a perte d’hétérozygotie, c’est-à-dire s’il y a une perte de plus de 15 Mb, il y a plus de chance qu’il s’agisse d’un cancer HRD.
Figure 3 – Caractéristiques phénotypiques de la tumeur HRD.
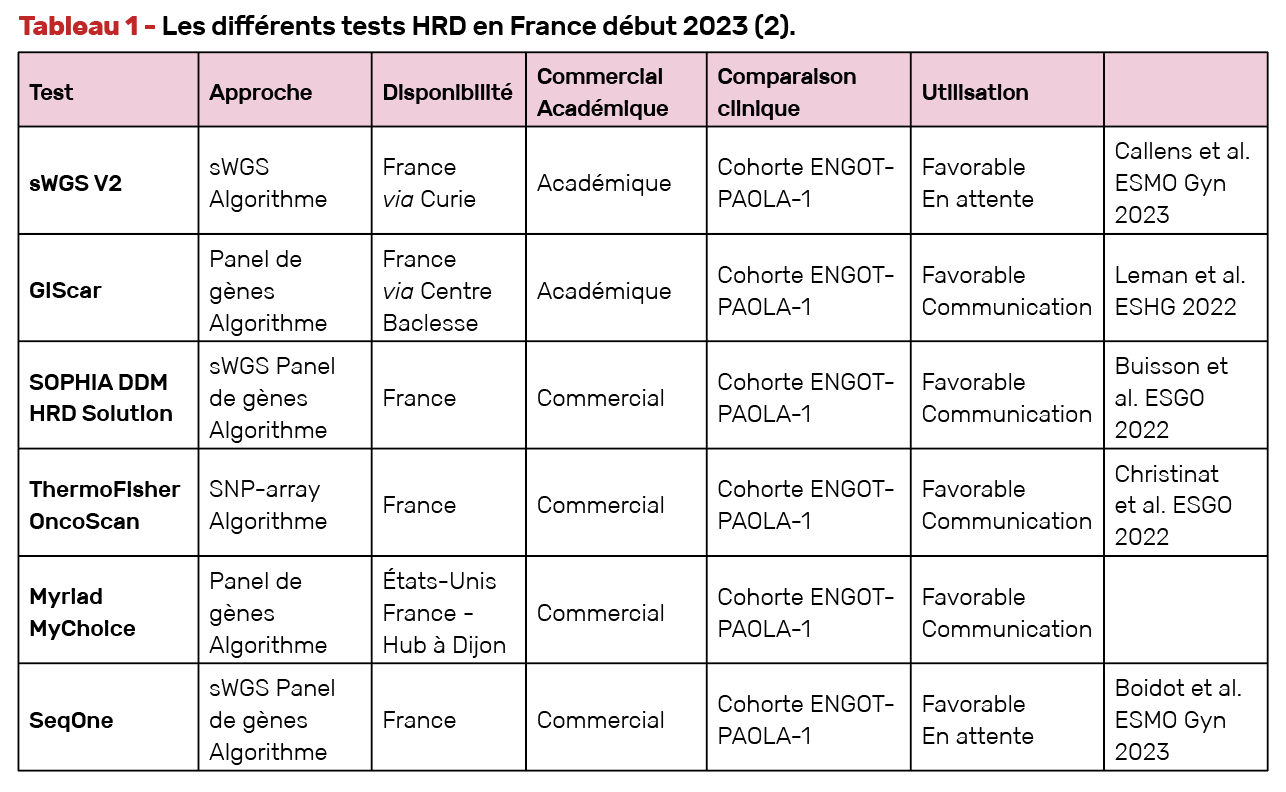
Quels tests HRD en France ?
Il existe dorénavant cinq autres tests validés sur la cohorte PAOLA-1, avec des résultats similaires au test Myriad, qui ont été présentés à l’ESMO Gynae 2023, l’ESHG et l’ESGO 2022. Le point fort de ces nouveaux tests par rapport au test Myriad est qu’ils ont un nombre de résultats dits non contributifs bien moindre. En effet, avec Myriad, le taux de non contributifs était de l’ordre de 15 versus 1 à 3 % avec les nouveaux tests (Tab. 1).
Quid du remboursement ?
En mai 2023, la question n’est pas résolue, mais des discussions sont en cours. La tarification actuelle s’inscrit dans le RIHN (Référentiel des actes innovants hors nomenclature). Il existe plusieurs cotations possibles allant de 880 à 2 200 euros, selon la taille du séquençage. Le remboursement réel pour l’établissement n’équivaut en réalité qu’à 50 % de cette somme. Courant 2023, le remboursement devrait être intégré au GHS des hôpitaux. Le montant et les modalités restent cependant inconnus à ce jour, mais il y a un fort risque d’une diminution de la prise en charge hospitalière des tests HRD tandis que la CCAM pourrait être avantageuse au risque de l’externalisation de cette technique.
Conclusion
Le statut BRCA et le statut HRD sont désormais des indispensables pour la prise en charge des femmes atteintes de cancers séreux de haut grade de l’ovaire. Il existe maintenant cinq tests HRD en France qui sont de véritables alternatives au test Myriad, car ils sont fiables, validés dans PAOLA-1, et moins chers. Les futurs enjeux sont les modalités de remboursement, l’homogénéisation, notamment à l’international pour les essais cliniques, et l’amélioration de ces tests afin, peut-être, d’affiner par sous-groupes les tumeurs HRD ou HRP.
Bibliographie
1. Ray-Coquard I, Pautier P, Pignata S et al. Olaparib plus bevacizumab as first-line maintenance in ovarian cancer. N Engl J Med 2019 ; 381 : 241-28.
2. GINECO. Recommandation Saint-Paul-de-Vence 2023. Disponible sur : arcagy.org/gineco/2659.
3. Dias MP, Moser SC, Ganesan S, Jonkers J. Understanding and overcoming resistance to PARP inhibitors in cancer therapy. Nat Rev Clin Oncol 2021 ; 18 : 773-91.
3/ L’avenir du GINECO. What’s next?
Dr Romane Gille – D’après la présentation du Dr Alexandra Leary (Paris)
La présentation du Dr Alexandra Leary avait pour objectif d’émettre des idées, des stratégies, voire des philosophies, afin de guider la recherche et le développement des essais cliniques au sein du GINECO sur les 10 à 15 prochaines années.
La promotion de la recherche académique
L’un des points forts du groupe GINECO est la recherche académique. Au fil des années, il a su monter de grands essais, seul ou en collaboration avec les industriels. On peut citer parmi les grands essais à promotion du GINECO, mais en partenariat avec l’industrie, des essais :
• de phase I comme INeOV,
• de phase II comme TEDOVA,
• de phase III comme PAOLA-1…
et ce, jusqu’à l’obtention d’une AMM.
Le groupe GINECO doit poursuivre la promotion de la recherche académique, en permettant :
• des essais à participations diverses (CHU, CLCC, CH, privé…),
• des essais purement académiques comme des essais de traitements locaux ou de désescalade qui ne seront pas lancés par les industriels,
• des cohortes de vraie vie,
• des cohortes de tumeurs,
• des essais hybrides imaginés par le GINECO et sponsorisés par l’industrie permettant l’accès à de nouvelles molécules…
Tout cela afin de changer les pratiques.
Faire preuve d’audace
De l’innovation
Afin de continuer à promouvoir la recherche académique, le GINECO va devoir continuer à mener l’innovation, comme cela a été le cas avec les inhibiteurs de PARP dans le cancer de l’ovaire HRD. Il s’agira le plus souvent de résister à l’envie d’appliquer une stratégie thérapeutique qui fonctionne dans un autre organe, comme par exemple l’immunothérapie et ses quatre études de phase III négatives dans le cancer de l’ovaire, pour être plutôt audacieux et innovant, en proposant de nouvelles stratégies qui n’ont pas encore été testées, comme le fait actuellement l’essai DOMENICA dans le cancer de l’endomètre MSI, qui propose une première ligne de traitement sans chimiothérapie.
Il faudra sortir de sa zone de confort et aller vers des essais ou des cohortes de phase I dédiés aux tumeurs gynécologiques, ce qui aurait quatre avantages :
1) avoir un accès plus tôt aux nouvelles molécules,
2) acquérir de l’expérience avec ces nouvelles molécules : apprendre à les manier, connaître leurs toxicités avant leur arrivée en phase III,
3) générer les premières données d’efficacité,
4) développer une relation de confiance avec l’industrie.
Tous ces avantages mèneraient ensuite au bon développement de phases II et III.
Cette démarche de promouvoir des essais précoces first in human dédiés aux tumeurs gynécologiques a déjà commencé. Par exemple, l’essai GYNET est un essai de phase I qui teste le NP137 dans le cancer de l’endomètre et du col ; ou encore dans le cancer de l’ovaire où un essai de phase I teste un inhibiteur de WEE1 (ZN-c3) en association avec un inhibiteur de PARP.
Les anticorps conjugués
Enfin, après les vagues des inhibiteurs de PARP et de l’immunothérapie, la nouvelle vague de thérapies innovantes qui afflue ces dernières années sur l’oncologie est évidemment l’arrivée des anticorps conjugués. Le nombre de cibles en développement est en croissance exponentielle et l’on pourra dans le futur virtuellement commander n’importe quel anticorps conjugué à n’importe quelle molécule de chimiothérapie. Il s’agira donc de prendre tôt cette vague et d’en tirer le meilleur profit, d’autant plus que les cancers gynécologiques sont sensibles à la chimiothérapie.
Il faudra être audacieux, mais aussi savoir réutiliser les modèles qui fonctionnent, comme le modèle du néoadjuvant, bien connu du GINECO.
Combler les trous dans la raquette : les besoins médicaux non assouvis…
Dans le cancer de l’ovaire
Les rechutes sous inhibiteurs de PARP
Malgré d’énormes progrès avec les inhibiteurs de PARP, lorsque les patientes rechutent sous inhibiteurs de PARP, les propositions thérapeutiques sont limitées. L’essai SOLO2 a montré que les sels de platine avaient peu d’efficacité post inhibiteurs de PARP, et l’essai OREO a montré une efficacité qui reste modeste du rechallenge. Le GINECO se doit de faire de la recherche pour les patientes progressant sous ou post inhibiteurs de PARP, une priorité. Des essais cliniques sont en cours avec de nouvelles pistes : TEDOVA, association WEE1 et inhibiteur de PARP…
Les patientes HRP
Peu de progrès ont été faits pour les patientes HRP (non-HRD), dont la survie reste très mauvaise avec les traitements actuels. Dans l’étude PRIMA, la médiane de SSP était de 8 mois. Des pistes sont en cours d’investigation, par exemple avec le projet SALVOVAR (adaptation du protocole de chimiothérapie en rattrapage). Côté innovation, il faut identifier de nouvelles thérapies ciblées efficaces pour les HRP. Là encore, le GINECO se doit d’en faire une priorité, puisque les patientes HRP correspondent à la moitié des patientes atteintes d’un cancer de l’ovaire avancé.
Dans le cancer de l’endomètre
Actuellement, toutes les patientes vont recevoir de l’immunothérapie en deuxième ligne, soit dans l’association lenvatinib-pembrolizumab, soit en monothérapie en cas de statut MSI. Mais qu’en sera-t-il alors pour la ligne suivante ? De plus, l’immunothérapie va bientôt monter en première ligne… Deux essais ont confirmé l’intérêt d’ajouter le pembrolizumab ou le dostarlimab à une chimiothérapie par carboplatine et paclitaxel. L’une des priorités pour le GINECO sera donc également de trouver des solutions pour le cancer de l’endomètre post-immunothérapie. Il faudra alors prendre en compte l’importance de la classification moléculaire, et faire des essais cliniques adaptés à cette dernière.
Dans le cancer du col de l’utérus
L’étude KEYNOTE-826 a montré une amélioration de la SSP et de la SG avec l’association immuno-chimiothérapie chez les patientes PD-L1 positives en première ligne, avec une SSP médiane qui passe de 8,2 à 10,4 mois (HR = 0,62 ; IC 95 % = 0,53-0,79). Malgré une différence significative, il faudrait faire mieux qu’un gain de 2 mois en SSP, et s’attacher à développer de nouvelles immunothérapies ou doubles immunothérapies en première ligne pour les cancers du col avancés.
Dans les tumeurs rares gynécologiques
Le groupe GINECO est un leader en essais thérapeutiques sur les tumeurs rares, et même dans les essais de phase III randomisés. Les tumeurs rares sont des tumeurs hétérogènes, qui nécessitent donc des thérapies personnalisées, avec des essais adaptés aux profils moléculaires. Une piste est déjà en cours d’investigation dans ce sens, avec l’essai BOUQUET pour les tumeurs épithéliales de l’ovaire. La prochaine étape pourrait être d’étendre cette stratégie aux autres tumeurs rares gynécologiques.
Conclusion
Bien que l’on ne puisse pas savoir à l’avance le futur du GINECO, plusieurs axes de développement et de renforcement de ses atouts ont été proposés :
• promouvoir la recherche académique,
• se lancer dans l’innovation et sortir des sentiers battus…
De nombreuses pistes ont déjà été lancées par les acteurs du GINECO. Nous avons hâte de découvrir la suite.
4/ ATALANTE : une tragédie grecque ?
Dr Romane Gille – D’après la présentation du Pr Jean-Emmanuel Kurtz (Strasbourg)
L’essai ATALANTE est une étude internationale de phase III, pilotée par le groupe GINECO, randomisée, en double aveugle, qui évaluait l’intérêt de l’atézolizumab chez des patientes en rechute platine-sensible d’un cancer épithélial de l’ovaire, des trompes de Fallope ou du péritoine, en association à une chimiothérapie à base de platine et au bévacizumab. Les résultats ont été présentés à l’ESMO 2022.
Rationnel
Pour les patientes présentant une rechute avec un intervalle libre de plus de 6 mois après la dernière chimiothérapie à base de platine (rechute dite platine-sensible), le standard de traitement est une bichimiothérapie associant du carboplatine avec soit de la doxorubicine liposomale pégylée (Caelyx®), soit de la gemcitabine, soit du paclitaxel. Lorsque l’on ajoute le bévacizumab à cette chimiothérapie, cela permet une amélioration du taux de réponse et de la survie sans progression (SSP).
En ce qui concerne l’immunothérapie par inhibiteurs de checkpoints, il existe des données montrant un signal de réponse dans le cancer de l’ovaire. Dans d’autres tumeurs, son bénéfice a été largement démontré lorsqu’elle est ajoutée à la chimiothérapie.
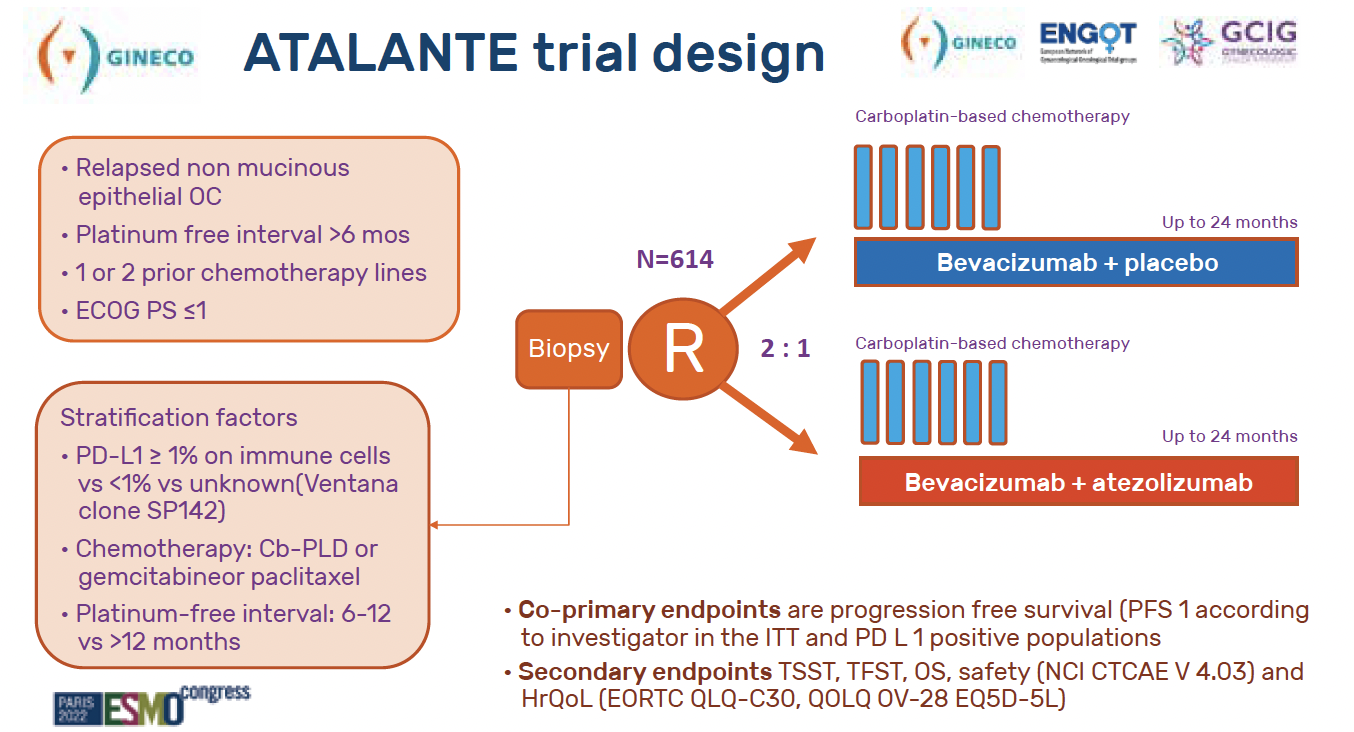
Design de l’essai (Fig. 1)
Au total, 614 patientes ont été incluses. Elles devaient être atteintes d’un cancer épithélial de l’ovaire en rechute platine-sensible, avoir été traitées antérieurement par une ou deux lignes de chimiothérapie, et être en bon état général (PS 0 ou 1).
Figure 1 – Design de l’étude ATALANTE.
Il était prévu une stratification sur le PD-L1 (< 1 ou ≥ 1 %), sur la combinaison de chimiothérapie reçue, et sur l’intervalle libre sans platine (entre 6 et 12 mois ou > 12 mois). Une biopsie tumorale était obligatoire avant l’entrée dans l’étude.
Les patientes étaient randomisées en 2:1 entre :
• chimiothérapie bévacizumab et placebo
• versus chimiothérapie bévacizumab et atézolizumab.
La maintenance pouvait durer jusqu’à 2 ans.
Objectifs
L’objectif principal était un co-
objectif principal :
• la SSP en intention de traiter (ITT)
• et la SSP dans la population PD-L1+.
La survie globale (SG) faisait partie des objectifs secondaires.
Statistiques
Du fait d’un co-objectif principal, le risque alpha a été divisé en deux. Il fallait donc pour atteindre la significativité un p < 0,025 pour la SSP en ITT et un p < 0,025 pour la SSP dans la population PD-L1+.
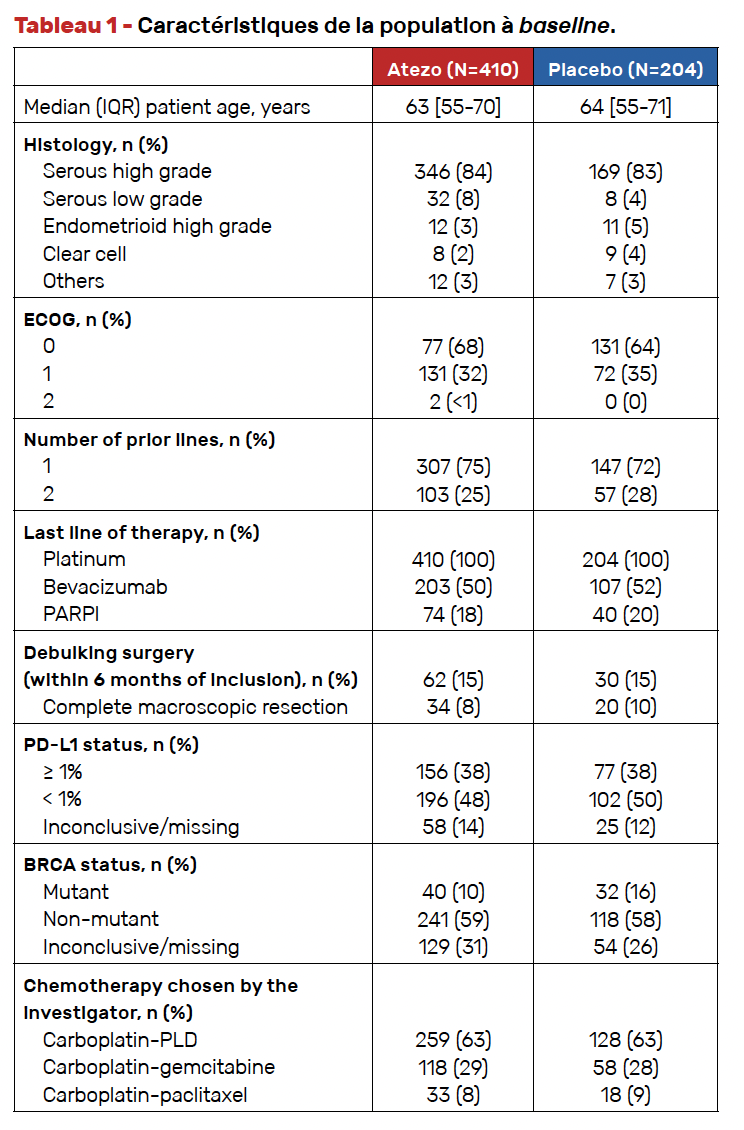
Caractéristiques de la population (Tab. 1)
La population était bien équilibrée. Il s’agissait majoritairement de patientes atteintes d’un carcinome séreux de haut grade (84 %), en deuxième ligne de traitement (75 %), traitées antérieurement par carboplatine Caelyx® (63 %).
Le taux de positivité de PD-L1 était de 38 %, un chiffre plus bas que ce qui était attendu.
La durée d’exposition au traitement était de 11,1 mois dans les deux groupes.
Résultats
Objectif principal
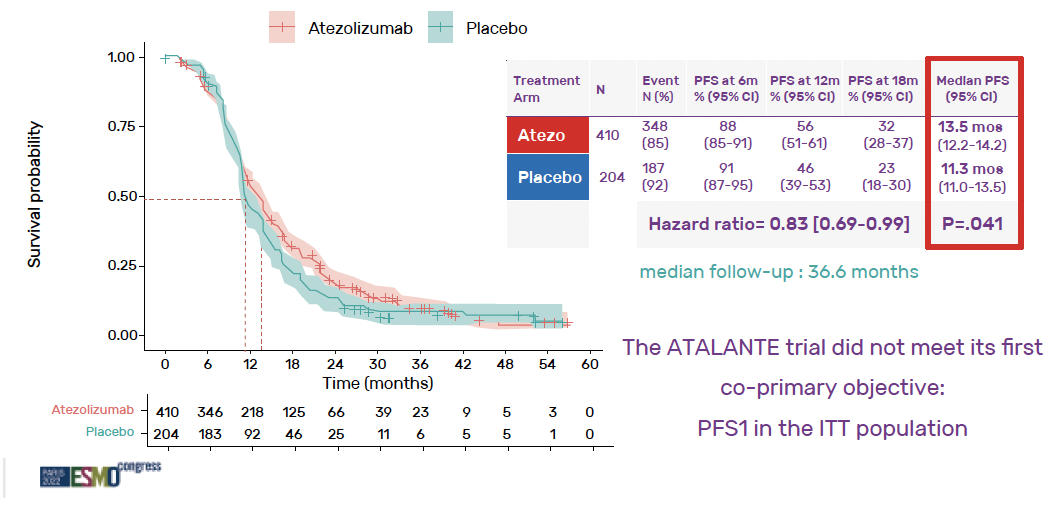
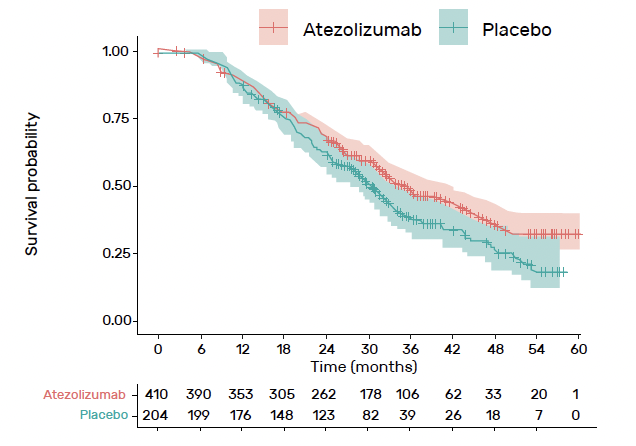
Le suivi médian était de 36,6 mois. La SSP médiane en ITT était de
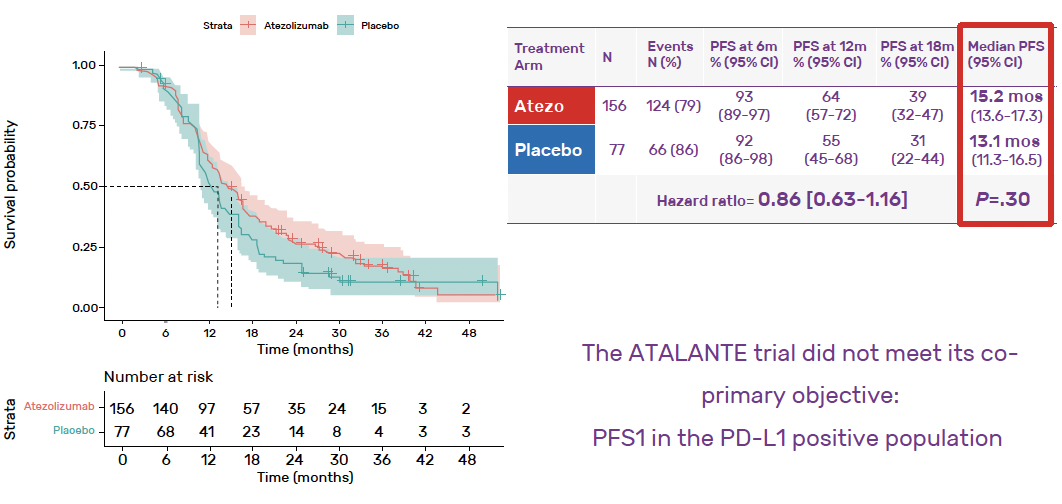
13,5 mois avec l’atézolizumab versus 11,3 mois avec placebo, soit un p à 0,04, donc non significatif (Fig. 2). La SSP médiane dans la population PD-L1+ était de 15,2 mois avec l’atézolizumab versus 13,1 mois avec placebo, soit un p à 0,30, donc non significatif (Fig. 3).
Figure 2 – Survie sans progression en ITT.
Figure 3 – Survie sans progression dans la population PD-L1+.
L’essai est par conséquent négatif sur son co-objectif principal.
Dans les analyses en sous-groupes réalisées, il n’a pas non plus été mis en évidence de signal pour l’un des sous-groupes, y compris pour la population CD8+, malgré un rationnel immunologique important.
Objectifs secondaires
Le temps jusqu’au second traitement ultérieur était de 23,9 mois avec l’atézolizumab versus 21,4 mois avec le placebo, soit une différence de 2,5 mois non significative.
Sous réserve de données non matures, on note une survie globale de 35,5 mois avec l’atézolizumab versus 30,6 mois avec le placebo, une tendance en faveur de l’atézolizumab sans que cela soit toutefois comparable ou significatif (Fig. 4).
Figure 4 – Survie globale en ITT.
Effets indésirables
Au niveau des effets indésirables, il n’y a pas de nouvel élément notable. La toxicité était celle connue et attendue avec l’immunothérapie.
Il n’y avait pas de différence dans la qualité de vie entre les deux groupes.
Conclusion
L’essai ATALANTE échoue à montrer un bénéfice de l’immunothérapie en association avec la chimiothérapie et le bévacizumab dans la rechute platine-sensible. Il existe probablement des patientes qui bénéficient de l’immunothérapie, mais nous ne sommes pas en capacité de les sélectionner à l’heure actuelle. Le PD-L1 n’est pas un bon critère.
Cependant, on peut espérer qu’ATALANTE, tout comme CHIVA, pourra donner lieu à des études complémentaires, notamment sur le plan translationnel, grâce au matériel tumoral qui a été collecté.
5/ Les actions d’IMAGYN en 2022-2023
Coralie Marjollet
Quelles ont été les actions d’IMAGYN envers les institutions pour faire progresser les droits des usagers ?
L’année 2022 a été une année particulièrement riche sur ce point. L’action d’IMAGYN en tant qu’association agréée par le ministère de la Santé et de la Prévention a porté sur l’amélioration de la prise en charge des patientes atteintes de cancer de l’ovaire, l’accès aux innovations thérapeutiques dans le cancer du col avancé, qui n’avait pas bénéficié d’avancées thérapeutiques majeures depuis de longues années et l’élargissement des compétences en matière de vaccination, dont le vaccin HPV par les infirmiers, les pharmaciens et les sages-femmes chez les enfants et adolescents à partir de 16 ans.
En effet, la participation d’IMAGYN à l’émission de Cash investigation en janvier 2022 et différentes actions auprès de parlementaires et du ministère ont participé à la signature du décret en avril 2022 sur les critères de qualité d’accès aux soins dans le cancer de l’ovaire avec une mise en œuvre progressive attendue en juin 2023.
IMAGYN a également répondu à plusieurs questionnaires de la Haute autorité de santé (HAS) sur l’accès précoce et le remboursement de nouvelles thérapeutiques et est intervenu en commission plénière de la HAS fin août 2023 pour la nouvelle indication dans le traitement des patientes atteintes d’un cancer du col de l’utérus persistant, récidivant ou métastatique.
Et, tout au long de l’année, IMAGYN a agi auprès des institutions pour demander la mise en place de mesures en faveur de la vaccination HPV et a participé à la création du collectif Demain sans HPV composé d’une dizaine d’associations portées par le même objectif : 80 % des jeunes filles et des jeunes garçons vaccinés contre les virus HPV à l’horizon 2030 selon les préconisations de l’OMS.
Quelles actions d’accompagnement avez-vous mises en œuvre en 2022 ?
Avec le soutien des médecins du GINECO et de la SFCO, nous avons continué à organiser des webinaires autour des questions des patientes et des proches : « Cancer, phytothérapie, compléments alimentaires et autres, démêler le vrai du faux » et « Vers l’éradication des cancers liés à l’HPV ».
En parallèle, nous avons réalisé deux nouveaux livrets pédagogiques : « Mutations génétiques et cancer de l’ovaire : comprendre et en parler » et « Médecines complémentaires, ce qu’il faut savoir ».
La tournée du COCON, projet réalisé en partenariat avec GSK, est repartie pour neuf villes en 2022 pour aller au plus près des patientes et des proches pour les accompagner dans leur parcours de soins.
IMAGYN a renforcé son soutien auprès des patientes avec la participation d’une psychologue dans les Cafés IMAGYN et le remboursement de consultations d’onco-psychologie pour les adhérentes.
Dans le cadre de vos missions d’information et de sensibilisation, comment IMAGYN a pu intervenir ?
Au sein de l’exposition Cancers à la Cité des sciences et de l’industrie, IMAGYN a diffusé ses trois spots de sensibilisation grand public afin d’inciter à la prévention et au dépistage de ces cancers méconnus et tabous.
Et, Septembre turquoise, mois de sensibilisation aux cancers gynécologiques, a donné lieu cette année à une présence exceptionnelle de l’association dans les établissements de santé avec plus de 50 stands partout en France.
Quel est le programme prévu pour cette année 2023 ?
Nous allons continuer, avec le collectif Demain sans HPV, à diffuser une information coordonnée aux parents et aux jeunes pour favoriser la vaccination et demander aux pouvoirs publics le remboursement de la vaccination de rattrapage pour les filles et les garçons, quelle que soit leur orientation sexuelle de 19 à 26 ans.
Le COCON va repartir pour une tournée dans de nouvelles villes avec ses ateliers animés en binôme par des professionnels de santé et des référentes IMAGYN pour favoriser l’échange autour de la maladie.
Plusieurs webinaires sont déjà prévus : le 14 juin sur le « Cancer de l’endomètre » et d’autres pour Septembre turquoise. Et cette année, en complément des stands, des Semaines turquoise avec des ateliers seront organisées dans certains centres.
Nous vous invitons à suivre toute notre actualité sur le site : www.imagyn.org.